குளோரின் ஐம்புளோரைடு
| |||

| |||
| இனங்காட்டிகள் | |||
|---|---|---|---|
| 13637-63-3 | |||
InChI
| |||
| யேமல் -3D படிமங்கள் | Image | ||
| பப்கெம் | 61654 | ||
| வே.ந.வி.ப எண் | FO2975000 | ||
SMILES
| |||
| பண்புகள் | |||
| ClF5 | |||
| வாய்ப்பாட்டு எடை | 130.445 கி மோல்−1 | ||
| தோற்றம் | நிறமற்ற வாயு | ||
| அடர்த்தி | 4.5 கி/செ.மீ3 | ||
| உருகுநிலை | −103 °C (−153 °F; 170 K) | ||
| கொதிநிலை | −13.1 °C (8.4 °F; 260.0 K) | ||
| நீராற்பகுப்பு அடைகிறது. | |||
| கட்டமைப்பு | |||
| மூலக்கூறு வடிவம் | |||
| வெப்பவேதியியல் | |||
| Std enthalpy of formation ΔfH |
−238.49 கியூ மோல்−1 | ||
| நியம மோலார் எந்திரோப்பி S |
310.73 J K−1 mol−1 | ||
மாறுதலாக ஏதும் சொல்லவில்லை என்றால் கொடுக்கப்பட்ட தரவுகள் யாவும் பொருள்கள் அவைகளின் இயல்பான வெப்ப அழுத்த நிலையில் (25°C, 100kPa) இருக்கும். | |||
| | |||
| Infobox references | |||
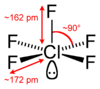
குளோரின் ஐம்புளோரைடு (Chlorine pentafluoride) என்பது ClF5. என்ற மூலக்கூற்று வாய்ப்பாடு கொண்ட கனிம வேதியியல் சேர்மமாகும். நிறமற்ற இந்த இடை உப்பீனி சேர்மம் ஒரு வலிமையான ஆக்சிசனேற்றியாகும். ஒருகாலத்தில் ராக்கெட்டுகளுக்கு ஆக்சிசனேற்றியாக இது பயன்படுத்தப்பட்டது. குளோரின் ஐம்புளோரைடு மூலக்கூறு C4v சமச்சீர் கொண்ட சதுர பிரமீடு அமைப்பை ஏற்றுள்ளது[1]. அணுக்கருக் காந்த ஒத்ததிர்வு நிறமாலை முடிவும் இதை உறுதிப்படுத்துகிறது[2]
தயாரிப்பு[தொகு]
இச்சேர்மத்தின் தயாரிப்பு ஆய்வுகள் குறித்த பண்டைய முறைகள் சில வகைப்படுத்தப்பட்டுள்ளன[3][4]. முதன்முதலில் குளோரின் முப்புளோரைடை உயர் வெப்பநிலை மற்றும் அழுத்தத்தில் புளோரினேற்றம் செய்து குளோரின் ஐம்புளோரைடு தயாரிக்கப்பட்டது.
- ClF3 + F2 → ClF5
NiF2 இவ்வினைக்கு வினையூக்கியாக செயல்பட்டது.[5]
KClF4, RbClF4, CsClF4 போன்ற சில உலோக புளோரைடுகள் புளோரினுடன் வினைபுரிந்து குளோரின் ஐம்புளோரைடையும் அதனுடன் தொடர்புடைய காரவுலோக புளோரைடையும் உருவாக்குகின்றன[4].
வினைகள்[தொகு]
குளோரின் ஐம்புளோரைடு உயர் வெப்ப உமிழ் வினையில் தண்ணீரால் நீராற்பகுக்கப்பட்டு குளோரைல் புளோரைடு மற்றும் ஐதரசன் புளோரைடு ஆகியனவற்றை உற்பத்தி செய்கிறது.:[6]
- ClF
5 + 2 H
2O → FClO
2 + 4 HF
இச்சேர்மம் ஒரு புளோரினேற்ற முகவராகவும் செயல்படுகிறது. அறை வெப்பநிலையில் , மந்தவாயுக்கள், நைட்ரசன், ஆக்சிசன் மற்றும் புளோரின் தவிர்த்த அனைத்து தனிமங்களுடனும் எளிமையாக வினைபுரிகிறது.[2]
மேற்கோள்கள்[தொகு]
- ↑ Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ). Butterworth–Heinemann. பக். 833. பன்னாட்டுத் தரப்புத்தக எண்:0080379419.
- ↑ 2.0 2.1 Pilipovich, D., Maya, W., Lawton, E.A., Bauer, H.F., Sheehan, D. F., Ogimachi, N. N., Wilson, R. D., Gunderloy, F. C., Bedwell, V. E. (1967). "Chlorine pentafluoride. Preparation and Properties". Inorganic Chemistry 6 (10): 1918. doi:10.1021/ic50056a036.
- ↑ John Drury Clark (1972). Ignition! An Informal History of Liquid Rocket Propellants. Rutgers University Press. பக். 87–88. பன்னாட்டுத் தரப்புத்தக எண்:0-8135-0725-1. https://archive.org/details/ignitioninformal0000clar.
- ↑ 4.0 4.1 Smith D. F. (1963). "Chlorine Pentafluoride". Science 141 (3585): 1039–1040. doi:10.1126/science.141.3585.1039. பப்மெட்:17739492.
- ↑ Šmalc, A., Žemva, B., Slivnik, J., and Lutar K. (1981). "On the Synthesis of Chlorine Pentafluoride". Journal of Fluorine Chemistry 17 (4): 381–383. doi:10.1016/S0022-1139(00)81783-2.
- ↑ Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ). Butterworth–Heinemann. பக். 834. பன்னாட்டுத் தரப்புத்தக எண்:0080379419.
இவற்றையும் காண்க[தொகு]
வெளி இணைப்புகள்[தொகு]
- National Pollutant Inventory - Fluoride and compounds fact sheet பரணிடப்பட்டது 2006-01-16 at the வந்தவழி இயந்திரம்
- WebBook page for ClF5