செலீனியம் மோனோகுளோரைடு
| |
| பெயர்கள் | |
|---|---|
| ஐயூபிஏசி பெயர்
செலீனியம் மோனோகுளோரைடு
| |
| வேறு பெயர்கள்
டைகுளோரோசெலீனைடு, டைசெலீனியம் டைகுளோரைடு, செலீனியம் குளோரைடு, 1,2-டைகுளோரோசெலேன்
| |
| இனங்காட்டிகள் | |
| 10025-68-0 | |
| ChemSpider | 59591 |
InChI
| |
| யேமல் -3D படிமங்கள் | Image |
| பப்கெம் | 66206 |
SMILES
| |
| UNII | 2A5292FC4P |
| பண்புகள் | |
| Se2Cl2 | |
| வாய்ப்பாட்டு எடை | 228.83 கி/மோல் |
| தோற்றம் | செம்பழுப்பு நீர்மம் |
| அடர்த்தி | 2.7741 கி/செ.மீ3 |
| உருகுநிலை | −85 °C (−121 °F; 188 K) |
| கொதிநிலை | 127 °C (261 °F; 400 K) 0.997 வளிமண்டல அழுத்தத்தில் |
| கரையாது | |
| பிற கரைப்பான்கள்-இல் கரைதிறன் | குளோரோபார்ம், கார்பன் டைசல்பைடு மற்றும் அசிட்டோநைட்ரைல் ஆகியவற்றில் கரையும் |
| −94.8•10−6செ.மீ3/மோல் | |
| தீங்குகள் | |
| R-சொற்றொடர்கள் | R23/24/25-R34 |
| S-சொற்றொடர்கள் | S22-S26-S36/37/39-S45 |
மாறுதலாக ஏதும் சொல்லவில்லை என்றால் கொடுக்கப்பட்ட தரவுகள் யாவும் பொருள்கள் அவைகளின் இயல்பான வெப்ப அழுத்த நிலையில் (25°C, 100kPa) இருக்கும். | |
| | |
| Infobox references | |
செலீனியம் மோனோகுளோரைடு (Selenium monochloride) என்பது Se2Cl2 என்ற மூலக்கூற்று வாய்ப்பாட்டால் விவரிக்கப்படும் ஒரு கனிம வேதியியல் சேர்மமாகும். செலீனியம் மோனோகுளோரைடு என்று அழைக்கப்பட்டாலும் இதன் சரியான விளக்கப் பெயர் டைசெலீனியம் டைகுளோரைடு என்பதாகும். டைகுளோரோசெலீனைடு, டைசெலீனியம் டைகுளோரைடு, செலீனியம் குளோரைடு, 1,2-டைகுளோரோசெலேன் போன்ற பல பெயர்களால் செலீனியம் மோனோகுளோரைடு அழைக்கப்படுகிறது. செம்பழுப்பு நிறத்தில் நீர்மமாகக் காணப்படும் இச்சேர்மம் மெல்ல நீராற்பகுப்பு அடைகிறது. செலீனியம் டைகுளோரைடு, செலீனியம் டெட்ராகுளோரைடு, குளோரின் மற்றும் தனிமநிலை செலீனியம் ஆகியவற்றுடன் செலீனியம் மோனோகுளோரைடு வேதிச்சமநிலை கொண்டுள்ளது. செலீனியத்தை பகுதிப்பொருளாகக் கொண்டுள்ள பிற சேர்மங்களை தயாரிக்க ஒரு வினையாக்கியாக இது பயன்படுகிறது.
குளோரோஃபார்ம், கார்பன் டைசல்பைடு மற்றும் அசிட்டோநைட்ரைல் போன்ற கரிமக் கரைப்பான்களில் இது கரைகிறது. செலீனியம் மோனோகுளோரைடுடன் எப்போதும் சிறிதளவு அதிக நிலைப்புத்தன்மை கொண்ட செலீனியம் டெட்ரா குளோரைடும் சேர்ந்தே இருக்கும். 2.7741 என்ற அடர்த்தி மதிப்பும் -85° பாகை செல்சியசு வெப்பநிலை உருகு நிலையும் 145 பாகை செல்சியசு வெப்பநிலையை கொதிநிலையாகவும் கொண்டதாக செலீனியம் மோனோகுளோரைடு காணப்படுகிறது. ஆவியாக்கும்போது இது பகுதியாக சிதைவடைகிறது.
கட்டமைப்பு[தொகு]
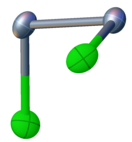
செலீனியம் மோனோகுளோரைடு Cl-Se-Se-Cl என்ற இணைப்புடன் சமதளமற்ற கட்டமைப்பை கொண்டுள்ளது. ஐதரசன் பெராக்சைடு மற்றும் கந்தக மோனோகுளோரைடு போன்ற சி 2 மூலக்கூற்று சமச்சீர்மையை இது கொண்டுள்ளது. Se-Se பிணைப்பின் பிணைப்பு நீளம் 2.23 ஆங்சிட்ராங் , மற்றும் Se-Cl பிணைப்பின் பிணைப்பு நீளம் 2.20 ஆங்சிட்ராங் ஆகும். இருமுகங்களுக்கிடையிலான பிணைப்புக் கோணம் 87 பாகைகளாகும் [1].
தயாரிப்பு[தொகு]
செலீனியம் மோனோகுளோரைடு முதலில் செலீனியத்தை குளோரினேற்றம் செய்வதன் மூலம் தயாரிக்கப்பட்டது [2]. இதை தொடர்ந்து இம்முறை மேம்படுத்தப்பட்டு செலீனியம், செலீனியம் டையாக்சைடு இரண்டின் கலவையுடன் ஐதரோகுளோரிக் அமிலம் சேர்த்து வினையில் ஈடுபடுத்துவதன் மூலம் தயாரிக்கப்பட்டது [3].
- 3 Se + SeO2 + 4 HCl → 2 Se2Cl2 + H2O.
செலீனியம் மோனோகுளோரைடின் அடர்த்தியான அடுக்கு வினை கலவையிலிருந்து பிரிந்து அடியில் தங்குகிறது. இதை புகையும் கந்தக அமிலத்தில் கரைத்து, ஐதரோகுளோரிக் அமிலம் சேர்த்து மறு வீழ்படிவாக்கம் செய்வதன் மூலம் விளைபொருள் சுத்திகரிக்கப்படுகிறது. தொகுப்புக்கான இரண்டாவது முறையில் ஓலியம் மற்றும் ஐதரோ குளோரிக் அமிலத்துடன் செலீனியம் வினை புரிவது அடங்கும் [3].
- 2 Se + 2 SO3 + 3 HCl → Se2Cl2 + H2SO3 + SO2(OH)Cl
கச்சா செலீனியம் மோனோகுளோரைடு தயாரிப்பு காய்ச்சி வடித்தல் வழியாக சேகரிக்கப்படுகிறது. அசிட்டோநைட்ரைல் கரைசல்களில் இது SeCl 2 மற்றும் SeCl 4 ஆகியவற்றுடன் சமநிலையில் உள்ளது [4]. அறை வெப்பநிலையில் சில நிமிடங்களுக்குப் பிறகு செலினியம் டைகுளோரைடு மோனோகுளோரைடாக தரம் குறைகிறது: [5]
- 3 SeCl2 → Se2Cl2 + SeCl4.
வினைகள்[தொகு]
செலீனியம் மோனோகுளோரைடு ஓர் எலக்ட்ரான் கவர் செலீனியமாக்கும் முகவராகும். எனவே எளிய ஆல்க்கீன்களுடன் செலீனியம் மோனோகுளோரைடு வினை புரிந்து பிசு(β-குளோரோ ஆல்க்கைல்) செலீனைடு மற்றும் பிசு(குளோரோ ஆல்க்கைல்) செலீனியம் டைகுளோரைடு போன்ற சேர்மங்களை கொடுக்கிறது. தடையுற்ற கீட்டோன்களின் ஐதரசோன்களை அவற்றுடன் தொடர்புடைய செலீனோ கீட்டோன்களாக மாற்றுகிறது. இவை கட்டமைப்பு ரிதியாக கீட்டோன்களின் அமைப்பை ஒத்திருக்கின்றன. இங்கு ஆக்சிசன் அணு செலீனியம் அணுவால் இடப்பெயர்ச்சி செய்யப்பட்டுள்ளது [6]. இறுதியாக, சில இரும்பு மற்றும் குரோமியம் கார்பனைல் அணைவுச் சேர்மங்களின் உலோக அணுக்களுக்கு இடையில் செலீனியம் ஈந்தணைவிகளை அறிமுகப்படுத்த இந்த சேர்மம் பயன்படுத்தப்படுகிறது [6].
மேற்கோள்கள்[தொகு]
- ↑ Kniep, Rüdiger; Körte, Lutz; Mootz, Dietrich (1 January 1983). "Kristallstrukturen von Verbindungen A2X2 (A = S, Se; X = Cl, Br)". Zeitschrift für Naturforschung B 38 (1): 1–6. doi:10.1515/znb-1983-0102.
- ↑ Lenher, Victor; Kao, C. H. (1925). "The Preparation of Selenium Monochloride and Monobromide". Journal of the American Chemical Society 47 (3): 772–774. doi:10.1021/ja01680a025.
- ↑ 3.0 3.1 Fehér, F. "Diselenium Dichloride". In Handbook of Preparative Inorganic Chemistry; Brauer, G., Ed.; Academic Press: New York, 1963; Vol. 1; p 422-433.
- ↑ Lamoureux, Marc; Milne, John (1990). "Selenium chloride and bromide equilibria in aprotic solvents; a 77Se NMR study". Polyhedron 9 (4): 589–595. doi:10.1016/S0277-5387(00)86238-5. https://archive.org/details/sim_polyhedron_1990_9_4/page/589.
- ↑ Maaninen, Arto; Chivers, Tristram; Parvez, Masood; Pietikäinen, Jarkko; Laitinen, Risto S. (1999). "Syntheses of THF Solutions of SeX2(X = Cl, Br) and a New Route to Selenium Sulfides SenS8-n(n = 1−5): X-ray Crystal Structures of SeCl2(tht)2 and SeCl2•tmtu". Inorganic Chemistry 38 (18): 4093–4097. doi:10.1021/ic981430h.
- ↑ 6.0 6.1 "Encyclopedia of Reagents for Organic Synthesis".. (2003). DOI:10.1002/047084289X.rn00201. பன்னாட்டுத் தரப்புத்தக எண் 0471936235.
