ஆண்டிமனி ஐங்குளோரைடு
| |||

| |||
| பெயர்கள் | |||
|---|---|---|---|
| ஐயூபிஏசி பெயர்s
ஆண்டிமணி ஐங்குளோரைடு
ஆண்டிமனி(V) குளோரைடு | |||
| வேறு பெயர்கள்
ஆண்டிமனிக் குளோரைடு
ஆண்டிமனி குயிண்டாகுளோரைடு ஆண்ட்டிமனி பெர்குளோரைடு | |||
| இனங்காட்டிகள் | |||
| 7647-18-9 | |||
| ChemSpider | 10613049 | ||
| EC number | 231-601-8 | ||
| யேமல் -3D படிமங்கள் | Image Image | ||
| பப்கெம் | 24294 | ||
| வே.ந.வி.ப எண் | CC5075000 | ||
SMILES
| |||
| பண்புகள் | |||
| Cl5Sb | |||
| வாய்ப்பாட்டு எடை | 299.01 g·mol−1 | ||
| தோற்றம் | நிறமற்ற அல்லது மஞ்சள் (புகைக்கும்) திரவம் | ||
| மணம் | கார மணம் | ||
| அடர்த்தி | 2.336 கி/செமீ3 (20 °செ), 2.36 கி/செமீ3 (25 °செ) | ||
| உருகுநிலை | 2.8 °C (37.0 °F; 275.9 K) | ||
| கொதிநிலை | 140 °C (284 °F; 413 K) | ||
| வினை | |||
| கரைதிறன் | மதுசாரம், HCl, தார்த்தாரிக்கு அமிலம், CHCl3, CS2, CCl4 ஆகியவற்றில் கரையக்கூடியது | ||
| செலினியம்(IV) ஆக்சிகுளோரைடு-இல் கரைதிறன் | 62.97 கி/100 கி (25 °செ) | ||
| ஆவியமுக்கம் | 0.16 kPa (25 °C) 4 kPa (40 °C) 7.7 kPa (100 °C)[1] | ||
| ஒளிவிலகல் சுட்டெண் (nD) | 1.59255 | ||
| பிசுக்குமை | 2.034 cP (29.4 °C), 1.91 cP (35 °C) | ||
| கட்டமைப்பு | |||
| மூலக்கூறு வடிவம் | |||
| இருமுனைத் திருப்புமை (Dipole moment) | 0 D | ||
| வெப்பவேதியியல் | |||
| Std enthalpy of formation ΔfH |
-437.2 கியூல்/மோல்[2] | ||
| நியம மோலார் எந்திரோப்பி S |
295 யூல்/மோல்·K[2] | ||
| வெப்பக் கொண்மை, C | 120.9 ஜூ/மோல்·கெல் (வளிமம்)[2] | ||
| தீங்குகள் | |||
| GHS pictograms |   [3] [3]
| ||
| GHS signal word | Danger | ||
| H314, H411[3] | |||
| P273, P280, P305+351+338, P310[3] | |||
| ஈயூ வகைப்பாடு | |||
| R-சொற்றொடர்கள் | R34, R51/53 | ||
| S-சொற்றொடர்கள் | (S1/2), S26, S45, S61 | ||
| உள்மூச்சு இடர் | நச்சு | ||
| தீப்பற்றும் வெப்பநிலை | 77 °C (171 °F; 350 K) | ||
| Lethal dose or concentration (LD, LC): | |||
LD50 (Median dose)
|
1115 mg/kg, (எலி,வாய்வழி)[2] | ||
| தொடர்புடைய சேர்மங்கள் | |||
| ஏனைய எதிர் மின்னயனிகள் | ஆண்டிமனிபெண்டாபுளோரைடு | ||
| ஏனைய நேர் மின்அயனிகள் | பாசுபரசு பெண்டாகுளோரைடு | ||
| தொடர்புடைய சேர்மங்கள் | ஆண்டிமனி முக்குளோரைடு | ||
மாறுதலாக ஏதும் சொல்லவில்லை என்றால் கொடுக்கப்பட்ட தரவுகள் யாவும் பொருள்கள் அவைகளின் இயல்பான வெப்ப அழுத்த நிலையில் (25°C, 100kPa) இருக்கும். | |||
| | |||
| Infobox references | |||
ஆண்டிமணி ஐங்குளோரைடு (Antimony pentachloride) என்பது SbCl5 என்ற மூலக்கூறு வாய்பாடு கொண்ட ஒரு வேதிச் சேர்மமாகும். இது ஒரு நிறமற்ற எண்ணெய் ஆகும். 106 பாகை செல்சியசு வெப்பநிலை முதல் இது சிதைவடையத் தொடங்கும்.[2]ஆனால் இதனுடைய உப்பு மாதிரிகள் அசுத்தங்கள் கலந்திருப்பதால் மஞ்சளாகக் காணப்படுகின்றன. ஐதரோ குளோரிக் அமிலமாக ஆண்டிமணி ஐங்குளோரைடு நீராற் பகுக்கப்படும் தன்மையால் இது மிகவும் அரிப்புத் தன்மை கொண்டதாக உள்ளது.
தயாரிப்பு மற்றும் கட்டமைப்பு[தொகு]
குளோரின் வாயுவை உருகிய ஆண்டிமணி முக்குளோரைடு வழியாகச் செலுத்தும்போது ஆண்டிமணி ஐங்குளோரைடு உருவாகிறது.
- SbCl3 + Cl2 → SbCl5
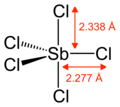
வாயுரூப ஆண்டிமணி ஐங்குளோரைடு முக்கோண முப்பட்டக அமைப்பைப் பெற்றுள்ளது[4] .
வேதி வினைகள்[தொகு]
ஆண்டிமணி ஐங்குளோரைடு உடனடியாக நிராற்பகுப்பு வினைக்கு உட்பட்டு ஐதரோ குளோரிக் அமிலமாக மாறுகிறது
- 2 SbCl5 + 5 H2O → Sb2O5 + 10 HCl
அதிக அளவிலான குளோரைடு முன்னிலையில் வினை கட்டுப்படுத்தப்பட்டு, அறுகுளோரோஆண்டிமோனேட்டு சிக்கல் அயனி உண்டாகிறது.
- SbCl5 + Cl- → [SbCl6]-
ஆண்டிமணி ஐங்குளோரைடின் ஒற்றை நீரேறிகள் மற்றும் நான்காம் நீரேறிகள் SbCl5·H2O SbCl5·4 H2O. உள்ளனவாக அறியப்பட்டுள்ளது.
ஆண்டிமணி ஐங்குளோரைடு பல லூயிசு காரங்களுடன் இணைந்து கூட்டுப் பொருள்களைத் தருகிறது[5] லூயிசு காரத்தன்மையை நிர்ணயிக்கும் கட்மான் அளவீட்டில் தரப்படுத்தப்பட்ட லூயிசு அமிலமாக இது பயனாகிறது.
இது ஒரு வலிமையான ஆக்சிசனேற்றியாகவும் பயன்படுகிறது[6] .
பயன்கள்[தொகு]
பலபடியாக்கல் வினைகளில் வினையூக்கியாகவும் கரிம சேர்மங்களில் குளோரினேற்றம் நிகழ்வதற்கும் ஆண்டிமணி ஐங்குளோரைடு பயன்படுகிறது.
மேற்கோள்கள்[தொகு]
- ↑ Antimony pentachloride in Linstrom, Peter J.; Mallard, William G. (eds.); NIST Chemistry WebBook, NIST Standard Reference Database Number 69, National Institute of Standards and Technology, Gaithersburg (MD), http://webbook.nist.gov (retrieved 2014-05-29)
- ↑ 2.0 2.1 2.2 2.3 2.4 "Antimony(V) chloride".
- ↑ 3.0 3.1 3.2 Sigma-Aldrich Co., Antimony(V) chloride. Retrieved on 2014-05-29.
- ↑ Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ). Butterworth–Heinemann. பன்னாட்டுத் தரப்புத்தக எண்:0080379419.
- ↑ V. Gutmann (1976). "Solvent effects on the reactivities of organometallic compounds". Coord. Chem. Rev. 18 (2): 225. doi:10.1016/S0010-8545(00)82045-7.
- ↑ Connelly, N. G. and Geiger, W. E. (1996). "Chemical Redox Agents for Organometallic Chemistry". Chem. Rev. 96: 877–922. doi:10.1021/cr940053x. பப்மெட்:11848774.