குளோரைடு
| குளோரைடு | |||
|---|---|---|---|
குளோரைடு[1] | |||
| இனங்காட்டிகள் | |||
| 16887-00-6 | |||
Beilstein Reference
|
3587171 | ||
| ChEBI | CHEBI:17996 | ||
| ChEMBL | ChEMBL19429 | ||
| ChemSpider | 306 | ||
Gmelin Reference
|
14910 | ||
| யேமல் -3D படிமங்கள் | Image | ||
| KEGG | C00698 | ||
| பப்கெம் | 312 | ||
| |||
| பண்புகள் | |||
| Cl− | |||
| வாய்ப்பாட்டு எடை | 35.453 g mol-1 | ||
| வெப்பவேதியியல் | |||
| Std enthalpy of formation ΔfH |
−167 kJ·mol−1[2] | ||
| நியம மோலார் எந்திரோப்பி S |
153.36 J K-1 mol-1[2] | ||
| தொடர்புடைய சேர்மங்கள் | |||
| ஏனைய எதிர் மின்னயனிகள் | புரோமைடு | ||
| Except where noted otherwise, data are given for materials in their standard state (at 25 °C, 100 kPa) | |||
| Infobox references | |||
குளோரைடு அயனி[3] (Chloride ion) என்பது எதிர்மின் சுமை கொண்ட ஓர் அயனியாகும் (Cl−). உப்பீனியான குளோரின் தனிமம் ஓர் எலக்ட்ரான் பெறும் போது அல்லது ஐதரசன் குளோரைடு போன்ற சேர்மம் நீர் அல்லது முனைவுக் கரைப்பான்களில் கரையும் போது இக்குளோரைடு அயனி உருவாகிறது. சோடியம் குளோரைடு போன்ற குளோரைடு உப்புகள் நீரில் நன்கு கரைகின்றன[4]. உடல் திரவங்கள் அனைத்திலும் இடம்பெற்று உடலின் அமில காரச் சமநிலையை பராமரிப்பதற்குத் தேவையான ஓர் அத்தியாவசியமான மின்பகுளியாகவும், நரம்பு தூண்டுதல்களை கடத்தவும் செல்களுக்கு உள்ளேயும் வெளியேயும் உடல் திரவங்களை முறைப்படுத்தவும் குளோரைடு அயனி பொறுப்பாகிறது. மேலும் குளோரைடு என்ற சொல் அரிதாக பொதுப்பெயரான வேதியியல் சேர்மங்கள் என்பதைக் குறிக்கவும் பயன்படுத்தப்படுகிறது. இத்தகைய சேர்மங்களில் கூடுதலாக ஓர் குளோரின் அணு சகப்பிணைப்பு மூலம் பிணைக்கப்படுகிறது. உதாரணமாக மெத்தில் குளோரைடு எனப்படும் குளோரோமெத்தேன் C−Cl சகப்பிணைப்பு கொண்ட ஒரு கரிமச் சேர்மமாகும். குளோரின் அயனியாக இல்லாத சேர்மத்திற்கு இது எடுத்துக்காட்டாகும்.
மின்னணு பண்புகள்
[தொகு]ஒரு குளோரைடு அயனியானது குளோரின் அணுவைக்காட்டிலும் பெரியது ஆகும். இவற்றின் அளவுகள் முறையே 167 மற்றும் 99 பைக்கோ மீட்டர்கள் என்பதைக் கொண்டு இதை ஒப்பிட்டு அறியலாம். குளோரின் அயனி நிறமற்றதாகவும் அபரகாந்தப்பண்புடனும் காணப்படுகிறது. நீரிய கரைசலில் பெரும்பாலான குளோரைடுகள் நன்கு கரைகின்றன. இருப்பினும் வெள்ளி குளோரைடு, ஈய (II) குளோரைடு மற்றும் பாதரசம் (I) குளோரைடு போன்ற சில குளோரைடு உப்புகள் தண்ணீரில் சிறிதளவே கரையக்கூடியவையாக உள்ளன[5] . நீரிய கரைசலில் குளோரைடு அயனி நீர் மூலக்கூறின் புரோட்டான் இருக்கும் முனையுடன் பிணைக்கப்பட்டுள்ளது.
தோற்றம்
[தொகு]கடல் நீரில் 1.94% குளோரைடு உள்ளது. குளோரைடுகளைக் கொண்ட சில கனிமங்களில் சோடியத்தின் குளோரைடுகள் காணப்படுகின்றன. ஆலைட்டு அல்லது சோடியம் குளோரைடு இதற்கு எடுத்துக்காட்டாகும். சில்வைட்டு அல்லது பொட்டாசியம் குளோரைடு கனிமத்தில் பொட்டாசியமும், பிசுக்கோபைட்டு, நீரேற்ற மக்னீசியம் குளோரைடில் மக்னீசியமும் காணப்படுகின்றன. இரத்தத்தில் உள்ள குளோரைடின் செறிவு சீரம் குளோரைடு என்று அழைக்கப்படுகிறது, இந்த செறிவு சிறுநீரகங்களால் கட்டுப்படுத்தப்படுகிறது. குளோரைடு அயனி என்பது சில புரோட்டீன்களின் கட்டமைப்புப் பகுதிப்பொருளாகவும் உள்ளது. எடுத்துக்காட்டாக இது அமைலேசு என்ற நொதியில் உள்ளது.
வணிக முக்கியத்துவம்
[தொகு]குளோர்-ஆல்கலி செயல்முறையில் சோடியம் குளோரைடு மின்னாற்பகுப்பு செய்யப்பட்டு குளோரினும் சோடியம் ஐதராக்சைடும் தயாரிக்கப்படுகின்றன. இவற்றிலிருந்து பல வேதிப்பொருட்களும் வேறு பிற பொருட்களும் தயாரிக்கப்படுகின்றன. இச்செயல்முறையில் இரண்டு இணை வினைகள் நிகழ்கின்றன.
- 2 Cl− → Cl
2 + 2 e− - 2 H
2O + 2 e− → H2 + 2 OH−
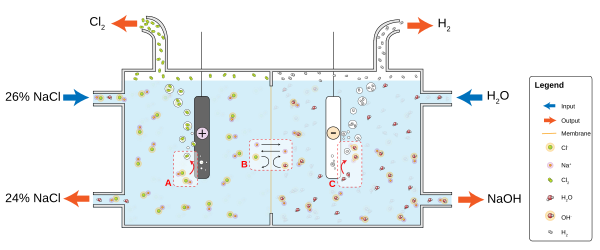
நீரின் தரம் மற்றும் இதர செயல்முறைகள்
[தொகு]குளோரைடுடன் தொடர்புடைய மற்றொரு பிரதான பயன்பாடு நீரிலிருந்து உப்பை அகற்றுதலாகும். இம்முறை குளோரைடு உப்புகளின் ஆற்றல் தீவிரமாக அகற்றப்பட்டு குடிக்கத்தக்க தண்ணீரை அளிக்கிறது. பெட்ரோலியம் தொழிற்சாலைகளிலும் சேற்றில் உள்ள குளோரைடின் செறிவு அளவு கண்காணிக்கப்படுகிறது. உயர் அழுத்த உப்பு நீர் உருவாக்கம் தொடர்பான முன்னறிவிப்பாக குளோரைடு அதிகரிப்பு அங்கு பார்க்கப்படுகிறது.
ஆற்று / நிலத்தடி நீர் மாசுபடுதலை தெரிவிக்கும் ஒரு பயனுள்ள மற்றும் நம்பகமான இரசாயன அடையாளமாக குளோரைடு திகழ்கிறது. உலகெங்கிலும் உள்ள பல நீர் ஒழுங்குபடுத்தும் நிறுவனங்கள் ஆறுகள் மற்றும் குடிக்கக்கூடிய நீர் ஆதாரங்கள் மாசடைவதை சரிபார்க்க குளோரைடைப் பயன்படுத்துகின்றன[6]. வீடுகளில் சோடியம் குளோரைடு போன்ற உப்புகள் உணவுப்பொருள்களைப் பாதுகாக்கப் பயன்படுத்தப்படுகின்றன.
அரிப்பு
[தொகு]கடல்நீரில் உள்ள குளோரைடுகளால் துவேறா இரும்பு முதல் பல மாழைகள் (உலோகங்கள்) சில வகையான புள்ளிபோன்ற சிறு அரிப்புகள் உறுவதை மிகைப்படுத்துகின்றன. இந்த புள்ளி போன்ற சிறுகுழி அரிப்புகள் பல்வேறு தூண்டு வினைகளால் ஏற்படுவன.
குளோரைடுகளின் வினைகள்
[தொகு]குளோரைடுகளை ஆக்சிசனேற்றம் செய்ய முடியும். ஆனால் ஒடுக்கமடையச் செய்ய இயலாது. குளோர் ஆல்கலி செயல் முறையில் மேற்கொள்ளப்படும் முதலாவது ஆக்சிசனேற்ற வினையில் குளோரின் உருவாக்கப்படுகிறது. இக்குளோரின் மேலும் ஆக்சிசனேற்றப்பட்டு பிற ஆக்சைடுகள் மற்றும் ஆக்சி எதிர்மின் அயனிகள் உருவாக்கப்படுகின்றன. ஐப்போகுளோரைட்டு, குளோரின் டையாக்சைடு, குளோரேட்டு, பெர்குளோரேட்டு என்பன அவற்றில் சிலவாகும்.
அமிலக் காரப் பண்புகளைப் பொறுத்தவரை குளோரைடு ஒரு வலிமை குறைந்த காரமாகும்.
பயன்கள்
[தொகு]உணவைப் பாதுகாக்க சோடியம் குளோரைடு பயன்படுகின்றது, இது சமையலில் பயன்படும் உப்புதான். கால்சியம் குளோரைடு, மக்னீசியம் குளோரைடு, பொட்டாசியம் குளோரைடு போன்றவை மருத்துவப் பயன்பாடு முதல் பைஞ்சுதை (சிமென்ட்டு) உருவாவது வரை பல பயன்பாடுகளுக்கு உதவுகின்றன.[7]
கரிமமல்லாத பகிர்பிணைப்பு கொண்ட குளோரைடுகள் (covalently bonded chlorides) வேதிவினைப்பொருள்களாகப் பயன்படுவன:
- பாசுபரசு திரைக்குளோரைடு , பாசுபரசு பென்ட்டாக்குளோரைடு, தியோனைல் குளோரைடு - இவை மூன்றும் வேதியசெய்களத்தில் குளோரைடாக்கிகளாகப் பயன்படுவன.
- டைசல்பைடு டைக்குளோரைடு (S2Cl2), என்பது இரப்பரை உறுதியாக்க (வல்க்கனைசேசன்) பயன்படுகின்றது.
மாவுப்பொருளை இனிப்பியங்களாக மாற்றும் அமிலேசு (amylase) என்னும் நொதியத்தின் முன்னுந்திக் கூறாக இருப்பது ஒரு குளோரைடு மின்மமூலக்க்குறே.
கால்சியம் குளோரைடு (CaCl2) என்பது அறையில் இருக்கும் ஈரத்தன்மையை நீக்கப் பயன்படும் ஒரு பொருள் இது பனியின் உருகுவெப்பநிலையை குறைப்பதால், பனியை நீக்கப் பயன்படுகின்றது (பனி நிறைந்த பகுதிகளில் வானூர்திகளின் இறக்கையின் மீதுள்ள பனியை நீக்கப்பயன்படும் பனி-நீக்கியாகப் பயன்படுகின்றது.[8]
அடிக்குறிப்புகளும் மேற்கோள்களும்
[தொகு]- ↑ "Chloride ion - PubChem Public Chemical Database". The PubChem Project. USA: National Center for Biotechnology Information.
- ↑ 2.0 2.1 Zumdahl, Steven S. (2009). Chemical Principles 6th Ed. Houghton Mifflin Company. p. A21. பன்னாட்டுத் தரப்புத்தக எண் 0-618-94690-X.
- ↑ Wells, John C. (2008), Longman Pronunciation Dictionary (3rd ed.), Longman, p. 143, பன்னாட்டுத் தரப்புத்தக எண் 9781405881180.
- ↑ Green, John, and Sadru Damji. "Chapter 3." Chemistry. Camberwell, Vic.: IBID, 2001. Print.
- ↑ Zumdahl, Steven (2013). Chemical Principles (7th ed.). Cengage Learning. pp. 109. பன்னாட்டுத் தரப்புத்தக எண் 978-1-285-13370-6.
- ↑ "Chlorides". www.gopetsamerica.com. Archived from the original on 18 ஆகத்து 2016. பார்க்கப்பட்ட நாள் 14 April 2018.
- ↑ Green, John, and Sadru Damji. "Chapter 3." Chemistry. Camberwell, Vic.: IBID, 2001. Print.
- ↑ "Common Salts." Test Page for Apache Installation. Web. 22 Mar. 2011. <http://hyperphysics.phy-astr.gsu.edu/hbase/chemical/saltcom.html>.
