கால்சியம் அயோடேட்டு
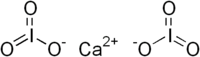
| |
| பெயர்கள் | |
|---|---|
| ஐயூபிஏசி பெயர்
கால்சியம் டை அயோடேட்டு
| |
| வேறு பெயர்கள்
லாவுட்டரைட்
| |
| இனங்காட்டிகள் | |
| 7789-80-2 (anhydrous) 10031-33-1 (hexahydrate) | |
| ChemSpider | 23021 |
| EC number | 232-191-3 |
| யேமல் -3D படிமங்கள் | Image |
| பப்கெம் | 24619 |
SMILES
| |
| பண்புகள் | |
| Ca(IO3)2 | |
| வாய்ப்பாட்டு எடை | 389.88 கி/மோல் (நீரிலி) 407.90 கி/மோல் (ஒருநீரேற்று) |
| தோற்றம் | வெண்மை நிறத் திண்மம் |
| அடர்த்தி | 4.519 கி/செ.மீ3 (ஒருநீரேற்று) |
| உருகுநிலை | 540 °C (1,004 °F; 813 K) (ஒருநீரேற்று) |
| கொதிநிலை | சிதைவடையும் |
| 0.09 g/100 mL (0 °C) 0.24 g/100 mL (20 °C) 0.67 g/100 mL (90 °C) | |
| கரைதிறன் | நைட்ரிக் அமிலத்தில் கரையும் ஆல்ககாலில் கரையாது. |
| கட்டமைப்பு | |
| படிக அமைப்பு | ஒற்றைச்சரிவு (நீரிலி வடிவம்) கனசதுரம் (ஒருநீரேற்று) நேர்சாய்சதுரம் (அறுநீரேற்று) |
| தீங்குகள் | |
| தீப்பற்றும் வெப்பநிலை | எளிதில் தீப்பற்றாது |
மாறுதலாக ஏதும் சொல்லவில்லை என்றால் கொடுக்கப்பட்ட தரவுகள் யாவும் பொருள்கள் அவைகளின் இயல்பான வெப்ப அழுத்த நிலையில் (25°C, 100kPa) இருக்கும். | |
| | |
| Infobox references | |
கால்சியம் அயோடேட்டு (Calcium iodate) என்பது Ca(IO3)2 என்ற மூலக்கூற்று வாய்ப்பாடு கொண்ட ஒரு வேதிச் சேர்மம் ஆகும். கால்சியம் இரட்டையூட்ட நேரயனியும் அயோடேட்டு எதிரயனியும் சேர்ந்து இந்தக் கனிம வேதியியல் சேர்மம் உருவாகிறது. நிறமற்ற உப்பான இச்சேர்மம் இயற்கையில் லாவுடரைட் என்ற கனிமமாக சிலியில் உள்ள அடகாமா பாலைவனத்தில் கிடைக்கிறது[1]
தயாரிப்பு மற்றும் வினைகள்[தொகு]
கால்சியம் அயோடைடின் நேர்மின்முனை ஆக்சிசனேற்றம் வழியாக கால்சியம் அயோடேட்டைத் தயாரிக்க முடியும் அல்லது அயோடின் கரைந்துள்ள நீர்த்த சுண்ணாம்புக் கரைசல் வழியாகக் குளோரினைச் செலுத்துவதன் மூலமும் இதைத் தயாரிக்க முடியும்.
பயன்கள்[தொகு]
வர்த்தக நோக்கிலான அயோடின் சேர்மங்களுக்கு இது ஒரு முன்னோடியாக விளங்குகிறது. தாதுப் பொருட்களை ஒடுக்குதல் என்ற மரபுவழி உலோகவியல் செயல்முறையில் நீர்த்த விளைபொருட்கள் சோடியம் பைசல்பைட்டுடன் சேர்க்கப்பட்டால் அங்கு சோடியம் அயோடைடு உருவாகிறது. விகிதச்சம பொதுவாதல் வினையின் வழியாக சோடியம் அயோடைடு அயோடேட்டு உப்புடன் சேர்ந்து தனிமநிலை அயோடினை உற்பத்தி செய்கிறது[1].
கோழிப்பண்ணைகளில் கோழிகளுக்கான அயோடின் துணைவுணவாக இது கோழிகளுக்குக் கொடுக்கப்படுகிறது[1].
குழைமம் மற்றும் மேற்பூச்சுக் களிம்புகளில் நாற்றம் நீக்கியாகவும் கிருமிநாசினியாகவும் கால்சியம் அயோடைடு பயன்படுகிறது[2].
மேற்கோள்கள்[தொகு]
- ↑ 1.0 1.1 1.2 Lyday, Phyllis A. "Iodine and Iodine Compounds" in Ullmann's Encyclopedia of Industrial Chemistry, 2005, Wiley-VCH, Weinheim, பன்னாட்டுத் தரப்புத்தக எண் 978-3-527-30673-2 எஆசு:10.1002/14356007.a14_381 Vol. A14 pp. 382–390.
- ↑ Calcium iodate[தொடர்பிழந்த இணைப்பு] from the Online Medical Dictionary
