துத்தநாக புளோரைட்டு
Appearance
| |
| பெயர்கள் | |
|---|---|
| வேறு பெயர்கள்
துத்தநாக விருபுளோரைட்டு
| |
| இனங்காட்டிகள் | |
| 7783-49-5 | |
| ChemSpider | 22957 |
| யேமல் -3D படிமங்கள் | Image |
| பப்கெம் | 24551 |
| வே.ந.வி.ப எண் | ZH3200000 |
| |
| பண்புகள் | |
| ZnF2 | |
| வாய்ப்பாட்டு எடை | 103.406 g/mol (anhydrous) 175.45 g/mol (நான்மநீரேறி) |
| தோற்றம் | white needles hygroscopic |
| அடர்த்தி | 4.95 g/cm3 (anhydrous) 2.30 g/cm3 (tetrahydrate) |
| உருகுநிலை | 872 °C (1,602 °F; 1,145 K) |
| கொதிநிலை | 1,500 °C (2,730 °F; 1,770 K) |
| .000052 g/100 mL (anhydrous) 1.52 g/100 mL, 20 °C (tetrahydrate) | |
| கரைதிறன் | sparingly soluble in HCl, HNO3, ammonia |
| கட்டமைப்பு | |
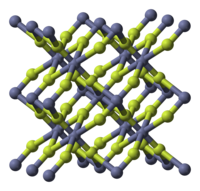
| படிக அமைப்பு | tetragonal (anhydrous), tP6 |
| புறவெளித் தொகுதி | P42/mnm, No. 136 |
| தீங்குகள் | |
மாறுதலாக ஏதும் சொல்லவில்லை என்றால் கொடுக்கப்பட்ட தரவுகள் யாவும் பொருள்கள் அவைகளின் இயல்பான வெப்ப அழுத்த நிலையில் (25°C, 100kPa) இருக்கும். | |
துத்தநாக புளோரைட்டு ( Zinc fluoride ) என்பது ZnF2 என்ற மூலக்கூறு வாய்பாடு கொண்ட ஒரு கனிம வேதியியல் சேர்மமாகும். இது நீரிலி மற்றும் சாய்சதுர படிகவடிவ நான்மநீரேறி ZnF2 · 4H2O ஆகிய நிலைகளில் காணப்படுகிறது[1]. இவ்வுப்பின் உருகுநிலை 872 பாகை செல்சியசு வெப்பநிலை ஆகும். மற்றும் இது ஆறு துத்தநாக அணுக்கள் இணைப்புத் தொடராக கொண்ட உரூத்தைல் கட்டமைப்பால் ஆக்கப்பட்டுள்ளதால் வேதிப்பிணைப்பில் அயனிப் பிணைப்புத் தன்மையைக் காட்டுகிறது[2]. துத்தநாக குளோரைடு, துத்தநாக புரோமைடு மற்றும் துத்தநாக அயோடைடு போன்ற மற்ற துத்தநாக ஆலைடுகள் போல நீரில் அதிகமாக கரையாது[2].
துத்தநாக புளோரைட்டு பல்வேறு தொகுப்பு முறைகளில் தயாரிக்கப்படுகிறது.
- ஒரு புளோரைட்டு உப்புடன் துத்தநாக குளோரைடு வினை புரிந்து துத்தநாக புளோரைட்டு மற்றும் ஒரு குளோரைடு உப்பு உண்டாகிறது.
- துத்தநாக உலோகத்துடன் புளோரீன் வாயு வினைபுரிந்து துத்தநாக புளோரைட்டு உண்டாகிறது[2].
- ஐதரோபுளோரிக் அமிலத்துடன் துத்தநாகம் வினைபுரிந்து துத்தநாக புளோரைட்டு மற்றும் ஐதரசன் வாயு உண்டாகிறது[2].
துத்தநாக புளோரைட்டு சூடான நிரினால் நீராற் பகுத்தல் வினைக்குட்பட்டு துத்தநாக ஐதராக்சி புளோரைட்டு உண்டாகிறது[3].
மேற்கோள்கள்
[தொகு]- ↑ Perry, D. L.; Phillips, S. L. (1995). Handbook of Inorganic Compounds. CRC Press. பன்னாட்டுத் தரப்புத்தக எண் 0-8493-8671-3.
{{cite book}}: CS1 maint: multiple names: authors list (link) - ↑ 2.0 2.1 2.2 2.3 Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ed.). Butterworth-Heinemann. பன்னாட்டுத் தரப்புத்தக எண் 0080379419.
- ↑ Srivastava, O. K.; Secco, E. A. (1967). "Studies on Metal Hydroxy Compounds. I. Thermal Analyses of Zinc Derivatives ε-Zn(OH)2, Zn5(OH)8Cl2 · H2O, β-ZnOHCl, and ZnOHF" (pdf). Canadian Journal of Chemistry 45 (6): 579–583. doi:10.1139/v67-096. http://www.nrcresearchpress.com/doi/pdf/10.1139/v67-096.
