துத்தநாக பெர்குளோரேட்டு
| |

| |
| பெயர்கள் | |
|---|---|
| வேறு பெயர்கள்
துத்தநாக இருபெர்குளோரேட்டு, துத்தநாக(II) பெர்குளோரேட்டு
| |
| இனங்காட்டிகள் | |
| 13637-61-1 | |
| ChemSpider | 8374666 |
| EC number | 237-122-0 |
InChI
| |
| யேமல் -3D படிமங்கள் | Image |
| பப்கெம் | 10199167 |
SMILES
| |
| UNII | 725JL07841 |
| பண்புகள் | |
| Cl 2O 8Zn | |
| வாய்ப்பாட்டு எடை | 261.826 |
| தோற்றம் | நிறமற்ற திண்மம் |
| அடர்த்தி | 2.252 கி/செ.மீ3 |
| உருகுநிலை | 106 °C (223 °F; 379 K) |
| கொதிநிலை | 210 °C (410 °F; 483 K) |
| கரையும் | |
மாறுதலாக ஏதும் சொல்லவில்லை என்றால் கொடுக்கப்பட்ட தரவுகள் யாவும் பொருள்கள் அவைகளின் இயல்பான வெப்ப அழுத்த நிலையில் (25°C, 100kPa) இருக்கும். | |
| Infobox references | |
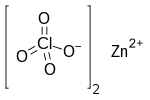
துத்தநாக பெர்குளோரேட்டு (Zinc perchlorate) என்பது Zn(ClO4)2 என்ற மூலக்கூற்று வாய்ப்பாட்டால் விவரிக்கப்படும் ஒரு வேதியியல் சேர்மமாகும். அறுநீரேற்றாக இது உருவாகிறது.[1][2]
தயாரிப்பு[தொகு]
துத்தநாக ஆக்சைடு அல்லது துத்தநாக கார்பனேட்டை பெர்குளோரிக் அமிலத்தில் கரைத்தால் துத்தநாக பெர்குளோரேட்டு உருவாகும்:[3]
வேதிப்பண்புகள்[தொகு]
உயர் வெப்பநிலைக்கு சூடாக்கப்படும் போது இச்சேர்மம் சிதைவடைகிறது. துத்தநாக பெர்குளோரேட்டு மிகவும் வலுவாக சூடேற்றப்பட்டால் வெடிக்க நேரிடலாம்.
தாமிர பெர்குளோரேட்டு மற்றும் காரீய பெர்குளோரேட்டு போன்ற மற்ற பெர்குளோரேட்டுகளைப் போலவே, துத்தநாக பெர்குளோரேட்டுகளும் ஈரமுறிஞ்சுகின்றன.
8-அமினோகுயினோலின், முக்கார்போ ஐதரசைடு மற்றும் டெட்ராபீனைலெத்திலீன் டெட்ராடிரையசோல் போன்ற ஈந்தணைவிகளுடன் துத்தநாக பெர்குளோரேட்டு ஒருங்கிணைவுச் சேர்மங்களை உருவாக்குகிறது.[4]
இயற்பியல் பண்புகள்[தொகு]
Zn(ClO4)2·6H2O என்ற வாய்ப்பாட்டைக் கொண்ட அறுநீரேற்றாக துத்தநாக பெர்குளோரேட்டு உருவாகிறது. துத்தநாக பெர்குளோரேட்டு ஒரு நீருறிஞ்சும் திண்மப் பொருளாக நிறமற்றும், மணமற்றும் காணப்படுகிறது. நீரில் கரைகிறது. குறைந்த எடையுள்ள ஆல்ககால்களை உருவாக்குகிறது.[5][6]
பயன்கள்[தொகு]
துத்தநாக பெர்குளோரேட்டு ஒரு வினையூக்கியாகவும் ஆக்சிசனேற்றியாகவும் பயன்படுத்தப்படுகிறது.
மேற்கோள்கள்[தொகு]
- ↑ Kumar, Raj; Thilagavathi, Ramasamy; Gulhane, Rajesh; Chakraborti, Asit K. (2 May 2006). "Zinc(II) perchlorate as a new and highly efficient catalyst for formation of aldehyde 1,1-diacetate at room temperature and under solvent-free conditions" (in en). Journal of Molecular Catalysis A: Chemical 250 (1): 226–231. doi:10.1016/j.molcata.2006.01.063. பன்னாட்டுத் தர தொடர் எண்:1381-1169. https://www.sciencedirect.com/science/article/abs/pii/S1381116906005164. பார்த்த நாள்: 14 March 2023.
- ↑ (in en) Advances in Inorganic Chemistry. Academic Press. 5 December 1984. பக். 283. பன்னாட்டுத் தரப்புத்தக எண்:978-0-08-057877-4. https://books.google.com/books?id=U-YOlLVuV1YC&dq=zinc(II)+Perchlorate&pg=PA283. பார்த்த நாள்: 14 March 2023.
- ↑ Lin, Lili; Liu, Xiaohua; Feng, Xiaoming (27 May 2014). "Zinc(II) Perchlorate Hexahydrate". Encyclopedia of Reagents for Organic Synthesis: 1–5. doi:10.1002/047084289X.rn01657. பன்னாட்டுத் தரப்புத்தக எண்:9780470842898. https://onlinelibrary.wiley.com/doi/abs/10.1002/047084289X.rn01657. பார்த்த நாள்: 14 March 2023.
- ↑ "8-aminoquinoline zinc perchlorate metal complex, and preparation method and application thereof" (in ஆங்கிலம்). 30 April 2014. பார்க்கப்பட்ட நாள் 14 March 2023.
- ↑ "Zinc Perchlorate Hexahydrate" (in ஆங்கிலம்). American Elements. பார்க்கப்பட்ட நாள் 14 March 2023.
- ↑ "Zinc perchlorate hexahydrate". Sigma Aldrich. பார்க்கப்பட்ட நாள் 14 March 2023.


