சல்பூரிக் அமிலம்: திருத்தங்களுக்கு இடையிலான வேறுபாடு
அடையாளங்கள்: கைப்பேசியில் செய்யப்பட்ட தொகுப்பு கைப்பேசி வலைத்தளத்தில் செய்யப்பட்ட தொகுப்பு |
அடையாளங்கள்: கைப்பேசியில் செய்யப்பட்ட தொகுப்பு கைப்பேசி வலைத்தளத்தில் செய்யப்பட்ட தொகுப்பு |
||
| வரிசை 93: | வரிசை 93: | ||
== முக்கியத்துவம் == |
== முக்கியத்துவம் == |
||
இரசாயனங்களின் அரசன் என்று அழைக்கப்படும் அளவுக்கு இந்த கந்தக அமிலம் முக்கிய பங்கு வகிக்கிறது. உலக இரசாயன உற்பத்தியில் 6% கந்தக அமிலம் இன்றியமையாதது. மேலும் நூற்றுக்கணக்கான இரசாயனங்கள் உற்பத்தி செய்ய கந்தக அமிலம் அடிப்படையாக அமைகிறது. |
|||
== வேதியியல் பண்புகள் == |
== வேதியியல் பண்புகள் == |
||
17:03, 6 செப்டெம்பர் 2019 இல் நிலவும் திருத்தம்
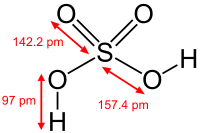
| |

| |
| பெயர்கள் | |
|---|---|
| ஐயூபிஏசி பெயர்s
Sulfuric acid
(சல்ஃவூரிக் ஆசிட்) கந்தக அமிலம் | |
| வேறு பெயர்கள்
விட்ரியோல் எண்ணெய் ("Oil vitriol")
| |
| இனங்காட்டிகள் | |
| 7664-93-9 | |
| EC number | 231-639-5 |
| வே.ந.வி.ப எண் | WS5600000 |
| UN number | 1830 |
| பண்புகள் | |
| H2SO4 | |
| வாய்ப்பாட்டு எடை | 98.08 கி/மோல் (g/mol) |
| தோற்றம் | தெளிவான நிறமற்ற மணமற்ற நீர்மம் |
| அடர்த்தி | 1.84 g/cm3, நீர்மம் |
| உருகுநிலை | 10 °C (50 °F; 283 K) |
| கொதிநிலை | 290 °C (554 °F; 563 K) |
| கலக்ககூடியது | |
| காடித்தன்மை எண் (pKa) | −3 |
| பிசுக்குமை | 26.7 cP (20 °C) |
| தீங்குகள் | |
| பொருள் பாதுகாப்பு குறிப்பு தாள் | ICSC 0362 |
| ஈயூ வகைப்பாடு | Corrosive (C) |
| R-சொற்றொடர்கள் | R35 |
| S-சொற்றொடர்கள் | (S1/2), S26, S30, S45 |
| தீப்பற்றும் வெப்பநிலை | தீப்பற்றாது |
| தொடர்புடைய சேர்மங்கள் | |
| கடுங்காடிகள் தொடர்புடையவை |
Selenic acid Hydrochloric acid Nitric acid |
| தொடர்புடைய சேர்மங்கள் | Sulfurous acid Peroxymonosulfuric acid Sulfur trioxide Oleum |
மாறுதலாக ஏதும் சொல்லவில்லை என்றால் கொடுக்கப்பட்ட தரவுகள் யாவும் பொருள்கள் அவைகளின் இயல்பான வெப்ப அழுத்த நிலையில் (25°C, 100kPa) இருக்கும். | |
| Infobox references | |
கந்தக அமிலம் (Sulfuric or sulphuric acid, H2SO4), ஒரு கடுமையான கரிமமற்ற அமிலம் (தாது அமிலம்). இது நீரில் எல்லா அளவிலும் (அடர்த்தியிலும்) கலந்து கரையக்கூடியது. கந்தக அமிலம் பல்வேறு தொழிலகங்களில் மிகப் பயன்படும் ஒரு வேதியியற் பொருள். 2001 ஆண்டின் கணக்குப்படி ஏறத்தாழ $8 பில்லியன் அமெரிக்க டாலர் மதிப்புடைய 165 மில்லியன் டன் கந்தக அமிலம் உற்பத்தி செய்யப்பட்டது. 2011-12ல் 250 மில்லியன் டன் அளவுக்கு உற்பத்தி அதிகரித்துள்ளது.2016 ல் 10.1 பில்லியன் அமெரிக்க டாலர் அளவுக்கு கந்தக அமிலம் வருவாய் தந்துள்ளது.முக்கிய பயன்பாடுகள்: உரம் செய்தல், கனிமங்களைப் பிரித்தெடுத்தல், எரியெண்ணெய் தூய்மைப்படுத்துதல், தானுந்துகளில் பயன்படும் ஈயம்-காடி மின்கலங்கள் செய்தல், கழிவுநீர் தூய்மைப்படுத்தல், பல்வேறு வேதியியல் பொருள்கள் செய்தல், சாயம், நிறப்பூச்சுகளில் நிறப்பொருள்கள் செய்தல், மருந்துகள், வெடிமருந்துகள் செய்தல் ஆகியவை.
கந்தக அமிலம் பார்ப்பதற்கு நிறமற்றதாக இருக்கும். இது அடர்த்தியான அரிப்புத்தன்மை மிக்க ஒரு வேதிப்பொருள். இதனை ஐதரசன் சல்பேட்டு (Hydrogen Sulfate) என்றும் கூறுவதுண்டு. இடைக்கால ஐரோப்பியாவில் இதனை ஆயில் ஆஃவ் விட்ரியோல் (Oil of Vitriol) என்றும் கூறினர், ஏனெனில் இந்த அமிலத்தின் பயன்பாட்டால் பெறும் வெவ்வேறு சல்பேட்டு உப்புகள் பல நிறங்களில் கண்ணாடி போன்று காட்சி அளித்தன. கண்ணாடியின் இலத்தீன் மொழிச்சொல் விட்ரியசு (vitreus).
கிடைப்பு
தூய கந்தக அமிலம் நீர் ஈர்ப்புத்தன்மை (நீரில் எளிதில் கரையும் தன்மை) கொண்டதால் இயற்கையில் நிலவுலகில் கிடைப்பதில்லை. ஆனால் அமில மழையில் உள்ள அமிலங்களில் இதுவும் ஒன்று. அமிலமழையில் உள்ள கந்தக அமிலம், வளிமண்டலத்தில் உள்ள நீர் மூலக்கூறுகளுடம் சேர்ந்து ஆக்சைடாகும் கந்தக-டை-ஆக்சைடால் நிகழ்கின்றது - அதாவது சல்பரசுக் காடி (கந்தசக் காடி) (H2SO3) ஆக்சைடாக்கத்தால் கந்தக அமிலம் (H2SO4)ஆகின்றது. நிலக்கரி, எரியெண்ணெய் போன்ற கந்தகம் கலந்துள்ள பல்வேறு எரிபொருள்களை எரிப்பதால் விளைபொருளாக கந்தக-டை-ஆக்சைடு உருவாகின்றது.
இரும்பு சல்பைடு (iron sulfide) போன்ற கனிமங்களின் சல்பைடு ஆக்சைடாவதால் இயல்பாய் கந்தக அமிலம் உருவாகின்றது. இப்படிக் கனிமங்களின் சுரங்கங்களில் இருந்து வெளியாகும் நீர் மிகுந்த காடித்தன்மை கொண்டிருக்கும். இதனை சுரங்க அமிலக்கழிவுநீர் (AMD, Acid Mine Drainage) அல்லது பாறை அமிலக் கழிவுநீர் (ARD) என்பர். இந்தக் காடிநீர் சல்பைடு கலந்த கிட்டம் அல்லது கனிமமணலில் (ore) உள்ள மாழைகளை (உலோகங்களை)க் கரைக்கக்கூடியது. அப்படிக் கரைத்து ஓடும் நீர் பளிச்சென்ற நிறத்தில் இருக்கும். இரும்பு சல்பைடு பைரைட்டு (FeS2) ஆக்சிசன் மூலக்கூறால் ஆக்சைடாக்கப்பட்டு இரும்பு (II) அல்லது Fe2+: .
Fe2+ மேலும் ஆக்சைடாக்கப்படு Fe3+ ஆகும், கீழ்க்காணுமாறு:
மேலும் உருவாகும் Fe3+ ஐதராக்சைடு அல்லது ஐதரசு ஆக்சைடு ஆக படிவிக்கலாம்.
இரும்பு(III) மின்மவணுவும் (ஃவெர்ரிக் அயர்ன் ("ferric iron") என்று பொதுப்படக் கூறப்படுவது) பைரட்டை (pyrite) ஆக்சைடாக்க இயலும். பைரைட்டின் இரும்பு(III)-ஆக்சைடாக்கத்தின் பொழுது அந்நிகழ்வு மிக விரைந்து நடக்ககூடும். பிஎச் (அமில-காரத்தன்மை) மதிப்பு சுழிக்கும் கீழே சென்று எதிர்ம எண்ணாகக் கூட அமைவதை பாறைகளில் அளவிட்டு இருக்கின்றனர்.
வெள்ளியின் (கோள்) வளிமண்டலம்
வெள்ளியின் வளிமண்டலத்தின் மேற்பகுதிகளில் உள்ள கார்பன்-டை-ஆக்சைடு, சல்பர்-ஆக்சைடு நீராவி ஆகியவை கதிரவனின் ஒளிவேதியியல் வினைகளால் கந்தக அமிலம் விளைவிக்கின்றது. 169 நானோமீட்டர் அலைநீளத்தை விட குறைவான புற ஊதாக்கதிர்கள் ஒளிச்சிதைவு வினைவழி கார்பன்-டை-ஆக்சைடை, பிரித்து கார்பன் மோனாக்சைடு, தனியணு ஆக்சிசன் ஆக மாற்றவல்லன.
தனியணு ஆக்சிசன் மிகவும் வீரியத்துடன் வினைப்படும். இது வெள்ளி வளிமண்டலத்தில் மிகமிகச் சிறிய இம்மியளவாக உள்ள சல்பர்-டை-ஆக்சைடை மாற்றி சல்பர்-டிரை-ஆக்சைடாக மாற்றி வெள்ளி வளிமண்டலத்தில் இம்மியளவாக உள்ள நீராவியுடன் இணைந்து கந்தகக் காடி உருவாகுகின்றது.
வெள்ளியின் வளிமண்டலத்தின் குளிர்ந்த மேல் மட்டங்களில், கந்தக அமிலம் நீர்ம வடிவில் இருக்கும், இதனால் கந்தக அமிலம் வெள்ளி "முகில்"கள் கீழே உள்ள பரப்ப்புகளை மறைக்கின்றன. கோளின் முதன்மையான முகில்கள் கோளின் பரப்புக்கு மேல் 45–70 கிமீ வரை இருக்கின்றன. அடர்த்தி குறைந்த முகில்கள் 30 கிமீ முதல் 90 கிமீ வரையும் இருக்கும்.
உற்பத்தி முறை
கந்தக அமிலம் தொடுமுறை (contact process) என்னும் முறைப்படி கந்தகம், ஆக்சிசன்,நீர் ஆகியவற்றை வேதியியல் வினைவழி இணையச்செய்து உருவாக்கப்படுகின்றது.
இச் செய்முறையின் முதற்படியில், கந்தகத்தை எரியச்செய்து சல்பர்-டை-ஆக்சைடு உருவாக்கப்படுகின்றது
- (1) வார்ப்புரு:கந்தகம்(தி (s)) + O2(வ (g)) → SO2(வ,g)
இது பின்னர் வனேடியம்(V) ஆக்சைடை வினையூக்கியாக பயன்படுத்தி ஆக்சிசனைப் பயன்படுத்தி சல்பர்-டிரை-ஆக்சைடாக மாற்ற ஆக்சைடாக்கப்படுகின்றது.
இப்படி உருவாக்கப்பட்ட சல்பர்-டிரை-ஆக்சைடு, 97-98% H2SO4 உக்குள் உள்வாங்கப்பட்டு ஒலியம்(oleum)(H2S2O7) ஆக மாறுகின்றது - இது புகையும் கந்தக அமிலம்(fuming sulfuric acid) என்றும் அழைக்கப்படுகின்றது. இந்த ஓலியம் (oleum) நீருடன் கலந்து அடர்த்தியான கந்தக அமிலமாக மாறுகின்றது.
- (3) H2SO4(நீ,l) + SO3 → H2S2O7(நீ,l)
- (4) H2S2O7(நீ,l) + H2O(நீ,l) → 2 H2SO4(நீ,l)
SO3 ஐ நேரடியாக நீரில் கலப்பது செயல்படுத்தக் கடினமான முறை, ஏனெனில் அவ் வேதியியல் வினை வெப்பம் உமிழ் வினை. இவ்வினையின் விளைவாக நீர்ம வடிவில் கந்தக அமிலம் பெறுவதற்கு மாறாக, மிகவும் அரிப்புத்திறன் கொண்ட நீர்மத்துளிவளி (aerosol) உருவாவதால் அவற்றை பிரிப்பது கடினமாக உள்ளது.
1900 ஆண்டுக்கு முன்னர் , கந்தக அமிலத்தை ஈய அறை செய்முறை (சேம்பர் புரோசசு, chamber process) என்னும் முறையால் படைத்தனர்[1].
முக்கியத்துவம்
இரசாயனங்களின் அரசன் என்று அழைக்கப்படும் அளவுக்கு இந்த கந்தக அமிலம் முக்கிய பங்கு வகிக்கிறது. உலக இரசாயன உற்பத்தியில் 6% கந்தக அமிலம் இன்றியமையாதது. மேலும் நூற்றுக்கணக்கான இரசாயனங்கள் உற்பத்தி செய்ய கந்தக அமிலம் அடிப்படையாக அமைகிறது.
வேதியியல் பண்புகள்
அடர்த்தி மிக்க கந்தக்காடியை சக்கரையுடன் (சீனியுடன்) இயையச் செய்தால் (வேதி வினைவழி தொழிற்படச்செய்தால்), சக்கரையில் உள்ள ஆக்சிசன், ஐதரசனை நீக்கி (அதாவது "நீரகற்றி"), புரைமையுடைய (porous) தனிக் கரிமத்தைப் பிரித்தெடுத்து விடுகின்றது. இதில் கந்தக அமிலம், சக்கரையைப் பிரிப்பதற்கு மட்டுமே உதவுகின்றது, மற்றபடி அது விளையும் பொருட்களில் கலப்பதில்லை. இந்த வேதி வினையில், நீர் (வளிமமாக, ஆவியாக) வெளிப்படுகின்றது (எனவே நீரகற்றி வினை), வெப்பமும் வெளிப்படுகின்றது. இந்த வேதிப் பிரிகையை கீழ்க்காணுமாறு காட்டலாம் (இதன் விளைபொருட்களில் கந்தக அமிலத்தின் கூறுகள் ஏதும் இல்லை என்பதைக் காணலாம்) :
- C12H22O11 → 12C + 11H2O
பயன்பாடுகள்

கந்தக அமிலம் தொழிலகங்களில் பயன்படும் மிக முக்கியமான ஒரு பொருள். ஒரு நாட்டின் தொழி வளர்ச்சியின் அளவு அல்லது வலிமையைக் கந்தக அமிலத்தின் அளவைக் கொண்டு அளவிடலாம் என்பர் .[2] கந்தக அமிலத்தின் படைப்பு ஏறத்தாழ ஆண்டுக்கு அமெரிக்க $ 8 பில்லியன். ஆண்டொன்றுக்கு படைக்கப்படும் ஏறத்தாழ 165 மில்லியன் டன்னில் பெரும்பகுதி (உலகளாவிய படைப்பளவில் 60%) பாசுப்பேட்டு உரம் தயாரிக்க உதவும் பாசுபாரிக் அமிலம் படைக்கவும், துணிசோப்பு (detergent) செய்யத் தேவைபப்டும் டிரைசோடியம் பாசுப்பேட்டு (trisodium phosphate) படைக்கவும் பயன்படுகின்றது.சிமென்ட் ,பெயிண்ட், பேப்பர் தயாரிப்பில் கணிசமாக பயன்படுகிறது.
அடிக்குறிப்புகளும் மேற்கோள்களும்
- ↑ Edward M. Jones, "Chamber Process Manufacture of Sulfuric Acid," Industrial and Engineering Chemistry, Nov 1950, Vol 42, No. 11, pp 2208-10.
- ↑ Chenier, Philip J. (1987). Survey of Industrial Chemistry. New York: John Wiley & Sons. பக். 45–57. பன்னாட்டுத் தரப்புத்தக எண்:0471010774.
