ஆர்சனசு அமிலம்

| |
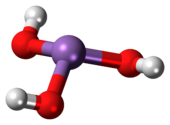
| |
| பெயர்கள் | |
|---|---|
| ஐயூபிஏசி பெயர்
ஆர்செனசு அமிலம்
| |
| வேறு பெயர்கள்
ஆர்சனியசு அமிலம்
ஆர்சனிக் ஆக்சைடு | |
| இனங்காட்டிகள் | |
| 13464-58-9 | |
| ChEBI | CHEBI:49900 |
| ChemSpider | 530 |
| DrugBank | DB04456 |
| யேமல் -3D படிமங்கள் | Image |
| பப்கெம் | 545 |
SMILES
| |
| பண்புகள் | |
| H3AsO3 | |
| வாய்ப்பாட்டு எடை | 125.94 கி/மோல் |
| தோற்றம் | நீர்த்த கரைசல்களில் மட்டுமே உள்ளது |
| தீங்குகள் | |
| முதன்மையான தீநிகழ்தகவுகள் | நச்சுத்தன்மை மிக்கது, அரிக்கும் |
| தொடர்புடைய சேர்மங்கள் | |
| தொடர்புடைய சேர்மங்கள் | ஆர்செனிக் அமிலம் |
மாறுதலாக ஏதும் சொல்லவில்லை என்றால் கொடுக்கப்பட்ட தரவுகள் யாவும் பொருள்கள் அவைகளின் இயல்பான வெப்ப அழுத்த நிலையில் (25°C, 100kPa) இருக்கும். | |
| | |
| Infobox references | |
ஆர்சனசு அமிலம் (Arsenous acid ) என்பது H3AsO3 என்ற மூலக்கூற்று வாய்ப்பாடுடன் உள்ள ஒரு வேதிச் சேர்மமாகும். இது ஆர்சனியசு ஆமிலம் என்றும் அழைக்கப்படுகிறது. நீர்த்த கரைசல் நிலையிலேயே அறியப்படும் இச்சேர்மம் தூய்மையான நிலையிலுள்ள வேதிப்பொருளாக தனிமைப்படுத்தப்படவில்லை. இருந்தபோதிலும் இப்பண்பால் As(OH)3 சேர்மத்தின் தனித்துவத்திற்கு இழுக்கு ஏதுமில்லை[1]
பண்புகள்[தொகு]
ஆர்சனிக்குடன் மூன்று ஐதராக்சில் தொகுதிகள் பிணைக்கப்பட்ட பட்டைக்கூம்பு மூலக்கூறு வடிவத்தில் As(OH)3 காணப்படுகிறது. ஆர்செனசு அமிலக் கரைசலின் 1H அணுக்கரு காந்த அலைமாலையில் மூலக்கூறின் உயர் சீரொழுங்கிற்கு ஒற்றைக் குறிகை முரணற்று காணப்படுகிறது[2]. இதற்கு மாறாக இதனுடன் பெயரளவில் தொடர்புடைய பாசுபரசு வழிப்பொருட்கள் (H3PO3) பிரதானமாக HPO(OH)2 வடிவத்தை ஏற்கின்றன;P(OH)3 என்பது மிகச்சிறு சமநிலைப் பாகமாக அத்தகைய கரைசல்களில் காணப்படுகிறது. ஆர்சனிக் மற்றும் பாசுபரசு சேர்மங்களின் இத்தைகைய மாறுபட்ட குணங்கள் ஒரு குறிப்பிட்ட வகையான போக்கை பிரதிபலிக்கின்றன. இதன்படி உயர் ஆக்சிசனேற்ற நிலையிலுள்ள முதன்மைத் தொகுதித் தனிமங்களில் அடர்குறை உலோகங்கள் அடர்மிகு ஓரின உலோகங்களைவிட அதிக நிலைப்புத் தன்மையுடன் காணப்படுகின்றன[3]
வினைகள்[தொகு]
ஆர்சனிக் மூவாக்சைடை தண்ணீரில் நீராற்பகுக்கும்போது அது மெதுவாக நீராற்பகுப்பு அடைந்து ஆர்சனசு அமிலத்தைக் கொடுக்கிறது. இதனுடன் காரத்தைச் சேர்க்கும் போது ஆர்சனிக் அமிலம், [AsO(OH)2]−, [AsO2(OH)]2−, மற்றும் [AsO3]3−.என்ற ஆர்செனைட் அயனிகளாக மாற்றப்படுகிறது. முதல் அமிலத்தன்மை எண் மதிப்பு (pKa) 9.2 என்பதால் ஆர்சனசு அமிலம் ஒரு வீரியம் குறைந்த அமிலமாகும்[3]. ஆர்சனசு அமிலம் மற்றும் அதனுடைய இணை காரங்களின் இயற்பண்புகளால் நீர்த்த ஆர்சனிக் மூவாக்சைடின் வினைகள் நிகழ்கின்றன.
நச்சுத்தன்மை[தொகு]
ஆர்சனிக் சேர்ந்துள்ள சேர்மங்கள் யாவும் அதிக நசுத்தன்மை கொண்டனவாகவும் புற்றுநோயாக்க வேதிப்பொருட்களாகவும் உள்ளன. இதனுடைய நீரிலி வடிவம் மற்றும் ஆர்சனிக் மூவாக்சைடு சேர்மங்கள் களைக்கொல்லி, பூச்சிக்கொல்லி மற்றும் எலிக்கொல்லிகள் தயாரிக்கப் பயன்படுகின்றன.
மேற்கோள்கள்[தொகு]
- ↑ Munoz-Hernandez, M.-A. (1994). "Arsenic: Inorganic Chemistry". Encyclopedia of Inorganic Chemistry. Ed. King, R. B.. Chichester: John Wiley & Sons.
- ↑ Kolozsi, A.; Lakatos, A.; Galbács, G.; Madsen, A. Ø.; Larsen, E.; Gyurcsik, B. (2008). "A pH-Metric, UV, NMR, and X-ray Crystallographic Study on Arsenous Acid Reacting with Dithioerythritol" (pdf). Inorganic Chemistry 47: 3832–3840. doi:10.1021/ic7024439. பப்மெட்:18380458. http://www.staff.u-szeged.hu/~galbx/Arsenous%20acid%20study%20%28Inorg%20Chem%202008%29.pdf. பார்த்த நாள்: 2015-07-25.
- ↑ 3.0 3.1 Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ). Butterworth-Heinemann. பன்னாட்டுத் தரப்புத்தக எண்:0080379419.
- "Arsenic trioxide". பார்க்கப்பட்ட நாள் January 29, 2006.
