ஐதரசன் அயோடைடு

| |

| |
| பெயர்கள் | |
|---|---|
| ஐயூபிஏசி பெயர்
அயோடேன்
| |
| வேறு பெயர்கள்
ஐதரோஅயோடிக் காடி (நீர்த்த கரைசல்)
அயோடின் ஐதரைடு | |
| இனங்காட்டிகள் | |
| 10034-85-2 | |
| ChemSpider | 23224 |
| யேமல் -3D படிமங்கள் | Image |
| பப்கெம் | 16109203 |
| வே.ந.வி.ப எண் | MW3760000 |
SMILES
| |
| UNII | 694C0EFT9Q |
| பண்புகள் | |
| HI | |
| வாய்ப்பாட்டு எடை | 127.904 கி/மோல் |
| தோற்றம் | நிறமற்ற வாயு |
| அடர்த்தி | 2.85 கி/மிலி (−47 °செ) |
| உருகுநிலை | −50.80 °C (−59.44 °F; 222.35 K) |
| கொதிநிலை | −35.36 °C (−31.65 °F; 237.79 K) |
| தோராயமாக 245 கி/100 மிலி | |
| காடித்தன்மை எண் (pKa) | −10 (நீரில், மதிப்பிடப்பது);[1] -9.5 (±1.0) [2] 2.8 (in acetonitrile)[3] |
| கட்டமைப்பு | |
| மூலக்கூறு வடிவம் | |
| இருமுனைத் திருப்புமை (Dipole moment) | 0.38 டிபை |
| தீங்குகள் | |
| முதன்மையான தீநிகழ்தகவுகள் | நச்சுத்தன்மை, அரிக்கும் தன்மை உடையது, தீங்கானது மற்றும் எரிச்சலுாட்டும் மணமுடையது |
| பொருள் பாதுகாப்பு குறிப்பு தாள் | hydrogen iodide hydroiodic acid |
| R-சொற்றொடர்கள் | R20, R21, R22, R35 |
| S-சொற்றொடர்கள் | S7, S9, S26, S45 |
| தீப்பற்றும் வெப்பநிலை | எளிதில் தீப்பற்றாதது |
| தொடர்புடைய சேர்மங்கள் | |
| ஏனைய எதிர் மின்னயனிகள் | ஐதரசன் புளுரைடு ஐதரசன் குளோரைடு ஐதரசன் புரோமைடு ஐதரசன் ஆசுடைடு |
மாறுதலாக ஏதும் சொல்லவில்லை என்றால் கொடுக்கப்பட்ட தரவுகள் யாவும் பொருள்கள் அவைகளின் இயல்பான வெப்ப அழுத்த நிலையில் (25°C, 100kPa) இருக்கும். | |
| | |
| Infobox references | |
ஐதரசன் அயோடைடு (Hydrogen iodide) என்பது HI மூலக்கூறு வாய்ப்பாடு கொண்ட ஒரு ஈரணு மூலக்கூறு ஐதரசன் ஆலைடு ஆகும். நீர்த்த கரைசலான HI கரைசல்கள் ஐதரோ அயோடிக் காடி அல்லது ஐதரையோடிக் காடி என்றழைக்கப்படும் வலிமைமிகு அமிலமாகும். கரிம மற்றும் கனிமச் சேர்மங்களின் தொகுப்புகளில் அயோடின் தயாரிப்பில் முதன்மை ஆதாரமாகவும், ஒடுக்கும் காரணியாகவும் HI உள்ளது.
ஐதரசன் அயோடைடு பண்புகள்[தொகு]
HI ஒரு நிறமற்ற வாயு ஆகும். இது ஆக்சிசன் உடன் வினைபுரிந்து நீர் மற்றும் அயோடினைத் தருகிறது. ஈரமான காற்றுடன், மூடுபனி அல்லது புகை போன்ற ஐதரோஅயோடிக் காடியைத் கொடுக்கிறது. ஒரு லிட்டர் நீரானது, 425 லிட்டர் ஐதரசன் அயோடைடில் கரைகிறது. ஒரு மூலக்கூறு HI, நான்கு மூலக்கூறு நீருக்கு ஈடான செறிவு மிகுந்த கரைசலை உருவாக்குகிறது.[4]
ஐதரோஅயோடிக் காடி[தொகு]
ஐதரோஅயோடிக் காடி என்பது தூய ஐதரசன் அயோடைடு ஆகாது. ஆனால், ஐதரசன் அயோடைடு கலந்த ஒரு கலவை ஆகும். வழக்கமாக வணிகரீதியான "செறிவுமிக்க" ஐதரோஅயோடிக் காடியானது, அதன் நிறையில் 48-57% HI ஐக் கொண்டுள்ளது. அயோடைடு அயனி மற்ற ஆலைடுகளை விடவும் மிகவும் பெரியதாக உள்ளதால், எதிர்மின் சுமையானது பெரிய இடைவெளிகளில் விரவி காணப்படுகிறது. மாறாக, குளோரைடு அயனி மிகவும் சிறியதாக உள்ளது, இதன் எதிர்மின்சுமை செறிவுமிக்கது. இது புரோட்டான் மற்றும் குளோரைடு அயனி இடையே வலுவான தொடர்புக்கு வழிவகுக்கிறது. HI சேர்மத்தில் உள்ள வலிமை குறைந்த H+···I− தொடர்பினால் புரோட்டான் எதிர்மின் பகுதியிலிருந்து பிரிகையடைகிறது. இதுவே ஐதரசன் ஆலைடுகளிலேயே, ஐதரசன் அயோடைடு வலிமை மிகுந்து இருப்பதற்கான காரணமாகும்.
- HI(g) + H
2O(l) → H
3O+
(aq) + I−(aq) Ka ≈ 1010 - HBr(g) + H
2O(l) → H
3O+
(aq) + Br−(aq) Ka ≈ 109 - HCl(g) + H
2O(l) → H
3O+
(aq) + Cl−(aq) Ka ≈ 106
தொகுப்புமுறை தயாரிப்பு[தொகு]
தொழிற்துறையில் ஐதரசன் அயோடைடானது (HI), அயோடின் (I2) மற்றும் ஐதரசீனை வினைபுரியச் செய்து தயாரிக்கப்படுகிறது. இதில் நைட்ரசன் வாயுவும் விளைபொருளாக உருவாகிறது.[5]
- 2 I2 + N
2H
4 → 4 HI + N
2
வினையானது நீரில் நிகழ்த்தப்படும் போது, HI ஐ காய்ச்சி வடிகட்ட வேண்டும்.
செறிவுமிக்க பாசுபாரிக் காடியில், சோடியம் அயோடைடு (NaI) அல்லது மற்ற கார அயோடைடு கரைசலில் இருந்து HI காய்ச்சி வடிகட்டப்படுகிறது (அயோடைடு அமிலத்தன்மையாக்க அடர் கந்தக அமிலத்தைப் பயன்படுத்தினால் அயோடைடானது ஆக்சிசனேற்றம் அடைந்து தனிமநிலை அயோடினாகி விடும் வாய்ப்புள்ள காரணத்தால் கந்தக அமிலத்தை இந்தச் செயல்முறைக்குப் பயன்படுத்த இயலாது என்பதை கவனத்தில் கொள்ள வேண்டும்).
மற்றொரு முறையில் நீர்த்த அயோடின் கரைசலில், ஐதரசன் சல்பைடு ஆவியை செலுத்தும் போது ஐதரோஅயோடிக் காடி (இது காய்ச்சி வடிகட்டப்படுகிறது) மற்றும் தனிம நிலைக் கந்தகம் உருவாகிறது (இது வடிகட்டிபிரிக்கப்படுகிறது):
- H2S + I2 → 2 HI + S
கூடுதலாக, H2 ஐயும் I2 ஐயும் ஒருங்கிணைப்பதன் மூலம் HI ஐ தயார் செய்யலாம்:
- H2 + I2 → 2 HI
இந்த முறையானது பொதுவாக மிகவும் தூய்மையான மாதிரிகளைப் பெறுவதற்கு மேற்கொள்ளப்படுகிறது.
H2 மற்றும் I2 மூலக்கூறுகளுக்கு இடையே நடைபெறும் வினை எளிய ஈரணு மூலக்கூறு வினையாக பல ஆண்டுகளாக கருதப்பட்டது. வாயுக்களின் கலவையை I2 இன் பிரிகை ஆற்றலுக்கு இணையான, 578 nm ஒளியின் அலைநீளத்தில் செலுத்தும்போது வினையின் வேகம் குறிப்பிடத்தக்க அளவு அதிகரித்தது, இந்த விளைவானது பின்வரும் வினைவழிமுறைக்கு ஆதரவாக அமைகிறது. அதன்படி, I2 முதலில் பிரிகையடைந்து இரண்டு அயோடின் அணுக்களை தருகிறது. அவை ஒவ்வொன்றும் ஒரு H2 மூலக்கூறுக்குப் பக்கவாட்டில் இணைந்து H−H பிணைப்பை உடைக்கிறது.[6]
ஆய்வகத்தில், மற்றொரு முறையில் பாசுபரசு டிரைஅயோடைடு (PI3) நீராற்பகுப்படையச் செய்யப்படுகிறது. இதில் பாசுபரசு டிரைபுரோமைடு (PBr3) க்கு சமானமான அயோடின் பயன்படுத்தப்படுகிறது, இந்த முறையில், I2 பாசுபரசு உடன் வினைபுரிந்து பாசுபரசு டிரைஅயோடைடு உருவாகிறது, மேலும் இது நீருடன் வினைபுரிந்து HI மற்றும் பாசுபரசு காடியைத் தருகிறது.
- 3 I2 + 2 P + 6 H
2O → 2 PI3 + 6 H
2O → 6 HI + 2 H3PO3
முக்கிய வினைகள் மற்றும் பயன்பாடுகள்[தொகு]
ஐதரசன் அயோடைடு கரைசல் காற்றில் எளிதாக ஆக்சிசனேற்றம் அடைகின்றது.
- 4 HI + O2 → 2 H
2O + 2 I2 - HI + I2 → HI3
HI
3 இன் அடர் பழுப்பு நிறத்தை உடையதாக உள்ளது. இதன் காரணமாகவே, HI இன் நாள்பட்ட கரைசல்கள் கரும்பழுப்பு நிறத்தில் தோன்றுகின்றன.
HBr மற்றும் HCl போன்று, HI ஆல்கினுடன் சேர்க்கை வினையில் ஈடுபடுகிறது.:[7]
- HI + H2C=CH2 → H
3CCH
2I
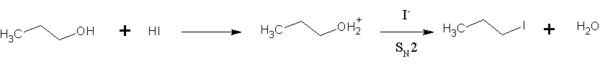
கரிம வேதியலில் ஓரிணைய ஆல்ககால், அல்கைல் ஆலைடாக மாற்றப்பட HI பயன்படுகிறது. இவ்வினை ஒரு இருமூலக்கூற்று கருக்கவர் பதிலியீட்டு வினை (SN2) ஆகும். இதில் அயோடைடு அயனி "செயல்மிக்க" ஐதராக்சில் தொகுதியால் (நீர்) இடமாற்றம் செய்யப்படுகிறது.
அயோடைடு அயனியானது, புரோமைடு அல்லது குளோரைடை விட சிறந்த கருக்கவர் காரணியாக செயல்படும் காரணத்தால், மேலே குறிப்பிட்ட வினையில், இதர ஐதரசன் ஆலைடுகளை விட ஐதரசன் அயோடைடுக்கு முன்னுரிமை வழங்கப்படுகிறது. இதன் காரணமாக, வினையானது, அதிகமாக வெப்பப்படுத்தப்பட வேண்டிய அவசியமில்லாமலேயே குறிப்பிடத்தக்க வேகத்தில் நடைபெறுகிறது. இவ்வினையானது ஈரிணைய ஆல்ககால்கள் மற்றும் மூவிணைய ஆல்ககால்களுடனும் கூட நிகழ்கிறது. ஆனால், வினையானது ஒற்றை மூலக்கூறு கருக்கவர் பதிலீட்டு வினை SN1 வழிமுறையில் நடைபெறுகிறது.
ஈதரைப் பிளவுறச் செய்து அல்கைல் அயோடைடு மற்றும் ஆல்ககால் பெறுவதற்கு HI (அல்லது HBr) பயன்படுகிறது, இது ஆல்ககாலின் பதிலீட்டு வினையை ஒத்துள்ளது. ஈதர் போன்ற வேதியியல் நிலைப்புத்தன்மை மற்றும் மந்தத் தன்மை உடைய சேர்மத்தை வினைவேகமிக்க வினைக்குழுவினைக் கொண்ட சேர்மமாக மாற்றுவதால், ஈதரின் பிணைப்பில் ஏற்படும் இத்தகைய பிளவு முக்கியத்துவம் வாய்ந்ததாக உள்ளது.[8] உதாரணமாக பின்வரும் வினையில் டைஎத்தில் ஈதரானது, எத்தனால் மற்றும் எத்தில் அயோடைடு ஆக பிளவுறச் செய்யப்படுகிறது.
அயோடைடானது குறைவான இடத்தடங்கலைக் (steric hindrance) கொண்டுள்ள ஈதர் கார்பனை தாக்குகிறது. ஆக இந்த வினையானது இடத்தெரிவு கொண்டுள்ள (regiospecific) வினையாக உள்ளது.
HCl மற்றும் HBr போன்றே, ஐதரசன் அயோடைடும் மார்கோவ்னிகாவ் விதி மற்றும் எதிர்-மார்கோவ்னிகோவ் விதிகளுக்குட்பட்ட சேர்மமாகும்.
நவீன தரங்கள் கடுமையானவையாக இருந்தாலும் கூட, கரிம வேதியியல் வரலாற்றின் ஆரம்பகாலத்தில் ஒடுக்கும் காரணியாக HI ஆனது பயன்படுத்தப்பட்டது. 19 ஆம் நூற்றாண்டில் வேதியியலாளர்கள் உயர் வெப்பநிலையில் பென்சீனை, HI ஆல் ஒடுக்கம் செய்வதன் மூலம் வளையஎக்சேன் தயாரிக்க முயன்றனர், ஆனால் அதற்கு பதிலாக மெத்தில் வளையபெண்டென் பிரித்தெடுக்கப்பட்டது. இதை முதன்முறையாக கில்லானி தெரிவித்தார்.[9].சர்க்கரை மற்றும் பிற பாலியால்கள், ஐதரோஅயோடிக் காடியால் ஒடுக்கப்படும் போது பல அல்லது அனைத்து ஐதராக்சி தொகுதிகளும் பிளவுறுகின்றன. பெரும்பாலும் குறைவான விளைபொருளே கிடைக்கிறது மேலும் இது மறுஉருவாக்கம் செய்யப்படுகிறது.[10].α-கார்போனைல் தொகுதி உள்ள ஆல்ககால்கள் மற்றும் பென்சைல் ஆல்ககால் போன்றவை HI ஆல் ஒடுக்கப்பட்டு தொகுப்புமுறையில் பயன்மிக்க அதனதன் ஐதரோகார்பன்களைத் தருகின்றன. (ROH + 2HI → RH + H
2O + I2).[7].இந்த செயல்முறையானது HI இல் சிவப்பு பாசுபரசை வினைவேகமாற்றியாக பயன்படுத்தி உருவான அயோடினானது (I2) ஒடுக்கப்படுகிறது.[11]
மேற்கோள்கள்[தொகு]
- ↑ Bell, R.P. The Proton in Chemistry. 2nd ed., Cornell University Press, Ithaca, NY, 1973.
- ↑ Trummal, A.; Lipping, L.; Kaljurand, I.; Koppel, I. A.; Leito, I. "Acidity of Strong Acids in Water and Dimethyl Sulfoxide" J. Phys. Chem. A. 2016, 120, 3663-3669. எஆசு:10.1021/acs.jpca.6b02253
- ↑ Raamat, E.; Kaupmees, K.; Ovsjannikov, G.; Trummal, A.; Kütt, A.; Saame, J.; Koppel, I.; Kaljurand, I.; Lipping, L.; Rodima, T.; Pihl, V.; Koppel, I. A.; Leito, I. "Acidities of strong neutral Brønsted acids in different media." J. Phys. Org. Chem. 2013, 26, 162-170. எஆசு:10.1002/poc.2946
- ↑ Holleman, A. F.; Wiberg, E. "Inorganic Chemistry" Academic Press: San Diego, 2001. பன்னாட்டுத் தரப்புத்தக எண் 0-12-352651-5.
- ↑ Greenwood, N. N. and A. Earnshaw. The Chemistry of the Elements. 2nd ed. Oxford: Butterworth-Heineman. p 809–815. 1997.
- ↑ Holleman, A. F. Wiberg, E. Inorganic Chemistry. San Diego: Academic Press. p. 371, 432–433. 2001.
- ↑ 7.0 7.1 Breton, G. W., P. J. Kropp, P. J.; Harvey, R. G. "Hydrogen Iodide" in Encyclopedia of Reagents for Organic Synthesis (Ed: L. Paquette) 2004, J. Wiley & Sons, New York. DOI: 10.1002/047084289.
- ↑ Bruice, Paula Yurkanis. Organic Chemistry 4th ed. Prentice Hall: Upper Saddle River, N. J, 2003 p. 438–439, 452.
- ↑ Kiliani, Heinrich (1886-01-01). "Ueber die Constitution der Dextrosecarbonsäure" (in en). Berichte der deutschen chemischen Gesellschaft 19 (1): 1128–1130. doi:10.1002/cber.188601901251. பன்னாட்டுத் தர தொடர் எண்:1099-0682. http://onlinelibrary.wiley.com/doi/10.1002/cber.188601901251/abstract.
- ↑ Perlin, A. S.; Purves, C. B. (1953-03-01). "Kiliani's Reduction of Glucose and Fructose Cyanohydrins to the Corresponding Heptanoic Acids and Lactones". Canadian Journal of Chemistry 31 (3): 227–236. doi:10.1139/v53-033. பன்னாட்டுத் தர தொடர் எண்:0008-4042. http://www.nrcresearchpress.com/doi/abs/10.1139/v53-033.
- ↑ Dobmeier, Michael; Herrmann, Josef M; Lenoir, Dieter; König, Burkhard (2012-03-02). "Reduction of benzylic alcohols and α-hydroxycarbonyl compounds by hydriodic acid in a biphasic reaction medium" (in en). Beilstein Journal of Organic Chemistry 8 (1): 330–336. doi:10.3762/bjoc.8.36. பப்மெட்:22423302. பப்மெட் சென்ட்ரல்:3302097. http://www.beilstein-journals.org/bjoc/content/8/1/36.
- Nishikata, E., T.; Ishii, and T. Ohta. "Viscosities of Aqueous Hydrochloric Acid Solutions, and Densities and Viscosities of Aqueous Hydroiodic Acid Solutions". J. Chem. Eng. Data. 26. 254-256. 1981.

![{\displaystyle {\ce {{H2}+{I2}->[{\text{578 nm radiation}}]{H2}+2I->I{\cdots }H{\cdots }H{\cdots }I->2HI}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/66229b185f4cf75e9c745f773af370ab34319202)