வெள்ளி சல்பேட்டு
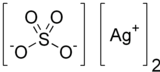
| |

| |
| பெயர்கள் | |
|---|---|
| ஐயூபிஏசி பெயர்
வெள்ளி சல்பேட்டு
| |
| வேறு பெயர்கள்
இருவெள்ளி(1+)உப்பு
| |
| இனங்காட்டிகள் | |
| 10294-26-5 | |
| ChemSpider | 140554? |
| EC number | 233-653-7 |
| யேமல் -3D படிமங்கள் | Image |
| பப்கெம் | 159865 |
SMILES
| |
| UNII | 8QG6HV4ZPO |
| UN number | 3077 |
| பண்புகள் | |
| Ag2O4S | |
| வாய்ப்பாட்டு எடை | 311.79 g·mol−1 |
| தோற்றம் | நிறமற்ற படிகங்கள் |
| மணம் | மணமற்றது |
| அடர்த்தி | 5.45 கி/செ.மீ3 (25 °C) 4.84 கி/செ.மீ3 (660 °செ) |
| உருகுநிலை | 652.2–660 °C (1,206.0–1,220.0 °F; 925.4–933.1 K) |
| கொதிநிலை | 1,085 °C (1,985 °F; 1,358 K)[2][4] |
| 0.57 கி/100மி.லி (0 °செ) 0.69 கி/100 மி.லி (10 °செ) 0.83 கி/100மி.லி (25 °செ) 0.96 கி/100 மி.லி (40 °செ) 1.33 கி/100மி.லி (100 °செ)[1] | |
| கரைதிறன் | நீர்த்தஅமிலங்கள், ஆல்ககால்கள், அசிட்டோன், ஈதர், அசிட்டேட்டுகள், அமைடுகள் ஆகியனவற்றில் கரையும் [1] எத்தனால்|எத்தனாலில்கரையாது. name=chemister /> |
| sulfuric acid-இல் கரைதிறன் | 8.4498 g/L (0.1 molH2SO4/LH2O)[1] 25.44 g/100 g (13 °C) 31.56 g/100 g (24.5 °C) 127.01 g/100 g (96 °C)[2] |
| ethanol-இல் கரைதிறன் | 7.109 g/L (0.5 nEtOH/H2O)[1] |
| acetic acid-இல் கரைதிறன் | 7.857 g/L (0.5 nAcOH/H2O)[1] |
| −9.29·10−5 cm3/mol | |
| ஒளிவிலகல் சுட்டெண் (nD) | nα = 1.756 nβ = 1.775 nγ = 1.782[3] |
| கட்டமைப்பு | |
| படிக அமைப்பு | சாய்சதுரம், oF56[3] |
| புறவெளித் தொகுதி | Fddd, No. 70[3] |
| வெப்பவேதியியல் | |
| Std enthalpy of formation ΔfH |
−715.9 கி.ஜூ/மோல் |
| நியம மோலார் எந்திரோப்பி S |
200.4 கி.ஜூ/மோல் |
| வெப்பக் கொண்மை, C | 131.4 ஜூ/மோல்·K |
| தீங்குகள் | |
| GHS pictograms |   [5] [5]
|
| GHS signal word | அபாயம் |
மாறுதலாக ஏதும் சொல்லவில்லை என்றால் கொடுக்கப்பட்ட தரவுகள் யாவும் பொருள்கள் அவைகளின் இயல்பான வெப்ப அழுத்த நிலையில் (25°C, 100kPa) இருக்கும். | |
| | |
| Infobox references | |
வெள்ளி சல்பேட்டு (Silver sulfate) என்பது Ag2SO4 என்ற மூலக்கூற்று வாய்ப்பாடு கொண்டதொரு அயனிச் சேர்மமாகும். வெள்ளி முலாம் பூசுதலிலும் கறைபடுத்தாமலிருக்க வெள்ளி நைட்ரேட்டுக்கு மாற்றாகவும் இது பயன்படுகிறது. இச்சேர்மம் நீரில் சிறிதளவு கரையக்கூடியதாக உள்ளது. சாதாரண அறை வெப்பநிலையில் நிலைப்புத்தன்மை கொண்டுள்ளதால் இச்சல்பேட்டை எளிதாகச் சேகரிக்கவும் பயன்படுத்தவும் முடியும். ஒளி அல்லது காற்றில் படநேர்ந்தால் இது நிறம் மாறும் தன்மையுடையது.
தயாரிப்பு[தொகு]
வெள்ளி நைட்ரேட்டு கரைசலுடன் கந்தக அமிலம் சேர்த்து வினைப்படுத்துவதால் வெள்ளி சல்பேட்டைத் தயாரிக்க முடியும்.
- 2 Ag+(aq) + SO42−(aq) → Ag2SO4(s)
பின்னர் சூடான நீரில் வீழ்படிவைக் கழுவி வெள்ளி சல்பேட்டு தயாரிக்கப்படுகிறது.
வெள்ளி(II) சல்பேட்டு[தொகு]
ஓரு இணைதிறன் வெள்ளி அயனிக்குப் பதிலாக இரு இணைதிறன் வெள்ளி அயனி கொண்ட வெள்ளி(II)சல்பேட்டு முதன் முதலில் 2010 ஆம் ஆண்டில் தயாரிக்கப்பட்டதாக அறியப்படுகிறது. வெள்ளி(II) புளோரைடுடன் கந்தக அமிலத்தைச் சேர்ப்பதன் மூலம் இது தயாரிக்கப்பட்டது. கருப்பு நிறத் திடப்பொருளான இது 120 பாகை செல்சியசு வெப்பநிலையில் சிதைவடைந்து ஆக்சிசனை வெளியேற்றி பைரோ சல்பேட்டாக உருவாகிறது.
மேற்கோள்கள்[தொகு]
- ↑ 1.0 1.1 1.2 1.3 1.4 Seidell, Atherton; Linke, William F. (1919). Solubilities of Inorganic and Organic Compounds (2nd ). New York: D. Van Nostrand Company. பக். 622–623. https://archive.org/details/solubilitiesino01seidgoog.
- ↑ 2.0 2.1 Anatolievich, Kiper Ruslan. "silver sulfate". http://chemister.ru. பார்க்கப்பட்ட நாள் 2014-07-19.
{{cite web}}: External link in|website= - ↑ 3.0 3.1 3.2 Morris, Marlene C.; McMurdie, Howard F.; Evans, Eloise H.; Paretzkin, Boris; Groot, Johan H. de; Hubbard, Camden R.; Carmel, Simon J. (1976-06). Standard X-ray Diffraction Powder Patterns. 25. Washington: Institute for Materials Research National Bureau of Standards.
- ↑ 4.0 4.1 "MSDS of Silver sulfate". https://www.fishersci.ca. Fisher Scientific, Inc. பார்க்கப்பட்ட நாள் 2014-07-19.
{{cite web}}: External link in|website= - ↑ Sigma-Aldrich Co., Silver sulfate. Retrieved on 2014-07-19.
