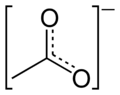
அசிட்டேட்டு
அசிட்டேட்டு (Acetate) என்பது அசிட்டிக் அமிலத்துடன் காரத்தன்மையுள்ள போரான் தொகுதி தனிமங்கள் அல்லது உலோகக் காரங்கள் வினைபுரிந்து உருவாகும் சேர்மம் ஆகும். பொதுவாக அசிட்டேட்டை அசிட்டிக் அமிலத்தினுடைய உப்பு அல்லது எசுத்தர் என்பர். மேலும் காரக் கரைசலில் உள்ள இணை காரம் அல்லது இணை அயனி (குறிப்பாக எதிர் மின்னயனி) என்றும் அசிட்டேட்டை வரையறுப்பர். C2H3O2− என்ற மூலக்கூற்று வாய்ப்பாடு அசிட்டேட்டைக் குறிக்கிறது. அசிட்டேட்டு அயனியும் ஒரு நேர்மின் அயனியும் சேர்ந்து உருவாகும் நடுநிலை மூலக்கூறுகளும் அசிட்டேட்டுகள் எனப்படுகின்றன. (காரிய அசிட்டேட்டு, அலுமினிய அசிட்டேட்டு போன்றவை) ஐதரசன் அசிட்டேட்டு ஒரு மிக எளிமையான அசிட்டேட்டு ஆகும். இதை அசிட்டிக் அமிலம் என்பர். இதனுடன் தொடர்புடைய உப்புகள் எசுத்தர்கள் எனப்படுகின்றன. மேலும் பல்லணு எதிர்மின் அயனியை CH3CO2−, அல்லது CH3COO− என்ற மூலக்கூற்று வாய்ப்பாட்டால் குறிக்கின்றனர்.
ஆண்டுதோறும் தயாரிக்கப்படும் சுமார் 5 பில்லியன் கிலோகிராம் அசிட்டிக் அமிலத்தின் பெரும்பகுதி அசிட்டேட்டு உற்பத்திகளில் பயன்படுத்தப்படுகிறது, இவை வழக்கமாக பலபடிகள் வடிவத்தை எடுத்துக் கொள்கின்றன. இயற்கையில், அசிட்டேட் என்பது உயிரித் தொகுப்பின் மிகவும் பொதுவான கட்டுறுப்புத் தொகுதி ஆகும். உதாரணமாக, கொழுப்பு அமிலங்கள் அசிட்டேட்டில் இருந்து கிடைக்கும் இரண்டு கார்பன் அணுக்களை இணைப்பதன் மூலம் கொழுப்பு அமிலங்கள் உற்பத்தி செய்யப்படுகின்றன [1].
பெயரிடலும் பொதுவாய்ப்பாடும்[தொகு]
அசிட்டேட்டு அயனியின் ஒரு பகுதி உப்பானது CH3CO2−, C2H3O2−அல்லது CH3COO−.என்ற மூலக்கூற்று வாய்ப்பாட்டால் குறிப்பிடப்படுகிறது. OAc− அல்லது AcO− என்று சுருக்கியும் வேதியியலர் அசிட்டேட்டை குறிப்பிடுவார்கள். இதனடிப்படையில் அசிட்டிக் அமிலம் HOAc என்றும் சோடியம் அசிட்டேட்டு NaOAc என்றும் எத்தில் அசிட்டேட்டு EtOAc என்றும் குறிப்பிட்டு எழுதப்படுகிறது[2]. அசிட்டேட் அயனி (CH3CO2-), அல்லது அசிட்டைல் குழு (CH3CO) வைக் குறிப்பிடுவதற்கு "Ac" (அல்லது "AC") என்ற சுருக்கக் குறியீடு சில சமயங்களில் வேதிச் சமன்பாடுகளிலும் பயன்படுத்தப்படுகிறது. ஆக்டினைடு வரிசையின் முதல் தனிமமான ஆக்டினைடுக்கும் மூலக்கூறு வாய்ப்பாடு Ac என்பதால் அசிட்டேட்டுக்கான சுருக்கக் குறியீட்டை எழுதும்போது எச்சரிக்கையாக கவனித்தல் வேண்டும். உதாரணமாக சோடியம் அசிட்டேட்டை NaC2H3O2 என்பதற்குப் பதிலாக சுருக்கமாக NaAc" என எழுதுவர். இதேபோல பெர் அசிட்டிக் அமிலத்தை எழுதும்போது OAc என்ற சுருக்கத்தையும் பயன்படுத்துவர். இச்சேர்மங்களை எழுதும்போதும் தெளிவுடன் இருத்தல் வேண்டும்.
எத்தனோயேட்டு என்று முறைபடுத்தப்பட்ட பெயர் அசிட்டேட்டுக்கு இருந்தாலும், ஐயுபிஏசி முறையிலும் அசிட்டேட்டு என்ற பெயரே நிலைபெற்று முன்நிற்கிறது [3].
உப்புகள்[தொகு]

[CH3COO]−,(அல்லது [C2H3O2]−) என்ற அசிட்டேட்டு எதிர்மின் அயனி கார்பாக்சிலேட்டு குடும்பத்தில் ஒரு உறுப்பினராகும். அசிட்டிக் அமிலத்தின் இணை காரமாகவும் இது கருதப்படுகிறது. அசிட்டிக் அமிலத்தை அசிட்டேட்டாக மாற்றலாம் :[2]
- CH3COOH ⇌ CH3COO− + H+. இதன் pH மதிப்பு 5.5 ஆகும்.
பல அசிட்டேட்டு உப்புகள் அயனப் பண்பைக் கொண்டுள்ளன. தண்ணீரில் மிக நன்றாக இவை கரைந்து போவதன் மூலம் இப்பண்பை வெளிப்படுத்துகின்றன. பொதுவாக காணப்படும் அசிடேட்டு என்பது சோடியம் அசெட்டேட்டைக் குறிக்கும். வினிகரையும் சோடியம் பைகார்பனேட்டையும் இணைப்பதன் மூலம் தயாரிக்கக்கூடிய ஒரு வெள்ளை நிறமான திண்மம் சோடியம் அசிட்டேட்டு ஆகும்.
- CH3COOH + NaHCO3 → CH3COO−Na+ + H2O + CO2
இடைநிலைத் தனிமங்கள் அசிட்டேட்டுகளால் அணைவுச் சேர்மங்களாக மாற்றப்படுகின்றன. குரோமியம்(II) அசிட்டேட்டும், அடிப்படை துத்தநாக அசிட்டேட்டுகளும் அசிட்டேட்டு அணைவுச் சேர்மங்களுக்கு உதாரணங்களாகும்.
சாயத் தொழிலில் பயன்படுத்தப்படும் அலுமினியம் அசிட்டேட்டு, அமோனியம் அசிட்டேட்டு, பொட்டாசியம் அசிட்டேட்டு போன்றவை வர்த்தக முக்கியத்துவம் வாய்ந்த அசிட்டேட்டுகளாகும். அசிட்டமைடு தயாரிப்பில் முன்னோடிச் சேர்ம்மமாக அமோனியம் அசிட்டேட்டு பயன்படுகிறது. பொட்டாசியம் அசிட்டேட்டு சிறுநீர்பெருக்கியாக உபயோகமாகிறது. இம்மூன்று உப்புகளுமே நிறமற்றவையாகும். தண்ணீரில் மிக நன்றாக கரையக்கூடியவையுமாகும்[4].
எசுத்தர்கள்[தொகு]
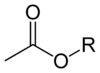
அசிட்டேட்டு எசுத்தர்களின் பொதுவான மூலக்கூற்று வாய்ப்பாடு CH3CO2R ஆகும். இங்குள்ள R ஒரு கரிமத் தொகுதியைக் குறிக்கிறது. எசுத்தர்கள் சந்தையில் அசிட்டேட்டு வடிவத்திலேயே ஆதிக்கம் செலுத்துகின்றன. அசிட்டேட்டு உப்புகளைப் போல இல்லாமல் அசிட்டேட்டு எசுத்தர்கள் பெரும்பாலும் நீர்மங்களாகவும் கொழுப்பில் கரையக்கூடியவையாகவும் சிலசமயங்களில் ஆவியாகக் கூடியனவாகவும் காணப்படுகின்றன. இனிய மணமும், குறைந்த விலையும் கொண்டு நச்சுத்தன்மை அதிகமற்று இருப்பதால் தவறற்றவையாக கருதப்பட்டு இவை அதிகமான பயன்பாட்டில் உள்ளன.
உற்பத்தி செய்யப்படும் அசிட்டிக் அமிலத்தில் ஏறத்தாழ பாதிக்கும் மேற்பட்ட அளவு வினைல் அசிட்டேட்டு உற்பத்தியில் பயன்படுத்தப்படுகிறது. வர்ணங்கள் பலவற்றில் பகுதிக்கூறாக உள்ள இது பாலிவினால் ஆல்ககால் தயாரிப்பில் முன்னோடிச் சேர்மமாகவும் உள்ளது. இதற்கு அடுத்ததாக செல்லுலோசு அசிட்டேட்டு தயாரிப்பில் அதிகமாக இதைப் பயன்படுத்துகிறார்கள். சொல்லப்போனால், "அசிட்டேட்டு" என்பது செல்லுலோசு அசிடேட் என்ற பொருளைக் குறிக்கிறது, இது இழைகள் உற்பத்தி அல்லது பல்வேறுபட்ட பொருட்களின் உற்பத்திகளில் பயன்படுத்தப்படுகிறது, உதாரணமாக, அசிட்டேட்டு தகடுகள் ஒலியைப் பதிவு செய்யும் தொழிலில் பயன்படுத்தப்படுகின்றன. பல வீட்டு உபயோகப் பொருட்கள் செல்லுலோசு அசிட்டேட்டால் தயாரிக்கப்படுகின்றன. மெத்தில் அசிட்டேட்டு, எத்தில் அசிட்டேட்டு, ஐசோபுரோப்பைல் அசிட்டேட்டு உள்ளிட்ட அசிட்டேட்டுகள் பல தொழில்துறை கரைப்பான்களாகப் பயன்படுகின்றன. பியூட்டைல் அசிடேட் என்ற அசிட்டேட்டு ஒரு வாசனையாக உணவுப் பொருட்களில் பயன்படுத்தப்படுகிறது[4].
உயிரியலில் அசிட்டேட்டுகள்[தொகு]
உயிரியியலில் ஒரு பொதுவான எதிர்மின் அயனியாக அசிட்டேட்டு பயன்படுகிறது. புரதமல்லா இணைநொதி ஏ என்ற வடிவில் உயிரினங்கள் இதைப் பிரதானமாகப் பயன்படுத்துகின்றன [5].
உடல் எடையில் ஒரு கிலோவுக்கு சோடியம் அசிட்டேட்டு 20 அல்லது 60 மி.கி அளவுக்கு உடல் உள்ளுறை ஊசியாக செலுத்தினால் அது உணர்திறன் கொண்ட எலிகளில் தலைவலியை தூண்டுவதாக கண்டறியப்பட்டது, மேலும் எத்தனாலின் ஆக்சிசனேற்றம் மூலம் கிடைக்கும் அசிட்டேட்டு பின் விளைவுகளை ஏற்படுத்துவதில் ஒரு முக்கிய காரணியாக உள்ளது. அதிகரித்த நிணநீர் அசிட்டேட்டு அளவுகள் மூளை உள்ளிட்ட பல திசுக்களில் அடினோசின் குவிப்பிற்கு வழிவகுக்கின்றன. அடினோசின் ஏற்பிகளை நிர்வகிப்பதற்காக எலிகளுக்கு காஃவீன் கொடுத்ததில் இரண்டாம் நிலை தூண்டுதல்களை குறைப்பதற்கு எத்தனால் காரணமென அறியப்பட்டது [6][7].
அசிட்டேட்டு நொதித்தல்[தொகு]
திடீர்மாற்றத்தடுப்பு வினைகளிலும் அசிட்டிக் அமிலம் ஈடுபட்டு மீத்தேனையும் கார்பனீராக்சைடையும் உற்பத்தி செய்கிறது [8][9]
- CH3COO− + H+ → CH4 + CO2 ΔG° = −36 கியூ/மோல்.
விகிதச்சமமற்ற இவ்வினை ஒருசெல் நுண்ணுயிரி மெத்தனோகெனின் வளர்சிதைமாற்றத்தால் வினையூக்கம் செய்யப்படுகிறது. கார்பாக்சில் தொகுதியின் கார்பனைல் வினையிலிருந்து ஒரு எலக்ட்ரான், அசிட்டிக் அமிலத்தின் மெத்தில் தொகுதிக்கு வழங்கப்பட்டு கார்பனீராக்சைடும் மீத்தேன் வாயுவும் உருவாகின்றன.
கட்டமைப்புகள்[தொகு]
-
அசிட்டேட்டு எதிர்மின் அயனியின் வெளிநிரப்பு மாதிரி -
அசிட்டேட்டு எதிர்மின் அயனியின் உடனிசைவு கலப்பினம் -
அசிட்டேட்டு எதிர்மின் அயனியின் நியமன வடிவம்
.
இவற்றையும் காண்க[தொகு]
மேற்கோள்கள்[தொகு]
- ↑ March, J. “Advanced Organic Chemistry” 4th Ed. J. Wiley and Sons, 1992: New York. பன்னாட்டுத் தரப்புத்தக எண் 0-471-60180-2.
- ↑ 2.0 2.1 Zumdahl, S. S. “Chemistry” Heath, 1986: Lexington, MA. பன்னாட்டுத் தரப்புத்தக எண் 0-669-04529-2.
- ↑ R-9.1 Trivial and semisystematic names retained for naming organic compounds, A Guide to IUPAC Nomenclature of Organic Compounds, IUPAC Commission on Nomenclature of Organic Chemistry
- ↑ 4.0 4.1 Hosea Cheung, Robin S. Tanke, G. Paul Torrence "Acetic acid" in Ullmann's Encyclopedia of Industrial Chemistry Weinheim, Germany: Wiley-VCH, 2005. எஆசு:045 10.1002/14356007.a01 045
- ↑ Nelson, D. L.; Cox, M. M. "Lehninger, Principles of Biochemistry" 3rd Ed. Worth Publishing: New York, 2000. பன்னாட்டுத் தரப்புத்தக எண் 1-57259-153-6.
- ↑ Christina Maxwell. "Acetate Causes Alcohol Hangover Headache in Rats". PLoS ONE 5 (12): e15963. doi:10.1371/journal.pone.0015963. பப்மெட்:21209842. பப்மெட் சென்ட்ரல்:3013144. Bibcode: 2010PLoSO...515963M. http://www.plosone.org/article/info%3Adoi%2F10.1371%2Fjournal.pone.0015963.
- ↑ 'Is coffee the real cure for a hangover?' by Bob Holmes, New Scientist, Jan. 15 2011, p. 17.
- ↑ Ferry, J.G. (1992). "Methane from acetate". Journal of Bacteriology 174 (17): 5489–5495. http://jb.asm.org/content/174/17/5489.abstract. பார்த்த நாள்: 2011-11-05.
- ↑ Vogels, G. D.; Keltjens, J. T.; Van Der Drift, C. (1988). "Biochemistry of methane production". in Zehnder A.J.B.. Biology of anaerobic microorganisms. New York: Wiley. பக். 707–770.
புற இணைப்புகள்[தொகு]
| அசிட்டேட்டுகள் | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| AcOH | He | ||||||||||||||||||
| LiOAc | Be(OAc)2 BeAcOH |
B(OAc)3 | AcOAc ROAc |
NH4OAc | AcOOH | FAc | Ne | ||||||||||||
| NaOAc | Mg(OAc)2 | Al(OAc)3 ALSOL Al(OAc)2OH Al2SO4(OAc)4 |
Si | P | S | ClAc | Ar | ||||||||||||
| KOAc | Ca(OAc)2 | Sc(OAc)3 | Ti(OAc)4 | VO(OAc)3 | Cr(OAc)2 Cr(OAc)3 |
Mn(OAc)2 Mn(OAc)3 |
Fe(OAc)2 Fe(OAc)3 |
Co(OAc)2, Co(OAc)3 |
Ni(OAc)2 | Cu(OAc)2 | Zn(OAc)2 | Ga(OAc)3 | Ge | As(OAc)3 | Se | BrAc | Kr | ||
| RbOAc | Sr(OAc)2 | Y(OAc)3 | Zr(OAc)4 | Nb | Mo(OAc)2 | Tc | Ru(OAc)2 Ru(OAc)3 Ru(OAc)4 |
Rh2(OAc)4 | Pd(OAc)2 | AgOAc | Cd(OAc)2 | In | Sn(OAc)2 Sn(OAc)4 |
Sb(OAc)3 | Te | IAc | Xe | ||
| CsOAc | Ba(OAc)2 | Hf | Ta | W | Re | Os | Ir | Pt(OAc)2 | Au | Hg2(OAc)2, Hg(OAc)2 |
TlOAc Tl(OAc)3 |
Pb(OAc)2 Pb(OAc)4 |
Bi(OAc)3 | Po | At | Rn | |||
| Fr | Ra | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | |||
| ↓ | |||||||||||||||||||
| La(OAc)3 | Ce(OAc)x | Pr | Nd | Pm | Sm(OAc)3 | Eu(OAc)3 | Gd(OAc)3 | Tb | Dy(OAc)3 | Ho(OAc)3 | Er | Tm | Yb(OAc)3 | Lu(OAc)3 | |||||
| Ac | Th | Pa | UO2(OAc)2 | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | |||||