அசிட்டிக் நீரிலி
| |

| |
| |
| பெயர்கள் | |
|---|---|
| ஐயூபிஏசி பெயர்
அசிட்டிக் நீரிலி
| |
| முறையான ஐயூபிஏசி பெயர்
எத்தனாயிக் நீரிலி | |
| வேறு பெயர்கள்
எத்தனாயில் எத்தனோயேட்
அசிட்டிக் அமில நீரிலி அசிட்டைல் அசிட்டேட் அசிட்டைல் ஆக்சைடு அசிட்டிக் ஆக்சைடு | |
| இனங்காட்டிகள் | |
| 108-24-7 | |
| ChEBI | CHEBI:36610 |
| ChemSpider | 7630 |
| EC number | 203-564-8 |
| யேமல் -3D படிமங்கள் | Image Image |
| பப்கெம் | 7918 |
| வே.ந.வி.ப எண் | AK1925000 |
| |
| UNII | 2E48G1QI9Q |
| பண்புகள் | |
| C4H6O3 | |
| வாய்ப்பாட்டு எடை | 102.09 g·mol−1 |
| தோற்றம் | colorless liquid |
| அடர்த்தி | 1.082 g cm−3, liquid |
| உருகுநிலை | −73.1 °C (−99.6 °F; 200.1 K) |
| கொதிநிலை | 139.8 °C (283.6 °F; 412.9 K) |
| 2.6 g/100 mL, see text | |
| ஒளிவிலகல் சுட்டெண் (nD) | 1.3901 |
| தீங்குகள் | |
| பொருள் பாதுகாப்பு குறிப்பு தாள் | ICSC 0209 |
| ஈயூ வகைப்பாடு | Corrosive (C) |
| R-சொற்றொடர்கள் | R10, R20/22, R34 |
| S-சொற்றொடர்கள் | (S1/2), S26, S36/37/39, S45 |
| தீப்பற்றும் வெப்பநிலை | 49 °C (120 °F; 322 K) |
| வெடிபொருள் வரம்புகள் | 2.7–10.3% |
| தொடர்புடைய சேர்மங்கள் | |
| அமில நீரிலிs தொடர்புடையவை |
Propionic anhydride |
| தொடர்புடைய சேர்மங்கள் | அசிட்டிக் காடி அசிட்டைல் குளோரைடு |
மாறுதலாக ஏதும் சொல்லவில்லை என்றால் கொடுக்கப்பட்ட தரவுகள் யாவும் பொருள்கள் அவைகளின் இயல்பான வெப்ப அழுத்த நிலையில் (25°C, 100kPa) இருக்கும். | |
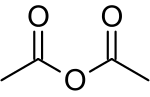
அசிட்டிக் நீரிலி (Acetic anhydride), அல்லது எத்தனாயிக் நீரிலி (ethanoic anhydride) அல்லது அசிடிக் அமில நீரிலி என்பது (CH3CO)2O என்ற வாய்பாடு கொண்ட ஒரு வேதிச்சேர்மம் ஆகும். இது சுருக்கமாக Ac2O என்றும் எழுதப்படுகிறது. தனித்துப் பிரித்தெடுக்க இயலும் எளிய அமில நீரிலியான இது கரிமத் தொகுப்பு வினைகளில் வினையூக்கியாகப் பயன்படுகிறது. இது நிறமற்ற அசிட்டிக் அமிலம் போன்ற நெடியுடைய நீர்மமாகும். நீரில் கரையாது. ஈரக்காற்றில் புகையும் தன்மையுடையது.
அமைப்பும் பண்புகளும்
[தொகு]மற்ற நீரிலிகளைப் போலவே அசிட்டிக் நீரிலியும் தளத்தில்லா நெகிழ்வான மூலக்கூறு அமைப்பைக் கொண்டிருக்கிறது. நடுவிலுள்ள ஆக்சிசனின் பை பிணைப்பு, இரண்டு கார்பனைல் ஆக்சிசன் அணுக்களுக்கு இடையிலான இருமுணை விலக்கத்துடன் ஒப்பிடுகையில் மிக பலவீனமான ஒத்ததிர்வு நிலைப்படுத்தலை வெளிப்படுத்துகிறது. தளத்திற்கு உகந்த ஒவ்வொரு பிணைப்புச் சுழற்சிக்கும் இடையே உள்ள ஆற்றல் தடைகள் மிகவும் குறைவாக [1] உள்ளதாகவும் உறுதிப்படுகிறது.
மற்ற நீரிலிகளைப் போலவே அசிட்டிக் நீரிலியில் உள்ள கார்பனைல் கார்பன் ஒரு ஆற்றல்மிக்க மின்கவரியாக குழுவை விட்டுச் செல்கிறது. ஒவ்வொரு கார்பனைல் கார்பனும் எலக்டரானைத் திரும்பப்பெறும் நல்ல இழக்கும் தொகுதியாக காணப்படுகிறது. உட்புற ஒத்தமைவின்மை அசிட்டிக் நீரிலியின் மின்கவர் தன்மைக்கான ஆற்றலைப் பங்களிக்கிறது. இச்சமச் சீரற்ற அமைப்பு வடிவியலால் கார்பனைல் கார்பனில் ஒன்று மற்றதைவிட அதிக வினையாற்றல் கொண்டுள்ளது. இவ்வாறு நிகழ்வதால் மற்றொரு கார்பனைல் கார்பனின் நேர்மின் தன்மை ஒருங்கிணைக்கப்படுகிறது.
தயாரிப்பு
[தொகு]அசிட்டிக் நீரிலி முதன் முதலில் 1852 ஆம் ஆண்டில் பிரஞ்சு வேதியியலாளர் சார்லஸ் பிரெடரிக் கெர்கார்ட் (1816-1856) என்பவரால் தொகுப்பு முறையில் தயாரிக்கப்பட்டது. இதற்கு பென்சாயில் குளோரைடுடன் பொட்டாசியம் அசிடேட் [2] சேர்த்து வெப்பப்படுத்தப்பட்டது.
மெத்தில் அசிட்டேட்டை கார்பனைல் ஏற்றம் செய்தும் அசிட்டிக் நீரிலி பெறப்பட்டது:[3]
- CH3CO2CH3 + CO → (CH3CO)2O
டென்னிசி ஈஸ்ட்மேன் அசிட்டிக் நீரிலி செயல்முறையில் மெத்தில் அசிட்டேட் மெத்தில் அயோடைடு மற்றும் ஒரு அசிடேட் உப்பாக மாற்றப்படுகிறது. கார்பனைல் ஏற்றத்தின் விளைவாக மெத்தில் அயோடைடு அசிட்டைல் அயோடைடை அளிக்கிறது. இந்த அசிட்டைல் அயோடைடு அசிட்டேட் உப்புகள் அல்லது அசிட்டிக் அமிலத்துடன் வினைபுரிந்து விளைபொருளைத் தருகின்றது.
தண்ணீரில் அசிட்டிக் நீரிலி நிலைப்புத் தன்மையற்றது என்பதால் இம்மாற்ற வினை நீரற்ற சூழ்நிலையில் நடைபெறுகிறது. அதாவது லித்தியம் குளோரைடு முன்னிலையில் ரோடியம் குளோரைடு வினைவேக மாற்றியாக செயல்படுகிறது. மாறாக , மான்சாண்டோ அசிட்டிக் அமில செயல்முறையில், மெத்தில் அயோடைடின் கர்ர்பைனலேற்றம் இதே ரோடியம் குளோரைடு முன்னிலையில் பகுதியாக நீரியக் கரைசலில் நடைபெறுகிறது. கீட்டினை ( எத்தினோன் ) 45 முதல் 55 பாகை வெப்ப நிலையில் (0.05–0.2 bar)அழுத்தத்தில் வினைப்படுத்தியும் மிகக் குறைவான அளவில் அசிட்டிக் நீரிலி தயாரிக்கப்படுகிறது.[4]
- H2C=C=O + CH3COOH → (CH3CO)2O (ΔH = −63 kJ/mol)
சுமார் 700 முதல் 750 பாகை வெப்ப நிலையில் வினைவேக மாற்றியான டிரை எத்தில் பாசுபேட்டு முன்னிலையில் அல்லது சுமார் 600 முதல் 700 பாகை வெப்பநிலையில் வினைவேக மாற்றியான கார்பன்டை சல்பைடு முன்னிலையில் வெப்பச் சிதைவு மூலமாக கீட்டீன்[4]
- CH3COOH
 H2C=C=O + H2O (ΔH = +147 kJ/mol)
H2C=C=O + H2O (ΔH = +147 kJ/mol) - CH3COCH3 → H2C=C=O + CH4 உற்பத்தி செய்யப்படுகிறது.
செல்லுலோசு அசிட்டேட்டின் உற்பத்தி அதிகரித்தபோது அசிட்டிக் நீரிலியின் தேவை அதிகரித்தது. அப்போதுதான் கீட்டீன் வழியாக அசிட்டிக் அமிலத்திலிருந்து அசிட்டிக் நீரிலி தயாரிக்கும் முறை 1922 ஆம் ஆண்டில் [5] வாக்கெர் கெமி என்பவரால் உருவாக்கப்பட்டது,
இதன் குறைந்த விலை காரணமாக அசிட்டிக் நீரிலி ஆராய்ச்சிக் கூடங்களில் தயாரிப்பதற்குப் பதிலாக வாங்கப்பட்டது.
வேதிவினைகள்
[தொகு]அசிட்டிக் நீரிலி அசிட்டைலேற்றத்திற்கான ஒரு பல்துறை கரணியாக திகழ்கிறது., கரிம வேதியியலில் CH3CO+ என்ற அடி மூலக்கூறினை[6] அறிமுகப்படுத்தும் ஆதாரமாக இது பார்க்கப்படுகிறது. ஆல்ககால்கள் மற்றும் அமீன்கள் உடனடியாக அசிட்டைலேற்றம் ஆகின்றன[7] . உதாரணமாக அசிட்டைல் நீரிலி எத்தனால் உடன் வினைபுரிந்து எத்தில் அசிட்டேட்டைக் கொடுக்கிறது.
- (CH3CO)2O + CH3CH2OH → CH3CO2CH2CH3 + CH3COOH
அடிப்படை ஊக்கியாக இது செயல்பட பிரிடின் போன்ற ஒரு காரம் இதனுடன் சேர்க்கப்படுகிறது. சில சிறப்பு பயன்பாடுகளில் லீவிஸ் அமில ஸ்கேண்டியம் உப்புக்கள் பயனுள்ள வினையூக்கிகளாக நிரூபிக்கப்பட்டுள்ளன [8]
அரோமேட்டிக் வளையங்கள் அசிட்டிக் நீரிலியால் அசிட்டைலேற்றம் பெறுகின்றன. பொதுவாக வினையை துரிதமாக்க அமில் வினையூக்கிகள் பயன்படுத்துவது வழக்கம். பென்சீனிலிருந்து அசிட்டோ பினோன். மற்றும் பெர்ரோசீனிலிருந்து அசிட்டைல் பெர்ரோசீன் மாற்ற வினைகள் கீழே தரப்பட்டுள்ளன:[9]
- (C5H5)2Fe + (CH3CO)2O → (C5H5)Fe(C5H4COCH3) + CH3CO2H
முன்பெல்லாம் வினைல் அசிட்டேட் தொழிற்துறை உற்பத்தியில் எத்திலிடின் டைஅசிட்டேட் இடைநிலையாக பங்கேற்றது.. இந்த ஓரிடத்த அசிட்டேட்டானது அசிட்டால்டிகைடு மற்றும் அசிட்டிக் நீரிலி ஆகியவை பெர்ரிக் குளோரைடு வினைவேக மாற்றியின் முன்னிலையில் வினைபுரிவதன் மூலம் பெறப்படுகிறது :[10].
- CH3CHO + (CH3CO)2O → (CH3CO2)2CHCH3
நீராற்பகுப்பு வினை
[தொகு]அசிட்டிக் நீரிலி அதனுடைய எடையில் தோராயமாக சுமார் 2.6 [11] சதவீதம் அளவுக்கு தண்ணீரில் கரைகிறது. அசிட்டிக் நீரிலியின் நீர்க்கரைசல் குறைவான நிலைப்புத்தன்மை கொண்டது. ஏனெனில், மற்ற நீரிலிகளைப் போன்றே இதுவும் நீராற்பகுப்புக்கு உட்பட்டு கார்பாக்சிலிக் அமிலமாகிறது. இந்நிகழ்வில் அசிட்டிக் அமிலம் உண்டாகிறது:[12].
- (CH3CO)2O + H2O → 2 CH3CO2H
பயன்கள்
[தொகு]கரிம வேதியியலில் அசிட்டிக் நீரிலியின் அசிட்டைலேற்றும் பண்பு வணிகரீதியான முக்கியத்துவம் பெற்றுள்ளது. செல்லுலோசை செல்லுலோசு அசிட்டேட்டாக மாற்றுவது இதனுடைய மிகப்பெரிய பயனாகும். செல்லுலோஸ் அசிட்டேட் புகைப்படத் தொழிலில் படசுருள்களில் பூசப்படும் பொருட்களில் அங்கம் வகிக்கிறது. இதுபோலவே ஆஸ்பிரின் எனப்படும் அசிட்டைல் சாலிசிலிக் அமிலம்[13] தயாரிப்பிலும் பங்குபெறுகிறது. சாலிசிலிக் அமிலத்தை [13] அசிட்டைலேற்றம் செய்தால் ஆஸ்பிரின் கிடைக்கிறது. மேலும் இச்சேர்மம் மரப்பலகைகளை பாதுகாக்கும் செயலிலும் பயனாகிறது.
மாச்சத்து தொழிற்சாலைகளில் பொதுவான அசிடைலேற்றியாக உள்ள இது பொருள் மாற்றியமைத்த மாச்சத்துகள் (E1414,E1420,E1422) உற்பத்தியில் பயன்படுத்தப்படுகிறது.
தொகுப்பு முறையில் அபின் தயாரிக்க அசிட்டிக் நீரிலி பயன்படுவதால் அமெரிக்கா மற்றும் பல்வேறு நாடுகளில் தடைசெய்யப்பட்டுள்ளது[14].
முன் பாதுகாப்பு
[தொகு]அசிட்டிக் நீரிலி நமைச்சலை உண்டாக்கக் கூடியதும் பற்றி எரியக்கூடிய திரவமுமாகும். அசிட்டிக் நீரிலியின் தீவிர எரிதலைக் கட்டுப்படுத்த [15] தண்ணீர் அல்லது கார்பன் டை ஆக்சைடு முன்மொழியழப் படுகிறது. அசிட்டிக் நீரிலியின் ஆவி உடலுக்கு ஊறு விளைவிக்கக் கூடியதாகும்[16] .
இதனுடன் ஐதரசன் பெராக்சைடு கலக்கும்போது அதிக அளவிலான அசிட்டிக் நீரிலி வினைவிளை பொருட்களில் ஒன்றான கரிம பெராக்சைடு, பெர்அசிட்டிக் அமிலத்துடன் வினைபுரிந்து வெடிக்கும் தன்மை கொண்ட டைஅசிட்டைல் பெராக்சைடு[17] தோன்றுகிறது.
மேற்கோள்கள்
[தொகு]- ↑ Wu, Guang; Van Alsenoy, C.; Geise, H. J.; Sluyts, E.; Van Der Veken, B. J.; Shishkov, I. F.; Khristenko (2000), "Acetic Anhydride in the Gas Phase, Studied by Electron Diffraction and Infrared Spectroscopy, Supplemented with ab Initio Calculations of Geometries and Force Fields", The Journal of Physical Chemistry A, 104 (7): 1576, எண்ணிம ஆவணச் சுட்டி:10.1021/jp993131z.
- ↑ Charles Gerhardt (1852) “Recherches sur les acides organiques anhydres” (Investigations into the anhydrides of organic acids), Comptes rendus … , 34 : 755-758.
- ↑ Zoeller, J. R.; Agreda, V. H.; Cook, S. L.; Lafferty, N. L.; Polichnowski, S. W.; Pond, D. M. (1992), "Eastman Chemical Company Acetic Anhydride Process", Catal. Today, 13 (1): 73–91, எண்ணிம ஆவணச் சுட்டி:10.1016/0920-5861(92)80188-S
- ↑ 4.0 4.1 Arpe, Hans-Jürgen (2007-01-11), Industrielle organische Chemie: Bedeutende vor- und Zwischenprodukte (6th ed.), Weinheim: Wiley-VCH, pp. 200–1, பன்னாட்டுத் தரப்புத்தக எண் 3-527-31540-3[தொடர்பிழந்த இணைப்பு].
- ↑ Milestones in the history of WACKER, Wacker Chemie AG, பார்க்கப்பட்ட நாள் 2009-08-27.
- ↑ "Acid Anhydrides", Understanding Chemistry, பார்க்கப்பட்ட நாள் 2006-03-25.
- ↑ Shakhashiri, Bassam Z., "Acetic Acid & Acetic Anhydride", Science is Fun…, Department of Chemistry, University of Wisconsin, archived from the original on 2006-03-03, பார்க்கப்பட்ட நாள் 2006-03-25.
- ↑ Macor, John; Sampognaro, Anthony J.; Verhoest, Patrick R.; Mack, Robert A. (2000). "(R)-(+)-2-Hydroxy-1,2,2-Triphenylethyl Acetate". Organic Syntheses 77: 45. http://www.orgsyn.org/demo.aspx?prep=V77P0045.; Collective Volume, vol. 10, p. 464
- ↑ Taber, Douglass F., Column chromatography: Preparation of Acetyl Ferrocene, Department of Chemistry and Biochemistry, University of Delaware, archived from the original on 2009-05-02, பார்க்கப்பட்ட நாள் 2009-08-27.
- ↑ G. Roscher "Vinyl Esters" in Ullmann's Encyclopedia of Chemical Technology, 2007 John Wiley & Sons: New York. எஆசு:10.1002/14356007.a27_419
- ↑ Acetic Anhydride: Frequently Asked Questions (PDF), British Petroleum, archived from the original (PDF) on 2007-10-11, பார்க்கப்பட்ட நாள் 2006-05-03.
- ↑ Acetic Anhydride: Material Safety Data Sheet (PDF) (PDF), Celanese, archived from the original (PDF) on 2007-09-27, பார்க்கப்பட்ட நாள் 2006-05-03.
- ↑ 13.0 13.1 வார்ப்புரு:SIDS-ref.
- ↑ UN Intercepts Taliban's Heroin Chemical in Rare Afghan Victory, Bloomberg, பார்க்கப்பட்ட நாள் 2008-10-07.
- ↑ "Data Sheets". International Occupational Safety and Health Information Centre. பார்க்கப்பட்ட நாள் 2006-04-13.
- ↑ "NIOSH". Pocket Guide to Chemical Hazards. Archived from the original on 2006-04-22. பார்க்கப்பட்ட நாள் 2006-04-13.
- ↑ "Chemical Safety: Synthesis Procedure". Chemical & Engineering News 89 (2): 2. 2011-01-10. http://cen.acs.org/articles/89/i2/Chemical-Safety-Synthesis-Procedure.html.
வெளிப்புற இணைப்புகள்
[தொகு]| அசிட்டேட்டுகள் | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| AcOH | He | ||||||||||||||||||
| LiOAc | Be(OAc)2 BeAcOH |
B(OAc)3 | AcOAc ROAc |
NH4OAc | AcOOH | FAc | Ne | ||||||||||||
| NaOAc | Mg(OAc)2 | Al(OAc)3 ALSOL Al(OAc)2OH Al2SO4(OAc)4 |
Si | P | S | ClAc | Ar | ||||||||||||
| KOAc | Ca(OAc)2 | Sc(OAc)3 | Ti(OAc)4 | VO(OAc)3 | Cr(OAc)2 Cr(OAc)3 |
Mn(OAc)2 Mn(OAc)3 |
Fe(OAc)2 Fe(OAc)3 |
Co(OAc)2, Co(OAc)3 |
Ni(OAc)2 | Cu(OAc)2 | Zn(OAc)2 | Ga(OAc)3 | Ge | As(OAc)3 | Se | BrAc | Kr | ||
| RbOAc | Sr(OAc)2 | Y(OAc)3 | Zr(OAc)4 | Nb | Mo(OAc)2 | Tc | Ru(OAc)2 Ru(OAc)3 Ru(OAc)4 |
Rh2(OAc)4 | Pd(OAc)2 | AgOAc | Cd(OAc)2 | In | Sn(OAc)2 Sn(OAc)4 |
Sb(OAc)3 | Te | IAc | Xe | ||
| CsOAc | Ba(OAc)2 | Hf | Ta | W | Re | Os | Ir | Pt(OAc)2 | Au | Hg2(OAc)2, Hg(OAc)2 |
TlOAc Tl(OAc)3 |
Pb(OAc)2 Pb(OAc)4 |
Bi(OAc)3 | Po | At | Rn | |||
| Fr | Ra | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | |||
| ↓ | |||||||||||||||||||
| La(OAc)3 | Ce(OAc)x | Pr | Nd | Pm | Sm(OAc)3 | Eu(OAc)3 | Gd(OAc)3 | Tb | Dy(OAc)3 | Ho(OAc)3 | Er | Tm | Yb(OAc)3 | Lu(OAc)3 | |||||
| Ac | Th | Pa | UO2(OAc)2 | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | |||||
