ஆர்சனிக் மூவாக்சைடு

| |
 | |
| பெயர்கள் | |
|---|---|
| முறையான ஐயூபிஏசி பெயர்
டையார்சனிக் டிரையாக்சைடு | |
| வேறு பெயர்கள் | |
| இனங்காட்டிகள் | |
| 1327-53-3 | |
| ATC code | L01XX27 |
| ChEMBL | ChEMBL1200978 |
| ChemSpider | 452539 |
| DrugBank | DB01169 |
| EC number | 215-481-4 |
| யேமல் -3D படிமங்கள் | Image |
| KEGG | C13619 |
| பப்கெம் | 261004 |
| வே.ந.வி.ப எண் | CG3325000 |
| |
| UNII | S7V92P67HO |
| பண்புகள் | |
| As 2O 3 | |
| வாய்ப்பாட்டு எடை | 197.841 கி/மோல் |
| தோற்றம் | வெண் திண்மம் |
| அடர்த்தி | 3.74 கி/செ.மீ3 |
| உருகுநிலை | 312.2 °C (594.0 °F; 585.3 K) |
| கொதிநிலை | 465 °C (869 °F; 738 K) |
| 20 g/L (25 °C) see text | |
| கரைதிறன் | நீர்த்த அமிலங்கள் மற்றும் காரங்களில் கரைகிறது. நடைமுறையில் கரிமக் கரைப்பான்களில் கரைவதில்லை.[2] |
| காடித்தன்மை எண் (pKa) | 9.2 |
| கட்டமைப்பு | |
| படிக அமைப்பு | கனசதுரம் (α)<180 °C ஒற்றைச் சரிவு (β) >180 °C |
| மூலக்கூறு வடிவம் | |
| இருமுனைத் திருப்புமை (Dipole moment) | Zero |
| வெப்பவேதியியல் | |
| Std enthalpy of formation ΔfH |
−657.4 கி.யூ/மோல் |
| நியம மோலார் எந்திரோப்பி S |
? J.K−1.mol−1 |
| தீங்குகள் | |
| பொருள் பாதுகாப்பு குறிப்பு தாள் | |
| R-சொற்றொடர்கள் | R45, R28, R34, R50/53 |
| S-சொற்றொடர்கள் | S53, S45, S60, S61 |
| Lethal dose or concentration (LD, LC): | |
LD50 (Median dose)
|
14.6 mg/kg (rat, oral) |
| அமெரிக்க சுகாதார ஏற்பு வரம்புகள்: | |
அனுமதிக்கத்தக்க வரம்பு
|
[1910.1018] TWA 0.010 mg/m3[3] |
பரிந்துரைக்கப்பட்ட வரம்பு
|
Ca C 0.002 mg/m3 [15-minute][3] |
உடனடி அபாயம்
|
Ca [5 mg/m3 (as As)][3] |
| தொடர்புடைய சேர்மங்கள் | |
| ஏனைய எதிர் மின்னயனிகள் | ஆர்சனிக் முச்சல்பைடு |
| ஏனைய நேர் மின்அயனிகள் | பாசுபரசு மூவாக்சைடு ஆண்டிமணி மூவாக்சைடு |
மாறுதலாக ஏதும் சொல்லவில்லை என்றால் கொடுக்கப்பட்ட தரவுகள் யாவும் பொருள்கள் அவைகளின் இயல்பான வெப்ப அழுத்த நிலையில் (25°C, 100kPa) இருக்கும். | |
ஆர்சனிக் மூவாக்சைடு (Arsenic trioxide) என்பது As2O3. என்ற மூலக்கூற்று வாய்பாடு கொண்ட ஒரு கனிம வேதியியல் சேர்மமாகும். ஆர்சனிக்கின் ஆக்சைடு சேர்மமான, வணிக முக்கியத்துவம் வாய்ந்த இச்சேர்மமானது பிற ஆர்சனிக் சேர்மங்கள் தயாரிப்பதற்குத் தேவையான முன்னோடிச் சேர்மமாக விளங்குகிறது. ஆண்டுக்கு 50000 டன்கள் வரை இச்சேர்மம் உற்பத்தி செய்யப்படுகிறது[4]. உயர் நச்சுத்தன்மை காரணமாக இச்சேர்மத்தின் பல்வேறு பயன்பாடுகள் விவாதத்திற்குள்ளாகின்றன.
தயாரிப்பு மற்றும் தோற்றம்
[தொகு]
வழக்கமாக ஆர்சனிக் சேர்மங்களைத் தயாரிப்பது போன்றே ஆர்சனிக் மூவாக்சைடும் தயாரிக்கப்படுகிறது. ஆர்சனிக் அல்லது ஆர்சனிக் இடம்பெற்றுள்ள கனிமங்களை காற்றில் ஆக்சிசனேற்றம் (எரிதல்) செய்து ஆர்சனிக் மூவாக்சைடு தயாரிக்கப்படுகிறது. விளக்கத்திற்காக இங்கு ஆர்பிமெண்ட் என்ற ஆர்சனிக்கின் சல்பைடு தாது எடுத்துக் கொள்ளப்பட்டுள்ளது.
- 2 As
2S
3 + 9 O
2 → 2 As
2O
3 + 6 SO
2
பிரித்தெடுத்தலுக்கு மற்ற தாதுப் பொருட்களைப் பயன்படுத்தும் போது ஆவியாகும் உடன் விளை பொருளாகவே பல ஆர்சனிக் ஆக்சைடுகள் கிடைக்கின்றன. உதாரணமாக ஆர்சனோபைரைட், தங்கம் மற்றும் செப்பு கலந்திருக்கின்ற ஒரு கனிமமான இதைச் சூடாக்கும் போது ஆர்சனிக் மூவாக்சைடு காற்றில் வெளியேறுகிறது. இத்தகைய கனிமங்களில் இருந்து தனிமங்களை பிரித்தெடுக்கும் செயல்முறையின் போது பலமுறை நச்சு விபத்துகள் நிகழ்கின்றன. சீனாவில் மட்டுமே ஆர்சனிக் தாது வெட்டி எடுக்கப்படுகிறது[5] Only in China are arsenic ores intentionally mined.[4] ஆர்சனிக் முக்குளோரைடை நீராற்பகுப்பு செய்து ஆய்வகத்தில் ஆர்சனிக் மூவாக்சைடு தயாரிக்கப்படுகிறது.
- 2 AsCl3 + 3 H2O → As2O3 + 6 HCl
பண்புகள் மற்றும் வினைகள்
[தொகு]ஆர்சனிக் மூவாக்சைடானது ஒர் ஈரியல்பு ஆக்சைடாகும். இதனுடைய நீர்க் கரைசல்கள் வலிமை குன்றிய அமிலங்களாக உள்ளன. காரத்தன்மையுள்ள கரைசல்களில் இது எளிமையாகக் கரைந்து ஆர்சனைட்டுகளைக் கொடுக்கிறது. அமிலங்களில் இச்சேர்மம் குறைவான கரைதிறன் கொண்டிருந்தாலும் [[ஐதரோகுளோரிக் காடி| ஐதரோகுளோரிக் அமிலத்தில் கரையக்கூடியதாக உள்ளது.[6]
நீரற்ற HF மற்றும் HCl உடன் ஆர்சனிக் மூவாக்சைடு வினைபுரிந்து AsF3 மற்றும் முக்குளோரைடுகளைக் கொடுக்கிறது,:[7]
- As2O3 + 6 HX → 2 AsX3 + 3 H2O (X = F, Cl)
ஓசோன் போன்ற வலிமையான ஆக்சிசனேற்றிகளுடன் வினைபுரிந்து ஐதரசன் பெராக்சைடைத் தருகிறது. மற்றும் நைட்ரிக் அமிலத்துடன் ஆர்சனிக் ஐந்தாக்சைடு அல்லது அதற்கு இணையான ஓர் அமிலத்தைத் தருகிறது.:[7]
- 2 HNO3 + As2O3 + 2 H2O → 2 H3AsO4 + N2O3
ஆக்சிசனேற்ற எதிர்ப்பு என்ற அடிப்படையில், ஆர்சனிக் மூவாக்சைடு பாசுபரசு மூவாக்சைடில் இருந்து வேறுபடுகிறது. பாசுபரசு மூவாக்சைடு எரிதலால் உடனடியாக பாசுபரசு ஐந்தாக்சைடாக மாறுகிறது. ஓடுக்க வினையில் வினை நிபந்தனைகளின் தன்மைக்கேற்ப தனிமநிலை ஆர்சனிக் அல்லது ஆர்சீன் (AsH3) உண்டாகிறது. இவ்வினை மாற்சு சோதனையில் பயன்படுகிறது.:[7]
- As2O3 + 6 Zn + 12 HNO3 → 2 AsH3 + 6 Zn(NO3)2 + 3 H2O
அமைப்பு
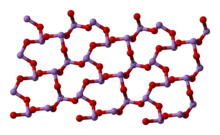
[தொகு]800 0 செல்சியசு வெப்பநிலைக்குக் கீழ் திரவநிலை மற்றும் வாயுநிலைகளில் ஆர்சனிக் மூவாக்சைடு As4O6 என்ற வாய்ப்பாடு மற்றும் P4O6 உடன் சமகட்டமைப்பைக் கொண்டுள்ளது. 800 0 செல்சியசு வெப்பநிலைக்கு மேல் As4O6 சேர்மமானது குறிப்பிடத்தக்க வகையில் As2O3, மூலக்கூற்று வடிவத்துடன் பிரிகையடைகிறது.இதுவும் N2O3. உடன் சமகட்டமைப்பைக் கொண்டுள்ளது. திண்மநிலையில் மூன்று வகையான பல்லுருத் தோற்றங்கள் அறியப்படுகின்றன. உயர் வெப்பநிலையில் 110 0 செல்சியசு வெப்பநிலைக்கு மேல் மூலக்கூற்று As4O6 கொண்ட கனசதுர As4O6 வடிவமைப்பும் இதனுடன் தொடர்புடைய இரண்டு பலபடி வடிவங்களிலும் காணப்படுகிறது[8]. பலபடிகள் இரண்டும் ஆக்சிசன் அணுக்களுடன் பகிர்ந்து கொண்டுள்ள பட்டைக் கூம்பு AsO3 அலகுகளுடன் ஒற்றைச் சரிவு அமைப்பில் படிகமாகின்றன.[9]
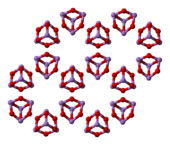
|

|
|
(கனசதுரம்) |
(ஒற்றைச்சரிவு) |
(ஒற்றைச்சரிவு) |
பயன்கள்
[தொகு]வனவியல் பொருட்கள் தயாரிப்பு, கண்ணாடி தயாரிப்பு, மின்னணுவியல்[4] பொருட்கள் தயாரிப்பு ஆகியவற்றில் முன்னோடியாக விளங்குவது உட்பட பெரிய அளவிலான பயன்பாடுகளை ஆர்சனிக் மூவாக்சைடு கொண்டிருக்கிறது. மேலும் இது ஆர்சனிக்கின் முக்கியமான சேர்மமாகவும் இருப்பதால் இது தனிமநிலை ஆர்சனிக், ஆர்சனிக் உலோக கலவைகள், மற்றும் ஆர்சனைடு குறைக்கடத்திகள் தயாரிப்புக்கும் முன்னோடியாக விளங்குகிறது. கரிம ஆர்சனிக் சேர்மங்களான உணவு கூட்டுப் பொருட்கள் ( ராக்சார்சோன்) மற்றும் மருந்துப் பொருள்கள் ( நியோசல்வர்சன்) முதலியன ஆர்சனிக் மூவாக்சைடில் இருந்து தருவிக்கப்படுகின்றன. இவை தவிர ஆர்சனிக்கை அடிப்படையாகக் கொண்ட சோடியம் ஆர்சனைட்டு மற்றும் சோடியம் காகோடிலைட்டு ஆகியனவும் இதிலிருந்து தருவிக்கப்படுகின்றன.
மரத்தைப் பாதுகாக்கும் ஆர்சனிக் ஆக்சைடு உட்பட பல்வேறு பயன்பாடுகள் ஆர்சனிக்கின் நச்சுத்தன்மையை பயன்படுத்திக் கொள்கின்றன. ஆர்சனிக் மூவாக்சைடில் இருந்து தருவிக்கப்படும் செப்பு ஆர்சனேட்டு, ஐக்கிய அமெரிக்கா மற்றும் மலேசியாவில் மரப்பாதுகாப்புப் பொருளாகப் பயன்படுத்தப்படுகிறது. ஆனால் உலகின் பலநாடுகள் இவ்வுபயோகத்தைத் தடை செய்துள்ளன. இன்றுவரையிலும் இப்பயன்பாடு குறித்த விவாதம் தொடர்ந்து கொண்டிருக்கிறது. செப்பு(II)அசிட்டேட்டு உடன் ஆர்சனிக் மூவாக்சைடு சேர்த்து பாரிசு பச்சை என்ற நிறமி தயாரிக்கப்பட்டு வந்ததும் தற்பொழுது நிறுத்தப்பட்டு விட்டது.
மருத்துவப் பயன்கள்
[தொகு]ஆர்சனிக்கின் நச்சுத்தன்மை நன்கு அறியப்பட்டிருந்தாலும் சீனர்களின் பாரம்பரிய மருத்துவத்தில் ஆர்சனிக் மூவாக்சைடு பயன்படுத்தப்பட்டு வருகிறது[10] . புற்றுநோய் சிகிச்சையில் இன்று வரையிலும், மற்றும் ஒமியோபதி மருத்துவத்தில் ஆர்சனிகம் ஆல்பம் என்ற பெயரிலும் சீனர்கள் இதைப்பயன்படுத்துகிறார்கள். பவுலர் கரைசல் போன்ற மதிப்பு மிகுந்த காப்புரிமை மருந்துகள் ஆர்சனிக் ஆக்சைடுகளில் இருந்து தருவிக்கப்பட்டவையாகும்[11].
இரத்த வெள்ளையணுவில்[12][13] தோன்றும் ஒருவகைப் புற்று நோய்க்கு சீனாவில் பாரம்பரியமாக உபயோகப்படுத்தி வரும் ஆர்சனிக் மூவாக்சைடை 1970 -களில் சாங் டிங் டாங் மற்றும் நண்பர்கள் ஆராய்ந்தனர். இதன் தொடர்ச்சியாக சீனா மற்றும் மேற்கு நாடுகளில் இர்ரைசினாக்சு என்ற மருந்து கண்டுபிடிக்கப்பட்டது. அமெரிக்காவும் இம்மருந்தை அங்கீகரித்து விற்பனை செய்தது. ஆங்காங் பல்கலைக்கழகம் வாய்வழியாக உட்கொள்ளும் ஒரு ஆர்சனிக் மருந்தையும் தயாரித்துள்ளது குறிப்பிடத்தக்கதாகும்[14].
நச்சு விளைவுகள்
[தொகு]ஆர்சனிக் மூவாக்சைடு உடனடியாக செரிமான அமைப்பால் உறிஞ்சப்படுகிறது: உள்ளிழுக்கும் போதும் அல்லது தோல் மீது தொடர்பு கொள்ளும் பொழுதும் கூட இதன் நச்சு விளைவுகள் நன்றாக அறியப்படுகின்றன. சிறுநீரில் சிறிதளவு வெளியேற்றப்பட்டாலும் 40 சதவீத அளவிற்கு எலும்புகள், தசைகள், தோல், முடி, மற்றும் நகங்களுடன் சேர்ந்து பின்னர் வாரம் அல்லது மாதத்திற்குப் பின்னர் வெளியேற்றப்படுகிறது.
இதனுடைய நச்சுப் பண்புகள் பலவற்றையும் தொகுத்தால் மிகவிரிவான ஒரு கட்டுரையாகப் பெருகலாம்[15][16][17].
சுற்றுச்சூழல் பிரச்சினைகள்
[தொகு]உருக்கிப் பிரித்தல் மற்றும் இதனுடன் தொடர்புடைய கனிமச் செயல்முறைகளில் ஆர்சனிக் மூவாக்சைடு தயாரிக்கப்படுகிறது.இச்செயல்முறை சூழலில் அடிக்கடி கடுமையான பாதிப்பை ஏற்படுத்தியுள்ளன. உதாரணமாக, கனடா நாட்டிலுள்ள இராட்சத சுரங்கத்தில் இருக்கும் ஆர்சனோபைரைட்டு தங்கத்தின் தாதுவை நச்சாக்கியது.
மேற்கோள்கள்
[தொகு]- ↑ Shakhashiri, B. Z. "Chemical of the Week: Arsenic". University of Wisconsin-Madison Chemistry Dept. Archived from the original on 2008-08-02. பார்க்கப்பட்ட நாள் 2015-10-02.
{{cite web}}: Unknown parameter|=ignored (help) - ↑ Patnaik, P. (2002). Handbook of Inorganic Chemicals. McGraw-Hill. பன்னாட்டுத் தரப்புத்தக எண் 0-07-049439-8.
- ↑ 3.0 3.1 3.2 "NIOSH Pocket Guide to Chemical Hazards #0038". National Institute for Occupational Safety and Health (NIOSH).
- ↑ 4.0 4.1 4.2 Grund, S. C.; Hanusch, K.; Wolf, H. U. (2005), "Arsenic and Arsenic Compounds", Ullmann's Encyclopedia of Industrial Chemistry, Weinheim: Wiley-VCH, எண்ணிம ஆவணச் சுட்டி:10.1002/14356007.a03_113.pub2
{{citation}}: CS1 maint: multiple names: authors list (link) - ↑ "Giant Mine – Northwest Territories Region – Indian and Northern Affairs Canada". Archived from the original on 2006-06-27. பார்க்கப்பட்ட நாள் 2007-08-28.
{{cite web}}: Unknown parameter|=ignored (help) - ↑ Greenwood, N. N.; & Earnshaw, A. (1997). Chemistry of the Elements (2nd Edn.), Oxford:Butterworth-Heinemann. பன்னாட்டுத் தரப்புத்தக எண் 0-7506-3365-4.
- ↑ 7.0 7.1 7.2 Handbook of Preparative Inorganic Chemistry, 2nd Ed. Edited by G. Brauer, Academic Press, 1963, NY.
- ↑ Wells A.F. Structural Inorganic Chemistry. 5th. London, England: Oxford University Press, 1984. Print. பன்னாட்டுத் தரப்புத்தக எண் 0-19-855370-6
- ↑ Holleman, A. F.; Wiberg, E. (2001). Inorganic Chemistry. San Diego: Academic Press. பன்னாட்டுத் தரப்புத்தக எண் 0-12-352651-5.
{{cite book}}: CS1 maint: multiple names: authors list (link) - ↑ Rao Y, Li R, Zhang D (June 2013). "A drug from poison: how the therapeutic effect of arsenic trioxide on acute promyelocytic leukemia was discovered". Sci China Life Sci 56 (6): 495–502. doi:10.1007/s11427-013-4487-z. பப்மெட்:23645104.
- ↑ Bian, Zhaoxiang; Chen, Shilin; Cheng, Chungwah; Wang, Jun; Xiao, Haitao; Qin, Hongyan (2012). "Developing new drugs from annals of Chinese medicine". Acta Pharmaceutica Sinica B 2: 1. doi:10.1016/j.apsb.2011.12.007.
- ↑ Soignet, S. L.; Frankel, S. R.; Douer, D.; Tallman, M. S.; Kantarjian, H.; Calleja, E.; Stone, R. M.; Kalaycio, M.; Scheinberg, D. A. (2001). "United States Multicenter Study of Arsenic Trioxide in Relapsed Acute Promyelocytic Leukemia" (pdf). Journal of Clinical Oncology 19 (18): 3852–3860. பப்மெட்:11559723. http://jco.ascopubs.org/content/19/18/3852.full.pdf.
- ↑ Antman, K. H. (2001). "Introduction: The history of arsenic trioxide in cancer therapy" (pdf). Oncologist 6 (Supplement 2): 1–2. doi:10.1634/theoncologist.6-suppl_2-1. பப்மெட்:11331433. http://theoncologist.alphamedpress.org/content/6/suppl_2/1.full.pdf.
- ↑ Au, W.-Y.; Kumana, C. R.; Kou, M.; Mak, R.; Chan, G. C.; Lam, C.-W.; Kwong, Y.-L. (2003). "Oral arsenic trioxide in the treatment of relapsed acute promyelocytic leukemia" (pdf). Blood 102 (1): 407–408. doi:10.1182/blood-2003-01-0298. பப்மெட்:12814916. http://bloodjournal.hematologylibrary.org/content/102/1/407.full.pdf.
- ↑ "Stanton v Benzler 9716830". U.S. 9th Circuit Court of Appeals. 1998-06-17. பார்க்கப்பட்ட நாள் 2008-06-09.
(...) convicted by a jury of first degree murder for poisoning her ex-husband. Her ex-husband's body was found with traces of arsenic trioxide in it.
- ↑ Emsley, J. (2006). "Arsenic". The Elements of Murder: A History of Poison. ஒக்ஸ்போர்ட் பல்கலைக்கழகப் பதிப்பகம். pp. 93–197. பன்னாட்டுத் தரப்புத்தக எண் 978-0-19-280600-0.
- ↑ Flaubert, G. (1856). Madame Bovary.
வெளி இணைப்புகள்
[தொகு]- Case Studies in Environmental Medicine: Arsenic Toxicity
- "Arsenic and Arsenic Compounds". Summaries & Evaluations. International Agency for Research on Cancer (IARC). February 1998.
- International Chemical Safety Card 0378
- NIOSH Pocket Guide to Chemical Hazards
- NTP Report on Carcinogens – Inorganic Arsenic Compounds
- Use of Arsenic Trioxide in Multiple Myeloma Treatment பரணிடப்பட்டது 2007-06-08 at the வந்தவழி இயந்திரம்
- The use of Arsenic trioxide in medicine.
- வார்ப்புரு:Inrs
- Institute of Chemistry Austria, specialised on arsenic and various arsenic compounds பரணிடப்பட்டது 2008-12-07 at the வந்தவழி இயந்திரம்
