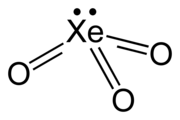
செனான் மூவாக்சைடு
| |

| |
| பெயர்கள் | |
|---|---|
| ஐயூபிஏசி பெயர்s
செனான் டிரையாக்சைடு
செனான்(VI) ஆக்சைடு | |
| வேறு பெயர்கள்
செனிக் நீரிலி
| |
| இனங்காட்டிகள் | |
| 13776-58-4 | |
| ChemSpider | 21106493 |
InChI
| |
| யேமல் -3D படிமங்கள் | Image |
SMILES
| |
| பண்புகள் | |
| XeO3 | |
| வாய்ப்பாட்டு எடை | 179.288 கி/மோல் |
| தோற்றம் | நிறமற்ற படிகத் திண்மம் |
| அடர்த்தி | 4.55 கி/செ.மீ3, திண்மம் |
| உருகுநிலை | 25 °C (77 °F; 298 K) தீவிரச் சிதைவடைதல் |
| கரையும் (வினையுடன்) | |
| கட்டமைப்பு | |
| மூலக்கூறு வடிவம் | |
| வெப்பவேதியியல் | |
| Std enthalpy of formation ΔfH |
402 கி.யூ·மோல்−1[1] |
| தீங்குகள் | |
| ஈயூ வகைப்பாடு | பட்டியலிடப்படவில்லை |
மாறுதலாக ஏதும் சொல்லவில்லை என்றால் கொடுக்கப்பட்ட தரவுகள் யாவும் பொருள்கள் அவைகளின் இயல்பான வெப்ப அழுத்த நிலையில் (25°C, 100kPa) இருக்கும். | |
| | |
| Infobox references | |
செனான் மூவாக்சைடு (Xenon trioxide) என்பது XeO3 என்ற மூலக்கூற்று வாய்ப்பாடு கொண்ட தும், +6 ஆக்சிசனேற்ற நிலையில் செனான் நிலைப்புத்தன்மையற்று காணப்படுவதுமான ஒரு சேர்மமாகும். மிகவலிமையான ஒர் ஆக்சிசனேற்றியாக இது செயல்பட்டு தண்ணீரில் இருந்து ஆக்சிசனை முதலிலும் பின்னர் செனானையும் மெல்ல வெளியேற்றுகிறது. சூரிய ஒளி படநேர்ந்தால் செனான் மூவாக்சைடு முடுக்கம் பெறுகிறது. கரிமச்சேர்மங்களுடன் தொடர்பு கொள்ள நேர்ந்தால் அபாயகரமாக வெடிக்கும் தன்மை கொண்டுள்ளது. அவ்வாறு வெடிக்கும்போது செனான் மற்றும் ஆக்சிசன் வாயுக்களை வெளியேற்றுகிறது.
செனான் மூவாக்சைடு வேதியியல்[தொகு]
செனான் மூவாக்சைடு ஒரு வலிமையான ஆக்சிசனேற்றி என்பதால் ஆக்சிசனேற்றம் அடையும் தன்மை கொண்ட அனைத்துப் பொருள்களையும் ஆக்சிசனேற்றம் அடையச் செய்கிறது. இருந்தாலும் இது மிகமெதுவாக வினைபுரிகிறது என்பதால் குறைவான பயன்பாடுகளையே கொண்டுள்ளது.[2]
ஆனால் ,25 °செல்சியசு வெப்பநிலைக்கு மேல் செனான் மூவாக்சைடு அதிதீவிரமாக வெடிக்கும் நிலையையும் கொண்டிருக்கிறது.
- 2 XeO3 → 2 Xe + 3 O2
செனான் மூவாக்சைடு தண்ணீரில் கரைந்து அமிலத்தன்மையுள்ள செனிக் அமிலமாக உருவாகிறது.
- XeO3 (aq) + H2O → H2XeO4
 H+ + HXeO4−
H+ + HXeO4−
அறை வெப்பநிலையில் இக்கரைசல் வெடிக்கும் தன்மையை இழந்து நிலைப்புத்தன்மையுடன் காணப்படுகிறது. கார்பாக்சிலிக் அமிலங்களை ஆக்சிசனேற்றம் செய்து கார்பன் டை ஆக்சைடு மற்றும் நீராக மாற்றுகிறது. .[3]
மாறாக , இது காரக் கரைசல்களில் கரைந்து செனேட்டுகளை உருவாக்குகிறது.செனேட்டுக் கரைசல்களில் HXeO4− எதிர்மின் அயனிகள் ஆதிக்கம் செலுத்தும் இனமாக உள்ளன.[4] நிலைப்புத்தன்மையற்று காணப்படும் இவை விகிதச்சமமாதலின்றி பிரிகையடைந்து +8 ஆக்சிசனேற்ற நிலையில் உள்ள பெர்செனேட்டுகளாகவும் செனான் மற்றும் ஆக்சிசன் வாயுக்களாக மாற்றமடைகின்றன.[5] செனான் மூவாக்சைடுடன் நீர்த்த ஐதராக்சைடு கரைசல்களைச் சேர்த்து வினைப்படுத்துவதால் XeO64−அயனிகளைக் கொண்டிருக்கும் திண்மநிலை பெர்செனேட்டுகள் தனித்துப் பிரிகின்றன. செனான் மூவாக்சைடு, கனிம புளோரைடுளான KF, RbF, அல்லது CsF போன்றவற்றுடன் வினைபுரிந்து நிலைப்புத்தன்மை மிக்க MXeO3F வகை திண்மங்களை உருவாக்குகிறது.[6]
இயற்பியல் பண்புகள்[தொகு]
செனான் அறுபுளோரைடு அல்லது செனான் நான்குபுளோரைடு சேர்மங்களை நீராற்பகுப்பு செய்யும் போது உண்டாகும் கரைசலை ஆவியாக்கி செனான் மூவாக்சைடு படிகங்கள் பெறப்படுகின்றன[7] . உலர் காற்றில் பலநாட்களுக்கு நிலைப்புத்தன்மையுடன் காணப்படும் இப்படிகங்கள் ஈரக்காற்றில் உள்ள நீரை உறிஞ்சி அடர் கரைசல்களை உருவாக்குகின்றன. a = 6.163, b = 8.115, c = 5.234 Å மற்றும் ஒர் அலகுக் கூட்டிற்கு 4 மூலக்கூறுகள் என்ற வகையிலான செஞ்சாய்சதுரப் படிக அமைப்பில் இது காணப்படுகிறது. இதனுடைய அடர்த்தி 4.55 கி/செ.மீ3 ஆகும்.[8]
 |
 |
 |
XeO3 படிக அமைப்பின் ஒரு பகுதி |
பாதுகாப்பு[தொகு]
செனான் மூவாக்சைடை எச்சரிக்கையுடன் கையாள வேண்டும். அறை வெப்பநிலையில் இதனுடைய மாதிரிகள் தன்னிச்சையாகவே வெடிக்கும் இயல்புடன் காணப்படுகின்றன. உலர் படிகங்கள் செல்லுலோசு போன்ற கரிமச் சேர்மங்களுடன் வெடித்தலுடன் வினைபுரிகின்றன.[8][9]
மேற்கோள்கள்[தொகு]
- ↑ Zumdahl, Steven S. (2009). Chemical Principles 6th Ed.. Houghton Mifflin Company. பக். A23. பன்னாட்டுத் தரப்புத்தக எண்:0-618-94690-X. https://archive.org/details/chemicalprincipl0000zumd_u9g0.
- ↑ Greenwood, N.; Earnshaw, A. (1997). Chemistry of the Elements. Oxford: Butterworth-Heinemann.
- ↑ Jaselskis B.; Krueger R. H. (July 1966). "Titrimetric determination of some organic acids by xenon trioxide oxidation". Talanta 13 (7): 945–949. doi:10.1016/0039-9140(66)80192-3. பப்மெட்:18959958.
- ↑ Peterson, J. L.; Claassen, H. H.; Appelman, E. H. (March 1970). "Vibrational spectra and structures of xenate(VI) and perxenate(VIII) ions in aqueous solution". Inorganic Chemistry 9 (3): 619–621. doi:10.1021/ic50085a037.
- ↑ W. Henderson (2000). Main group chemistry. Great Britain: Royal Society of Chemistry. பக். 152–153. பன்னாட்டுத் தரப்புத்தக எண்:0-85404-617-8.
- ↑ Egon Wiberg; Nils Wiberg; Arnold Frederick Holleman (2001). Inorganic chemistry. Academic Press. பக். 399. பன்னாட்டுத் தரப்புத்தக எண்:0-12-352651-5.
- ↑ John H. Holloway; Eric G. Hope (1998). A. G. Sykes. ed. Recent Advances in Noble-gas Chemistry. Advances in Inorganic Chemistry, Volume 46. Academic Press. பக். 65. பன்னாட்டுத் தரப்புத்தக எண்:0-12-023646-X.
- ↑ 8.0 8.1 Templeton, D. H.; Zalkin, A.; Forrester, J. D.; Williamson, S. M. (1963). "Crystal and Molecular Structure of Xenon Trioxide". Journal of the American Chemical Society 85 (6): 817. doi:10.1021/ja00889a037.
- ↑ Bartlett, N.; Rao, P. R. (1963). "Xenon Hydroxide: an Experimental Hazard". Science 139 (3554): 506. doi:10.1126/science.139.3554.506. பப்மெட்:17843880. Bibcode: 1963Sci...139..506B.
