மாலிப்டினம்
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| பொது | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| பெயர், குறி எழுத்து, தனிம எண் |
மாலிப்டினம், Mo, 42 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| வேதியியல் பொருள் வரிசை |
பிறழ்வரிசை மாழைகள் | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| நெடுங்குழு, கிடை வரிசை, வலயம் |
6, 5, d | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| தோற்றம் | மழமழ சாம்பல் 
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| அணு நிறை (அணுத்திணிவு) |
95.94(2) g/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| எதிர்மின்னி அமைப்பு |
[Kr] 4d5 5s1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| சுற்றுப் பாதையிலுள்ள எதிர்மின்னிகள் (எலக்ட்ரான்கள்) |
2, 8, 18, 13, 1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| இயல்பியல் பண்புகள் | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| இயல் நிலை | திண்மம் | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| அடர்த்தி (அறை வெ.நி அருகில்) |
10.28 கி/செ.மி³ | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| உருகுநிலையில் நீர்மத்தின் அடர்த்தி |
9.33 g/cm³ | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| உருகு வெப்பநிலை |
2896 K (2623 °C, 4753 °F) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| கொதி நிலை | 4912 K (4639 °C, 8382 °F) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| நிலை மாறும் மறை வெப்பம் |
37.48 கி.ஜூ/மோல் (kJ/mol) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| வளிமமாகும் வெப்ப ஆற்றல் |
617 கி.ஜூ/மோல் | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| வெப்பக் கொண்மை |
(25 °C) 24.06 ஜூ/(மோல்·K) J/(mol·K) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| அணுப் பண்புகள் | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| படிக அமைப்பு | கட்டகம், பருநடு | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ஆக்சைடு நிலைகள் |
2, 3, 4, 5, 6 (கடும் காடிய ஆக்ஸைடு) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| எதிர்மின்னியீர்ப்பு | 2.16 (பௌலிங் அளவீடு) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| மின்மமாக்கும் ஆற்றல் |
1st: 684.3 kJ/(mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2nd: 1560 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 3rd: 2618 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| அணு ஆரம் | 145 பிமீ | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| அணுவின் ஆரம் (கணித்) |
190 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| கூட்டிணைப்பு ஆரம் | 145 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| வேறு பல பண்புகள் | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| காந்த வகை | தரவு இல்லை | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| மின் தடைமை | (20 °C) 53.4 nΩ·m | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| வெப்பக் கடத்துமை |
(300 K) 138 வாட்/(மீ·கெ) W/(m·K) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| வெப்ப நீட்சி | (25 °C) 4.8 மைக்.மீ/(மி.மீ·கெ) µm/(m·K) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ஒலியின் விரைவு (மென் கம்பி) |
(அறை வெ.நி) 5400 மீ/நொ | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| யங்கின் மட்டு | 329 GPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Shear modulus | 20 GPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| அமுங்குமை | 230 GPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| பாய்சான் விகிதம் | 0.31 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| மோவின்(Moh's) உறுதி எண் | 5.5 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| விக்கர் உறுதிஎண் Vickers hardness |
1530 MPa (மெகாபாஸ்) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| பிரிநெல் உறுதிஎண் Brinell hardness]] |
1500 MPa (மெகாபாஸ்) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CAS பதிவெண் | 7439-98-7 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| குறிபிடத்தக்க ஓரிடத்தான்கள் | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| மேற்கோள்கள் | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
மாலிப்டினம் ( Molybdenum) என்பது Mo என்னும் வேதியியல் குறியீடு கொண்ட ஒரு வேதியியல் தனிமம் ஆகும். இதன் அணு எண் 42 ஆகும். மாலிப்டினத்தின் அணுக்கருவில் 54 நியூட்ரான்கள் உள்ளன. பண்டைய கிரேக்க மொழியில் ஈயம் போன்றது என்ற பொருள் கொண்ட மாலிப்டாசு என்ற சொல்லிலிருந்து மாலிப்டினம் என்ற பெயர் தோன்றியது. மாலிப்டினத்தின் தாதுக்களும் ஈயத்தின் தாதுக்களும் ஒரே மாதிரியாக இருந்து குழப்பத்தை உண்டாக்கும் தன்மையுடயவையாகும்[1]. மாலிப்டினத்தின் தாதுக்கள் நீண்ட நெடுங்காலமாக அறியப்பட்டாலும் மாலிப்டினம் 1778 ஆம் ஆண்டு கார்ல் வில்லெம் சீலே என்பவரால் கண்டுபிடிக்கப்பட்டது. பின்னர் 1781 ஆம் ஆண்டு முதன்முதலாக பீட்டர் யாக்கோபு எயெல்ம் என்பவரால் தனிமமாகத் தனித்துப் பிரித்து எடுக்கப்பட்டது.
மாலிப்டினம் தனித்த நிலையில் ஒருபோதும் இயற்கையில் கிடைப்பதில்லை. பல்வேறு ஆக்சிசனேற்ற நிலைகளில் கனிமங்களில் இது காணப்படுகிறது. தூய மாலிப்டினம் வெள்ளி போன்ற வெண்மையான உலோகமாகும். பொதுவாகத் தூள் நிலையில் இது கிடைக்கிறது. எளிதில் இதை தகடாகவும் கம்பியாகவும் மாற்றலாம். எஃகை விட மிருதுவானதாக காணப்படுகிறது. தூய நிலையில் உள்ளபோது இதை பளபளப்பாக மாற்றமுடியும். வலிமையான இவ்வுலோகம் பாரா காந்தத்தன்மை கொண்டதாக உள்ளது. அனைத்து தனிமங்களிலும் இது ஆறாவது உயர்ந்த உருகுநிலையைக் கொண்ட தனிமமாக உள்ளது. மாலிப்டினம் உடனடியாக கடினமான மற்றும் நிலைப்புத் தன்மை கொண்ட கார்பைடுகளாக மாறி கலப்புலோகங்களை உருவாக்குகிறது, இந்த காரணத்திற்காக உலகின் உற்பத்தியாகும் பெரும்பாலான மாலிப்டினத்தின் சுமார் 80% எஃகு உலோகக் கலவைகள் தயாரிக்கப் பயன்படுத்தப்படுகிறது. இக்கலப்புலோகங்களில் அதிக வலிமை கொண்ட உலோகக்கலவைகளும் மீவுயர் கலப்புலோகங்களும் அடங்கும்.
பெரும்பாலான மாலிப்டினம் சேர்மங்கள் தண்ணீரில் குறைந்த அளவே கரையக்கூடியனவாக உள்ளன. ஆனால் மாலிப்டினத்தை தாங்கியிருக்கும் தாதுக்கள் ஆக்சிசன் மற்றும் தண்ணீரைத் தொடர்பு கொள்ளும்போது உருவாகும் மாலிப்டேட்டு அயனி MoO2-4 மிகவும் நன்றாக கரையக்கூடியதாக உள்ளது. தொழிற்துறையில், உலக மாலிப்டினம் உற்பத்தியில் சுமார் 14% மாலிப்டினம் சேர்மங்கள் உயர் அழுத்த மற்றும் உயர் வெப்பநிலை பயன்பாடுகளில் நிறமிகள் மற்றும் வினையூக்கிகளாகப் பயன்படுத்தப்படுகின்றன. உயிரியலில் நைட்ரசன் நிலைநிறுத்தும் செயல்பாட்டில் வளிமண்டல மூலக்கூற்று நைட்ரசனில் இருக்கும் வேதிப் பிணைப்பை உடைப்பதற்கான மிகப்பொதுவான பாக்டீரியா வினையூக்கிகளுக்கு மாலிப்டினம் தாங்கும் நொதிகள் காரணமாக உள்ளன. குறைந்தபட்சம் 50 மாலிப்டினம் நொதிகள் இப்போது பாக்டீரியா, தாவரங்கள் மற்றும் விலங்குகளில் அறியப்படுகின்றன, இருப்பினும் பாக்டீரியா மற்றும் சயனோபாக்டீரியல் நொதிகள் நைட்ரசன் நிலை நிறுத்தலில் ஈடுபடுகின்றன. இந்த நைட்ரசனேசு நொதிகளைப் தன் வடிவத்தில் பெற்றிருக்கும் மாலிப்டினம் மற்ற மாலிப்டினம் நொதிகளிலிருந்து மாறுபட்டவையாக இருக்கின்றன. இவை அனைத்தும் மாலிப்டினம் இணைகாரணிகளில் முழுமையாக ஆக்சிசனேற்றப்பட்ட மாலிப்டினத்தைக் கொண்டிருக்கின்றன.
தோற்றமும் உற்பத்தியும்[தொகு]
மாலிப்டினம் தனித்த நிலையில் கிடைப்பதில்லை. பூமியின் மேலோட்டில் அதிகமாகக் கிடைக்கும் தனிமங்கள் பட்டியலில் 54 வது இடத்தைப் பிடிக்கிறது. அதே போல கடல்களில் அதிகமாகக் கிடைக்கும் தனிமங்களின் பட்டியலில் 25 வது இடத்தையும் மாலிடினம் பிடிக்கிறது. ஆக ஒட்டுமொத்தமாக சராசரியாக பில்லியனுக்கு 10 பகுதிகள் என்ற அளவில் பூமியில் மாலிப்டினம் கிடைக்கிறது. பிரபஞ்சத்தில் அதிகமாகக் கிடைக்கும் தனிமங்கள் என்ற வரிசையில் வகைப்படுத்தினால் மாலிப்டினத்திற்கு 42 ஆவது இடமாகும்[2]. உருசியாவின் லூனா 24 விண்கலத் திட்டத்தில் நிலவிலிருந்து கொண்டுவரப்பட்ட பைராக்சின் துண்டில் மாலிப்டினம் இருந்தது கண்டுபிடிக்கப்பட்டது[3].
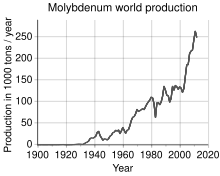
புவியில் மாலிப்டினம் மாலிப்டினைடு (MoS2), உல்பினைட்டு (PbMoO4)ம் பாவெலைட்டு (CaMoO4), மாலிப்டைட்டு (Fe2O3.MoO3.2H2O) என்ற தாதுக்கள் வடிவில் கிடைக்கிறது. பொதுவாக மாலிப்டினைட்டு என்ற தாதுவிலிருந்து மாலிப்டினம் தயாரிக்கப்படுகிறது. 2011 ஆம் ஆண்டில் உலக மாலிப்டினம் உற்பத்தி 250000 டன்கள் ஆகும். சீனா (94000 டன்), அமெரிக்கா (64000டன்), சிலி (38000 டன்), பெரு (18000 டன்) மெக்சிகோ (12000 டன்) ஆகியவை மாலிப்டினத்தை அதிகமாக உற்பத்தி செய்யும் நாடுகளாகும். 10 மில்லியன் டன் மாலிப்டினம் உலகில் இருப்பு இருக்கலாம் எனக் கணக்கிடப்பட்டுள்ளது. அவ்விருப்பு சீனா (4.3 மில்லியன் டன்) அமெரிக்கா (2.7 மில்லியன் டன்), சிலி (1.2 மில்லியன் டன்) போன்ற நாடுகளில் காணப்படுகிறது. 93% மாலிப்டினம் வட மற்றும் தென் அமெரிக்கக் கண்டங்களில் உற்பத்தி செய்யப்படுகிறது. மீதி மாலிப்டினத்தை ஐரோப்பா மற்றும் ஆசிய கண்டங்கள் தயாரிக்கின்றன.
மாலிப்டினத் தாது நுண்ணிய தூளாக அரைக்கப்பட்டு நுரை மிதப்பு மிறையில் அடர்ப்பிக்கப்படுகிறது. இவ்வாறு அடர்ப்பிக்கப்பட்ட தாது காற்றில் 700° செல்சியசு வெப்பநிலையில் நன்கு வறுக்கப்படுகிறது. மாலிப்டினம்(VI) ஆக்சைடும் வாயுநிலையில் உள்ள கந்தக டை ஆக்சைடும் உருவாகின்றன.
- 2 MoS2 + 7 O2 → 2 MoO3 + 4 SO2
மாசுடன் கூடிய மாலிப்டினம்(VI) ஆக்சைடு அமோனியாவில் கலக்கப்பட்டு அமோனியம் மாலிப்டேட்டு தயாரிக்கப்படுகிறது.
- MoO3 + 2 NH3 + H2O → (NH4)2(MoO4)
படிகமாக்கல் முறையில் அமோனியம் மாலிப்டேட்டு தூய்மை செய்யப்படுகிறது. இப்படிகங்களை வெப்பச் சிதைவுக்கு உட்படுத்தி தூய்மையான மாலிப்டினம்(VI) ஆக்சைடு தயார் செய்யப்படுகிறது.
மாலிப்டினைட்டு தாதுவுடன் கலந்துள்ள தாமிரம் அமோனியாவில் சிறிதளவே கரையும். முற்றிலுமாக அதை நீக்க தாதுவானது ஐதரசன் சல்பைடுடன் சேர்க்கப்பட்டு வீழ்படிவாக்கப்பட வேண்டும். அமோனியம் மாலிப்டேட்டு அமோனியம் டைமாலிப்டேட்டாக மாறுகிறது. இதைத் தனித்துப் பிரித்து வெப்பப்படுத்தினால் தூய்மையான மாலிப்டினம் டிரை ஆக்சைடு கிடைக்கிறது.
- (NH4)2Mo2O7 → 2 MoO3 + 2 NH3 + H2O
இந்த மாலிப்டினம் டிரை ஆக்சைடு 1100 பாகை செல்சியசு வெப்பநிலைக்கு சூடுபடுத்தப்படுகிறது. மாலிப்டினம் டிரை ஆக்சைடு பதங்கமாதலுக்கு உள்ளாகி மேலும் தூய்மைப்படுத்தப்படுகிறது. இதை ஒடுக்குதலுக்கு உட்படுத்தி தூமையான மாலிப்டினம் தயாரிக்கப்படுகிறது. ஒடுக்கும் முகவர்களாக ஐதரசன், கார்பன்ம் அலுமினியம், கால்சியம், துத்தநாகம் போன்றவை பயன்படுத்தப்படுகின்றன.
- MoO3 + 3 H2 → Mo + 3 H2O
MoO3 + 3 C → Mo + 3 CO
மேற்கூறப்பட்ட முறைகளில் தயாரிக்கப்படும் மாலிப்டினம் தூளாகக் கிடைக்கும். இதை ஐதரசன் வாயுச் சூழலில் அழுத்தத்திற்கு உட்படுத்தி சூடாக்கினால் திண்ம மாலிப்டினம் கிடைக்கும்.
எஃகு உற்பத்தி செய்வதற்குத் தேவையான மாலிப்டினத்தை, இதனுடன் இரும்பைச் சேர்த்து அலுமினோவெப்பச் சிதைவு வினையின் மூலம் பெர்ரோமாலிப்டினமாகத் தயாரிக்கிறார்கள். பெர்ரோ மாலிப்டினத்தில் 60% மாலிப்டினம் கலந்துள்ளது[4][5].
இயற்பியல் பண்புகள்[தொகு]
தூய மாலிப்டினம் வெள்ளி போன்ற வெண்மையான உலோகமாகக் காணப்படுகிறது. மாலிப்டினத்தின் மோவின் கடினத்தன்மை எண் 5.5 ஆகும். இதனுடைய உருகுநிலை 2623° செல்சியசு ஆகும். இயற்லையாகத் தோன்றும் தனிமங்களில் தங்குதன், ஒசுமியம், இரேனியம், டாண்ட்டலம் மற்றும் கார்பன் போன்ற தனிமங்கள் மட்டுமே உயர்ந்த உருகுநிலை கொண்டவையாகும்[1]. மாலிப்டினத்தின் பலவீனமான ஆக்சிசனேற்றம் 300 ° செல்சியசு வெப்பநிலையில் தொடங்குகிறது. வணிக ரீதியாக பயன்படுத்தப்படும் உலோகங்கள் மத்தியில் வெப்ப விரிவாக்க குணகங்களில் குறைவான குணகம் கொண்டவற்றில் இதுவும் ஒன்றாகும் [6]. மாலிப்டினம் கம்பிகளின் விட்டம் ~ 50-100 நானோமீட்டர் முதல் 10 நானோமீட்டர் வரை குறையும் போது அவற்றின் இழுவிசை வலிமை 10 முதல் 30 கிகாபாசுக்கல் வரை சுமார் 3 மடங்கு அதிகரிக்கிறது [7],
வேதிப் பண்புகள்[தொகு]
மாலிப்டினம் ஓர் இடைநிலை தனிமமாகும். உதன் மின்னெதிர் தன்மை பௌலிங் அளவுகோலில் 2.16 ஆகும். அறை வெப்பநிலையில் ஆக்சிசன் அல்லது காற்றுடன் வெளிப்படையாக வினைபுரியாது. 300 பாகை செல்சியசு வெப்பநிலையில் மாலிப்டினம் ஆக்சிசனேற்றம் அடையத் தொடங்குகிறது. 600 பாகை செல்சியசு வெப்பநிலைக்கு மேல் இதன் பேரளவு ஆக்சிசனேற்றம் நிகழ்ந்து மாலிப்டினம் டிரையாக்சைடு உருவாகிறது. கடுமையான நிபந்தனைகளுக்கு உட்பட்டு Mo3+ நேர்மின் அயனி அறியப்படுகிறது என்றாலும் பிற கன இடைநிலைத் தனிமங்கள் போல மாலிப்டினம் நீரிய கரைசல்களில் சிறிய அளவில் நேர்மின் அயனியாக உருவாக முற்படுகிறது [8].
ஐசோடோப்புகள்[தொகு]
மாலிடினத்திற்கு 35 ஐசோடோப்புகள் உள்ளன. அவற்றின் அணுநிறை 83 முதல் 117 வரை மாறுபடுகின்றன. இவற்றில் நான்கு சிற்றுறுதி நிலை அணுக்கரு மாற்றியங்களும் உள்ளன. 92, 94, 95, 96, 97, 98, மற்றும் 100 அணு நிறைகள் கொண்ட ஏழு ஐசோடோப்புகள் இயற்கையில் தோன்றுகின்றன. இயற்கையில் தோன்றும் ஐசோடோப்புகளில் மாலிப்டினம்-100 மட்டும் நிலைப்புத் தன்மையற்றதாகும்[9].
மாலிப்டினம் -98 மிக அதிகளவில் காணப்படும் ஐசோடோப்பு ஆகும். அனைத்து மாலிப்டினங்களையும் 24.14 சதவீதம் அளவிற்கு இது உள்ளடக்கியுள்ளது. மாலிப்டினம்-100 இன் அரைவாழ்வுக் காலம் சுமார் 1019 ஆண்டுகளாகும். இது இரட்டை பீட்டா சிதைவுக்கு உட்பட்டு ருத்தேனியம் -100 ஆக மாறுகிறது. அணு நிறை 111 முதல் 117 வரையிலான மாலிப்டினம் ஐசோடோப்புகள் அனைத்தும் ஏறக்குறைய 150 நானோ வினாடிகள் என்ற அரை ஆயுளைக் கொண்டுள்ளன[9][10]. மாலிப்டினத்தின் அனைத்து நிலையற்ற ஐசோடோப்புகளும் நையோபியம், டெக்னீசியம் மற்றும் ருத்தேனியம் ஆகியவற்றின் ஐசோடோப்புகளாக சிதைகின்றன[10].
அணுக்கரு பிளப்பில் தோன்றும் மாலிப்டினம்-99 ஐசோடோப்பை உள்ளடிக்கியே மாலிப்டினம் ஐசோடோப்பின் மிகப் பொதுவான பயன்பாடு அமைகிறது. மருத்துவத்தில் பயன்படுத்தப்படும் டெக்னீசியம்-99 என்ற ஐசோடோப்பு உருவாக்கத்தில் மாலிப்டினம் -99 பெரிதும் பயன்படுகிறது[11]. மாலிப்டினம்-98 ஐசோடோப்பிலிருந்து மாலிப்டினம்-99 தயாரிப்பதற்கான காப்புரிமைக்கும் 2008 ஆம் ஆண்டு விண்ணப்பிக்கப்பட்டுள்ளது[12],
சேர்மங்கள்[தொகு]
-II முதல் +VI வரையிலான ஆக்சிசனேற்ற நிலைகளில் மாலிப்டினம் வேதிச் சேர்மங்களாக உருவாகிறது. உயர் ஆக்சிசனேற்ற நிலைகள் இதன் நிலப்பரப்பு தோற்றம் மற்றும் இதன் உயிரியல் பங்களிப்புகளுக்கு மிகவும் பொருத்தமானவையாக உள்ளது. இடைப்பட்ட ஆக்சிசனேற்ற நிலைகள் பெரும்பாலும் உலோகத் தொகுதிகளுடன் தொடர்பு கொண்டுள்ளன. தாழ்ந்த நிலை ஆக்சிசனேற்ற நிலைகளில் மாலிப்டினம் கரிம்மாலிப்டினம் சேர்மங்களுடன் தொடர்புடையதாக உள்ளது. மாலிப்டினம் மற்றும் தங்குதன் தனிமங்களின் வேதியியல் ஒரே மாதிரியாக உள்ளன. மாலிப்டினம்(III) இன் அரிதான தன்மை ஒப்பீட்டளவில் குரோமியம்(III) சேர்மங்களின் பரவலுடன் முரண்படுகிறது. மாலிப்டினம்(VI) ஆக்சைடில் (MoO3) மாலிப்டினம் அதிக ஆக்சிசனேற்ற நிலையில் காணப்படுகிறது, அதே நேரத்தில் மாலிப்டினத்தின் சாதாரண கந்தகச் சேர்மம் மாலிப்டினம் டைசல்பைடு (MoS2) ஆகும் [4]
| ஆக்சிசனேற்ற நிலை |
உதாரணம்[13] |
|---|---|
| −1 | Na 2[Mo 2(CO) 10] |
| 0 | Mo(CO) 6 |
| +1 | Na[C 6H 6Mo] |
| +2 | MoCl 2 |
| +3 | Na 3[Mo(CN)] 6 |
| +4 | MoS 2 |
| +5 | MoCl 5 |
| +6 | MoF 6 |

.
மாலிப்டினம் டைசல்பைடும் (MoS2), மாலிப்டினம் டிரையாக்சைடு (MoO3) வர்த்தகப் பார்வையில், மிக முக்கியமான சேர்மங்களாகக் கருதப்படுகின்றன. கருப்பு நிறத்தில் காணப்படும் மாலிப்டினம் டைசல்பைடு ஒரு முக்கிய கனிமமாகும். இதை காற்றில் வறுக்க்கும்போது மாலிப்டினம் டிரையாக்சைடு ஆக்சைடு உருவாகிறது:[4]
- 2 MoS
2 + 7 O
2 → 2 MoO
3 + 4 SO
2.
உயர் வெப்பநிலையில் மாலிப்டினம் டிரையாக்சைடு ஆவியாகிறது. பிற மாலிப்டினம் சேர்மங்களையும் அதன் உலோகக் கலவைகளையும் தயாரிக்க உதவும் முன்னோடிச் சேர்மமாக இது பயன்படுகிறது. மாலிப்டினம் பல ஆக்சிசனேற்ற நிலைகளை கொண்டிருந்தாலும் +4 மற்றும் +6 ஆக்சிசனேற்ற நிலைகள் நிலைப்புத் தன்மை கொண்டவையாகும். மாலிப்டினம்(VI) ஆக்சைடு வலிமையான காரநீரில் கரைந்து மாலிப்டேட்டுகளாக (MoO42−) உருவாகிறது. குரோமேட்டுகளைக்காட்டிலும் மாலிப்டினேட்டுகள் வலிமை குறைந்த ஆக்சிசனேற்றிகளாகும். குறைந்த pH மதிப்புகளில் இவை ஒடுங்கி [Mo7O24]6− மற்றும் [Mo8O26]4−போன்ற அணைவு ஆக்சியெதிர்மின் அயனிகளாக மாற முற்படுகின்றன. பல்மாலிப்டேட்டுகள் மற்ற அயனிகளையும் தன்னுடன் சேர்த்துக் கொண்டு பல்லாக்சோமெட்டலேட்டுகளாக உருவாகின்றன[14]. அடர் நீல நிறத்துடன் பாசுபரசை கொண்டிருக்கும் பல்லினமாலிப்டேட்டு P[Mo12O40]3− அயனி பாசுபரசை நிறமாலையியலில் கண்டுபிடிக்க பயன்படுகிறது [15]. மாலிப்டினத்தின் பல்வேறு ஆக்சிசனேற்ற நிலைகள் காரணமாக பல்வேறு மாலிடினம் குளோரைடுகளும் உருவாகின்றன.
- மாலிப்டினம்(II) குளோரைடு (MoCl2) ஓர் அறுமமாகவும் (Mo6Cl12) தொடர்புடைய இரட்டை எதிர்மின் அயனியாகவும் [Mo6Cl14]2-. காணப்படுகிறது.
- மாலிப்டினம்(III) குளோரைடு (MoCl3) அடர் சிவப்பு திண்மமாக காணப்படுகிறது. இதை மூவெதிர்மின் அயனி அணைவாக மாற்றலாம் [MoCl6]3-.
- Molybdenum(IV) chloride (MoCl4) ஒரு கறுப்பு நிற திண்மம் ஆகும். இது பல்லுருவக் கட்டமைப்பை ஏற்கிறது. .
- மாலிப்டினம்(V) குளோரைடு (MoCl5) அடர் பச்சை நிறத்தில் காணப்படும் இத்திண்மம் ஈருருவக் கட்டமைப்பை ஏற்கிறது. .
மாலிப்டினம்(VI) குளோரைடு (MoCl6) அறியப்படவில்லை என்றாலும் மாலிப்டினம் அறுபுளோரைடு நன்கு அறியப்பட்டுள்ளது. குரோமியம் மற்றும் பிற சில இடைநிலைத் தனிமங்கள் போல மாலிப்டினம் Mo2(CH3COO)4 போன்ற நான்மடங்கு பிணைப்புகளாக உருவாகிறது. [Mo2Cl8]4− சேர்மத்திலும் நான்மடங்கு பிணைப்பு உள்ளது.[4][16]
மாலிப்டினத்தின் பயன்கள்[தொகு]
- கலப்புலோக எஃகுத் தயாரிப்பில் பெர்ரோமாலிப்டினம் காலப்புலோகம் பெரிதும் பயன்படுகிறது[17].
- தோல் மற்றும் இரப்பர் பொருட்களுக்கு நிறமூட்டும் பொருளாகப் பயன்படுத்தப்படுகிறது.
- அமோனியம் என்ற சேர்மத்தைத் தயாரிக்க மாலிப்டினம் பயன்படுகிறது, பாசுப்பேட்டு, ஆர்சனேட்டு உப்புகளைக் கண்டறிவதில் இச்சேர்மம் பெரிதும் உதவுகிறது.
- மாலிப்டினம் தூள் சில தாவரங்களுக்கு உரமாகப் பயன்படுகிறது[18].
- எக்சு கதிர் குழாய்களில் மாற்ரு மின்வாயாக இதைப் பயன்படுத்துகிறார்கள்.
- மாலிப்டினம்-தங்குதன் வெப்ப மின் இரட்டைகள் உயர் வெப்பநிலை அளவீடுகளுக்குப் பயனாகிறது.
- மாலிப்டினம் எஃகு பல்வேரு இயந்திர பாகங்கள் தயாரிக்க உதவுகிறது.
- மின் உலைகளில் பிளாட்டினத்திற்கு மாற்றாக மாலிப்டினம் பயன்படுத்தப்படுகிறது.
- மாலிப்டினம் அடிப்படையிலான வினையூக்கிகள் ஆல்டோல் ஒடுக்கம்[19] , தேர்ந்தெடுக்கப்பட்ட ஆக்சிஜனேற்றம்[20][21], டீசல்புரைசேஷன்[22] மற்றும் மின்னாற்பகுப்பு[23] போன்ற பல்வேறு தொழில்துறை சார்ந்த முன்னெச்சரிக்கைகளுக்காக உருவாக்கப்படுகின்றன.
இவற்றையும் பார்க்க[தொகு]
மேற்கோள்கள்[தொகு]
- ↑ 1.0 1.1 Lide, David R., தொகுப்பாசிரியர் (1994). "Molybdenum". CRC Handbook of Chemistry and Physics. 4. Chemical Rubber Publishing Company. பக். 18. பன்னாட்டுத் தரப்புத்தக எண்:0-8493-0474-1.
- ↑ Considine, Glenn D., தொகுப்பாசிரியர் (2005). "Molybdenum". Van Nostrand's Encyclopedia of Chemistry. New York: Wiley-Interscience. பக். 1038–1040. பன்னாட்டுத் தரப்புத்தக எண்:978-0-471-61525-5.
- ↑ Jambor, J.L. (2002). "New mineral names". American Mineralogist 87: 181. http://www.minsocam.org/msa/AmMin/TOC/Abstracts/2002_Abstracts/Jan02_Abstracts/Jambor_p181_02.pdf.
- ↑ 4.0 4.1 4.2 4.3 Holleman, Arnold F.; Wiberg, Egon; Wiberg, Nils (1985). Lehrbuch der Anorganischen Chemie (91–100 ). Walter de Gruyter. பக். 1096–1104. பன்னாட்டுத் தரப்புத்தக எண்:3-11-007511-3.
- ↑ Gupta, C. K. (1992). Extractive Metallurgy of Molybdenum. CRC Press. பக். 1–2. பன்னாட்டுத் தரப்புத்தக எண்:978-0-8493-4758-0.
- ↑ Emsley, John (2001). Nature's Building Blocks. Oxford: Oxford University Press. பக். 262–266. பன்னாட்டுத் தரப்புத்தக எண்:0-19-850341-5. https://books.google.com/?id=j-Xu07p3cKwC&pg=PA265.
- ↑ Shpak, Anatoly P.; Kotrechko, Sergiy O.; Mazilova, Tatjana I.; Mikhailovskij, Igor M. (2009). "Inherent tensile strength of molybdenum nanocrystals". Science and Technology of Advanced Materials 10 (4): 045004. doi:10.1088/1468-6996/10/4/045004. பப்மெட்:27877304. Bibcode: 2009STAdM..10d5004S.
- ↑ Parish, R. V. (1977). The Metallic Elements. New York: Longman. பக். 112, 133. பன்னாட்டுத் தரப்புத்தக எண்:978-0-582-44278-8. https://archive.org/details/metallicelements0000pari_y1t0.
- ↑ 9.0 9.1 வார்ப்புரு:NUBASE 2003
- ↑ 10.0 10.1 Lide, David R., தொகுப்பாசிரியர் (2006). CRC Handbook of Chemistry and Physics. 11. CRC. பக். 87–88. பன்னாட்டுத் தரப்புத்தக எண்:978-0-8493-0487-3.
- ↑ Armstrong, John T. (2003). "Technetium". Chemical & Engineering News. Archived from the original on 2008-10-06. பார்க்கப்பட்ட நாள் 2009-07-07.
- ↑ Wolterbeek, Hubert Theodoor; Bode, Peter "A process for the production of no-carrier added 99Mo". European Patent EP2301041 (A1) ― 2011-03-30. Retrieved on 2012-06-27.
- ↑ Schmidt, Max (1968). "VI. Nebengruppe" (in German). Anorganische Chemie II.. Wissenschaftsverlag. பக். 119–127.
- ↑ Pope, Michael T.; Müller, Achim (1997). "Polyoxometalate Chemistry: An Old Field with New Dimensions in Several Disciplines". Angewandte Chemie International Edition 30: 34–48. doi:10.1002/anie.199100341.
- ↑ Nollet, Leo M. L., தொகுப்பாசிரியர் (2000). Handbook of water analysis. New York, NY: Marcel Dekker. பக். 280–288. பன்னாட்டுத் தரப்புத்தக எண்:978-0-8247-8433-1. https://books.google.com/?id=YZpW4Y4Q_PIC&pg=PA280.
- ↑ Walton, Richard A.; Fanwick, Phillip E.; Girolami, Gregory S.; Murillo, Carlos A.; Johnstone, Erik V. (2014). Girolami, Gregory S.. ed (in en). Inorganic Syntheses: Volume 36. John Wiley & Sons, Inc.. பக். 78–81. doi:10.1002/9781118744994.ch16. பன்னாட்டுத் தரப்புத்தக எண்:9781118744994.
- ↑ Influence of Mo alloying on pitting corrosion of stainless steels used as concrete reinforcement, Rem: Rev. Esc. Minas vol.66 no.2, 2013, http://www.scielo.br/pdf/rem/v66n2/v66n2a06.pdf
- ↑ Molybdenum supply and biological fixation of nitrogen by two Brazilian common bean cultivars, Rev. bras. eng. agríc. ambient. vol.21 no.2, Feb. 2017, http://www.scielo.br/pdf/rbeaa/v21n2/1415-4366-rbeaa-21-02-0100.pdf
- ↑ Vrbková, Eva; Šteflová, Barbora; Sekerová, Lada; Krupka, Jiří; Vyskočilová, Eliška; Červený, Libor (2020-04-01). "Contribution to MoO3–SiO2 and WO3–SiO2 utilization—active catalysts in jasmine aldehyde, 2-hexyl-1,3-dioxolane and methyllaurate synthesis" (in en). Reaction Kinetics, Mechanisms and Catalysis 129 (2): 645–658. doi:10.1007/s11144-020-01727-6. பன்னாட்டுத் தர தொடர் எண்:1878-5204. https://doi.org/10.1007/s11144-020-01727-6.
- ↑ Surface chemistry of phase-pure M1 MoVTeNb oxide during operation in selective oxidation of propane to acrylic acid. Journal of Catalysis, 285, 48-60, https://pure.mpg.de/rest/items/item_1108560_8/component/file_1402724/content
- ↑ Kinetic studies of propane oxidation on Mo and V based mixed oxide catalysts. PhD Thesis, Technische Universität Berlin, https://pure.mpg.de/rest/items/item_1199619_5/component/file_1199618/content
- ↑ Hydrodesulfurization of dibenzothiophene using novel unsupported FeMoS catalysts prepared by in-situ activation from Fe (III)-containing thiomolybdate salts, https://link.springer.com/article/10.1007/s11144-021-02040-6
- ↑ Molybdenum sulfide, method for producing same, and hydrogen generation catalyst, Patent US11642663B2
புற இணைப்புகள்[தொகு]
- Molybdenum at The Periodic Table of Videos (University of Nottingham)
- Mineral & Exploration – Map of World Molybdenum Producers 2009
- "Mining A Mountain" Popular Mechanics, July 1935 pp. 63–64
- Site for global molybdenum info
- CDC – NIOSH Pocket Guide to Chemical Hazards


