இலித்தியம்
| லித்தியம் | |||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
3Li
| |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| தோற்றம் | |||||||||||||||||||||||||
வெள்ளி போன்ற வெள்ளை (படத்தில் எண்ணெயில் மிதக்கிறது) லித்தியத்தின் நிறமாலைக் கோடுகள் | |||||||||||||||||||||||||
| பொதுப் பண்புகள் | |||||||||||||||||||||||||
| பெயர், குறியீடு, எண் | லித்தியம், Li, 3 | ||||||||||||||||||||||||
| உச்சரிப்பு | /ˈlɪθiəm/ LI-thee-əm | ||||||||||||||||||||||||
| தனிம வகை | கார உலோகம் | ||||||||||||||||||||||||
| நெடுங்குழு, கிடை வரிசை, குழு | 1, 2, s | ||||||||||||||||||||||||
| நியம அணு நிறை (அணுத்திணிவு) |
6.941(2) | ||||||||||||||||||||||||
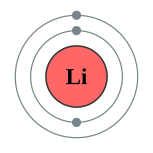
| இலத்திரன் அமைப்பு | 1s2 2s1 or [He]2s1 2, 1 | ||||||||||||||||||||||||
| வரலாறு | |||||||||||||||||||||||||
| கண்டுபிடிப்பு | J. Arfwedson (1817) | ||||||||||||||||||||||||
| முதற்தடவையாகத் தனிமைப்படுத்தியவர் |
W. Brande (1821) | ||||||||||||||||||||||||
| இயற்பியற் பண்புகள் | |||||||||||||||||||||||||
| நிலை | திண்மம் | ||||||||||||||||||||||||
| அடர்த்தி (அ.வெ.நிக்கு அருகில்) | 0.534 g·cm−3 | ||||||||||||||||||||||||
| திரவத்தின் அடர்த்தி உ.நி.யில் | 0.512 g·cm−3 | ||||||||||||||||||||||||
| உருகுநிலை | 453.69 K, 180.54 °C, 356.97 °F | ||||||||||||||||||||||||
| கொதிநிலை | 1615 K, 1342 °C, 2448 °F | ||||||||||||||||||||||||
| மாறுநிலை | (extrapolated) 3223 K, 67 MPa | ||||||||||||||||||||||||
| உருகலின் வெப்ப ஆற்றல் | 3.00 கி.யூல்·மோல்−1 | ||||||||||||||||||||||||
| வளிமமாக்கலின் வெப்ப ஆற்றல் | 147.1 கி.யூல்·மோல்−1 | ||||||||||||||||||||||||
| வெப்பக் கொண்மை | 24.860 யூல்.மோல்−1·K−1 | ||||||||||||||||||||||||
| ஆவி அழுத்தம் | |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| அணுப் பண்புகள் | |||||||||||||||||||||||||
| ஒக்சியேற்ற நிலைகள் | +1, -1 (strongly basic oxide) | ||||||||||||||||||||||||
| மின்னெதிர்த்தன்மை | 0.98 (பாலிங் அளவையில்) | ||||||||||||||||||||||||
| மின்மமாக்கும் ஆற்றல் | 1வது: 520.2 kJ·mol−1 | ||||||||||||||||||||||||
| 2வது: 7298.1 kJ·mol−1 | |||||||||||||||||||||||||
| 3வது: 11815.0 kJ·mol−1 | |||||||||||||||||||||||||
| அணு ஆரம் | 152 பிமீ | ||||||||||||||||||||||||
| பங்கீட்டு ஆரை | 128±7 pm | ||||||||||||||||||||||||
| வான்டர் வாலின் ஆரை | 182 பிமீ | ||||||||||||||||||||||||
| பிற பண்புகள் | |||||||||||||||||||||||||
| படிக அமைப்பு | body-centered cubic | ||||||||||||||||||||||||
| காந்த சீரமைவு | paramagnetic | ||||||||||||||||||||||||
| மின்கடத்துதிறன் | (20 °C) 92.8 nΩ·m | ||||||||||||||||||||||||
| வெப்ப கடத்துத் திறன் | 84.8 W·m−1·K−1 | ||||||||||||||||||||||||
| வெப்ப விரிவு | (25 °C) 46 µm·m−1·K−1 | ||||||||||||||||||||||||
| ஒலியின் வேகம் (மெல்லிய கம்பி) | (20 °C) 6000 மீ.செ−1 | ||||||||||||||||||||||||
| யங் தகைமை | 4.9 GPa | ||||||||||||||||||||||||
| நழுவு தகைமை | 4.2 GPa | ||||||||||||||||||||||||
| பரும தகைமை | 11 GPa | ||||||||||||||||||||||||
| மோவின் கெட்டிமை (Mohs hardness) |
0.6 | ||||||||||||||||||||||||
| CAS எண் | 7439-93-2 | ||||||||||||||||||||||||
| மிக உறுதியான ஓரிடத்தான்கள் (சமதானிகள்) | |||||||||||||||||||||||||
| முதன்மைக் கட்டுரை: லித்தியம் இன் ஓரிடத்தான் | |||||||||||||||||||||||||
| |||||||||||||||||||||||||
இலித்தியம் (Lithium) என்பது Li என்ற மூலக்கூற்று வாய்ப்பாட்டுடன், வெள்ளி போலும் தோற்றம் உள்ள மென்மையான ஒரு மாழை (உலோகம்). இது தனிம அட்டவணையில் 3ஆவதாக உள்ள ஒரு தனிமம். இதன் அணுவெண் 3. இதன் அணுக்கருவில் மூன்று நேர்மின்னிகளும் நான்கு நொதுமிகளும் உள்ளன. இது மிகவும் மென்மையாக உள்ளதால், ஒரு கத்தியால் எளிதாக வெட்டலாம். மாழைகள் (உலோகங்கள்) யாவற்றிலும் மிகக்குறைவான எடை கொண்ட மாழை இலித்தியம் ஆகும். இலித்தியத்தின் அடர்த்தியும், நீரில் பாதியளவு தான். இலித்தியம் மின்கலங்களிலே பெருமளவு பயன்படுகின்றது.
இலித்தியத்தின் அணு எண் 3 ஆகையால் இதன் அணுக்கருவிலே மூன்று நேர்மின்னிகள் (proton, புரோட்டான்) உள்ளன; மூன்று எதிர்மின்னிகள் (electron, இலத்திரன்) அணுச் சுழல் பாதைகளில் உலா வருகின்றன. இந்த மூன்று எதிர்மின்னிகளில், இரண்டு எதிர்மின்னிகள் உட்சுற்றுப்பாதையில் அதற்கான நிறைவுற்ற நிலையில் உள்ளன. ஆனால், ஓர் எதிர்மின்னி மட்டும் தனியாய் அடுத்த சுழல் பாதையில் இருப்பதால், இவ்வெதிர்மின்னியை வேதியியல் வினைகளில் எளிதில் இழக்கின்றது. இதனால், எளிதாக நீரோடு இயைவதால் (வேதியியல் வினையால் சேர்வதால்), இலித்தியம் தனியாய் எளிதில் கிடைப்பதில்லை. தூய இலித்தியம், காற்றிலும் நீரிலும் எளிதில் தீப்பற்றும் ஒரு தனிமம். இதன் தன்வெப்பக் கொள்ளளவு எல்லாத் திண்ம நிலைப் பொருள்களிலும் மிகப்பெரியது. இதன் பெறுமானம் 3582 J Kg−1 K−1 ஆகும். அதாவது ஒரு கிலோகிராம் எடையுள்ள இலித்தியத்தின் வெப்பநிலையை ஒரு கெல்வினால் உயர்த்த வேண்டுமெனில், 3582 யூல் (Joule) ஆற்றல் தரவேண்டும்.
இலித்தியம் புவியில் கிடைக்கும் தனிமங்களில் 33 ஆவது மலிவான பொருள்.[1]. இது உலகில் பரவலாகக் கிடைக்கின்றது. புவியின் புற ஓட்டில் மில்லியனில் 20 முதல் 70 பங்குகள் (ppm) [2] என்ற அளவில் உள்ளது.
இலித்தியம் கண்டறிதல்[தொகு]
பீட்டாலைட்டு என்ற கனிமத்தைப் பகுத்தாராய்ந்த வாக்குலின்(Vauquelin) என்பார் அதில் அலுமினா (அலுமினியம் ஆக்ஃசைடு), சிலிக்கா தவிர்த்து காரமாழை (கார உலோகம்) இருப்பதைக் கண்டார்.ஆனால் அது பொட்டாசியம் என்று பிழையாக அறிவித்து விட்டார். இதற்குச் சரியான விளக்கத்தை முறையாக அளித்து இலித்தியம் என்ற புதிய தனிமத்தைக் கண்டு பிடித்த பெருமையைத் தட்டித் சென்றவர் சுவீடன் நாட்டின் வேதியல் அறிஞரான அர்ப்வெட்சன் (Arfwedson) என்பாராவர்.[3][4][5] பீட்டாலைட்டு கனிமத்தில் 80 % சிலிக்கான் ஆக்சைடும், 17 % அலுமினியமும் 3 % அப்புதிய காரமாழையும் இருக்கின்றது. பீட்டாலைட்டை,பேரியம் கார்பொனேட்டுடன் சேர்ந்து சூடுபடுத்தி அதிலிருந்து இலித்தியம் பிரித்தெடுக்கப் பட்டது.[5][6][7] இதற்கு இலித்தியம் என்று பெயரிட்டவர் அர்ப்வெட்சன். இது பாறை என்று பொருள்படும் 'இலித்தியோஸ் ' என்ற கிரேக்க மொழிச் சொல்லிலிருந்து உருவானது.[1][5] 1855 ல் இடாய்ச்சுலாந்து (செருமன் நாட்டு) வேதியியல் அறிஞர் புன்செனும், இங்கிலாந்து நாட்டு இயற்பியலறிஞர் மாதீசனும் உருக்கப்பட்ட இலித்தியம் குளோரைடை மின்னாற் பகுப்பிற்கு உட்படுத்தி வணிக அளவில் இலித்தியத்தைப் பிரித்தெடுத்தனர்.[8]

பண்புகள்[தொகு]
பௌதீக இயல்புகள்[தொகு]
தனிம அட்டவணையில் ஐதரசன், ஈலியத்திற்கு அடுத்து மூன்றாவதாக இடம் பெற்றுள்ள, மிக இலேசான மாழை (உலோகம்) இலித்தியம். பூமியில் இலித்தியத்தின் கனிமங்கள் மிக அரிதாகவே காணப்படுகின்றன. இதன் செழுமை சோடியம், பொட்டாசியத்தை விட மிகவும் குறைவு. இலித்தியம் இயற்கையில் தங்கம், வெள்ளி போலத் தனித்துத் தூய நிலையில் கிடைப்பதில்லை. இது மென்மையான வெள்ளி போன்று பளபளக்கின்ற மாழையாகும். வேதியியலின் படி இது சோடியத்தை ஒத்தது என்றாலும் அதை விட வீரியம் குறைந்தது. இதை விட இலேசான உலோகம் வேறெதுவும் இல்லை. இலித்தியம் நீரை விட எடை குறைந்தது. இதன் அடர்த்தி, நீரின் அடர்த்தியில் பாதியளவே என்பதால் நீரில் மிதக்கின்றது.[note 1][9] ஆனால் நீர் கார உலோகங்களுக்கு ஒரு பாதுகாப்பு ஊடகமாக இருக்க முடியாது.[1]

அறை வெப்ப நிலையில் இலித்தியம் காற்றில் உள்ள நைதரசன், ஆக்சிசனுடன் வினை புரிகின்றது.[10][11][12] ஒரு கண்ணாடிக் குப்பியில் சிறிதளவு இலித்தியத்தை இட்டு அதை இறுக்க மூடிவிட்டால் அதிலுள்ள காற்றையெல்லாம் இலித்தியம் உள்வாங்கிக் கொண்டுவிடுவதால் அங்கு ஒரு வெற்றிடம் விளைகிறது. சோடியத்தை மண்ணெண்ணெய் அல்லது பெட்ரோலில் பாதுகாப்பாக வைத்துக் கொள்ள முடிவதைப் போல இலித்தியத்தை முழுமையாகப் பாதுகாக்க முடிவதில்லை. எனவே இலித்தியத்தை குச்சிகளாக்கி வாசிலின் (Vaseline) அல்லது பாரபின் மெழுகில் புதைத்து வைக்கின்றார்கள்.
இதன் வேதி குறியீடு Li ஆகும்.இதன் அணு எண் 3, அணு நிறை 6.94,அடர்த்தி 530 கிகி/கமீ, உருகு நிலையும் கொதி நிலையும் முறையே 453.2 K,1603 K ஆகும்.
வேதியல் இயல்புகள்[தொகு]
இலித்தியம் நீருடன் இலகுவில் தாக்கம் புரிந்து இலிதியம் ஐதரொக்சைட்டையும் ஐதரசன் வாயுவையும் உருவாக்கும். எனினும் இதன் தாக்கம் ஏனைய கார உலோகங்களின் அளவுக்கு வீரியமானதல்ல. இலிதியத்தை வளியில் திறந்து வைத்தால் கறுப்பு நிறப் படை உலோகத்துக்கு மேல் உருவாகும். இது இலிதியம் ஐதரொக்சைட்(LiOH + LiOH.H2O), இலிதியம் நைட்ரைட் (Li3N), இலிதியம் கார்பனேட்(Li2CO3) (இலிதியம் ஐதரொக்சைட்டும் காபனீரொக்சைட்டும் தாக்கமுறுவதால் தோன்றுவது.) ஆகிய சேர்மங்களின் கலவையாகும்.
இலித்தியத்தை நெருப்புச் சுவாலை மேல் பிடிக்கும் போது இலிதியத்தின் சேர்மங்கள் சிவப்பு நிறச் சுவாலையைக் கொடுக்கும்; பின்னர் இலிதியம் வெண்ணிறச் சுவாலையைக் கொடுக்கும்.
சாதாரண சூழ்நிலையில் நைதரசனுடன் தாக்கமடையும் ஒரே உலோகம் இலிதியம் ஆகும். இலிதியமும் மக்னீசியம் உலோகமும் மூலைவிட்டத் தொடர்பு கொண்டவையாகும். நைட்ரைட் உருவாக்கல், எரியும் போது ஒக்சைட்டுடன் (Li2O) பரஒக்சைட்டையும்(Li2O2) தோற்றுவித்தல், இவ்வுலோகங்களின் நைட்ரைட்டுகளும் கார்பனேற்றுகளும் வெப்பப்பிரிகை அடைதல் ஆகிய இயல்புகளில் மக்னீசியம் மற்றும் இலிதியம் ஒத்த இயல்பைக் காட்டுகின்றன. எனவே இவை மூலைவிட்டத் தொடர்பைக் கொண்டுள்ளன.
உயர் வெப்பநிலையில் ஐதரசனுடன் தாக்கமடைந்து இலிதியம் ஹைட்ரைட்ஐ (LiH) உருவாக்கும்.
பயன்கள்[தொகு]

கண்ணாடி மற்றும் செராமிக்[தொகு]
இலித்தியம், ஹைட்ரஜனுடன் கூடி,உடனடியாக இணைந்து இலித்தியம் ஹைட்ரைட் உண்டாகின்றது. இதை நீரிலிடும் போது அவை பிரிகின்றன.ஒரு கிலோ இலித்தியம் ஹைட்ரைட் 2800 லிட்டர் ஹைட்ரஜன் வளி மண்டல அழுத்தத்தில் அறை வெப்ப நிலையில் தருகிறது. ஹைட்ரஜன் அவசரத் தேவைக்கு உகந்த மூலமாக இதைக் கொள்கின்றனர். இலித்தியம் சேர்ந்த கண்ணாடி வெப்பத்தைக் கூடுதலாகத் தாக்குப் பிடிக்கின்றது. வெப்ப மண்டலங்களில் கட்டடங்களின் கட்டுமானப் பொருளாகவும் , வெப்பமானிகள் தொலைக்காட்சி பெட்டியின் சின்னத் திரை மற்றும் சூரிய ஒளி எதிரொளிப்பான் போன்றவற்றில் பயன்பாட்டுப் பொருளாகவும் இலித்தியம் கண்ணாடி பயன்தருகிறது.
மின்கருவிகள்[தொகு]
இலித்தியம் புளுரைடு படிகம் புறஊதாக் கதிர் உடுருவும் திறனை மிகைப் படுத்துகின்றது. புறஊதாக் கதிர் தொடர்பான ஆய்வுகளில் இது பயன்தருகிறது. இதயத் துடிப்புச் சீராக்கி (Pace Maker) போன்ற பல சாதனங்களுக்கு இலித்தியம் மின்கலம் (lithium cell) உதவுகிறது. இதில் நேர்மின் வாயாக இலித்தியமும் மின்னாற் பகுபொருளாக இலித்தியக் கூட்டுப் பொருளான இலித்தியம் புளூரைடு அல்லது அயோடைடு பயன்படுகின்றது. இதன் எதிர் மின்வாயாக கார்பன் மோனோ புளூரைடு அல்லது அயோடைடு செயல்படுகின்றது. இது 1.5-3.0 வோல்ட் மின்னழுத்தம் தரக்கூடியது. எனினும் இத்தகைய மின்கலத்தைப் புதிப்பித்துக் கொள்ள முடிவதில்லை. 40 பாகை செல்சியசுக்கு மேலும் - 20 பாகை செல்சியசுக்கு கீழும் இம் மின்கலத்தைப் பயன்படுத்த முடிவதில்லை.
உயவுப் பொருட்கள்[தொகு]
இலித்தியம் ஐதராக்சைடை ஒரு கொழுப்புப் பொருளுடன் சேர்த்து சூடு படுத்த இலித்தியம் சோப்பு கிடைக்கின்றது. இது எண்ணெயின் பாகுத் தன்மையை அதிகரிக்கின்றது. இதனால் கொழுப்புப் பசை (Grease) தயாரித்து உயவுப் பொருளாகப் பயன்படுத்த முடிகின்றது. இசுட்டியரேட்டு (stearate), பால்மிட்டேட்டு (Palmitate) போன்ற சில கரிம இலித்திய கூட்டுப் பொருட்கள் முதல் தரமான மசகுப் பொருட்களாக விளங்குகின்றன.
மாழைக் கலவை[தொகு]
மாழை அல்லது உலோகப் பரப்புகளை மெருகூட்டுவதற்கும், வண்ணப்பூச்சிடுவதற்கும், எனாமல் மற்றும் உயர் வகை பீங்கான் பொருட்களைத் தயாரிப்பதற்கும் நெசவுத் தொழிலில் துணிகளுக்கு வெண்மை யூட்டுவதற்கும், சாயங்களைக் கெட்டிப்படுத்துவதற்கும் இலித்தியக் கூட்டுப் பொருட்கள் பயன் படுகின்றன. அலுமினிய -இலித்தியக் கலப்பு மாழை தாழ்ந்த அடர்த்தியும் மிகுந்த உறுதியும் கொண்டது. இலேசாகவும், உறுதியாகவும் இருக்க வேண்டிய விண்கலம், வானவூர்தி, விண்ணூர்தி போன்றவற்றை வடிவமைக்க இது பயன்தருகிறது.[13] 50 % மக்னீசியத்துடன் இலித்தியம் சேர்ந்த ஒரு கலப்பு உலோகம் நீரில் மிதக்கின்றது அனால் இது காற்றிலுள்ள ஆக்சிசனைக் கவர்ந்து அரிக்கப்படுகின்றது. எனினும் ஒரு குறிப்பிட்ட நெடுக்கைக்கு உட்பட்ட விகிதத்தில் மக்னீசியத்தைச் சேர்க்கும் போது அது பழுதுறாமல் நீண்ட காலப்பணிக்கு உகந்ததாக இருக்கின்றது.
அலுமினிய உற்பத்தி முறையில் இலித்தியம் ஒரு வினையூக்கியாகச் செயல்படுகின்றது. மின்னாற்பகுப்புத் தொட்டியில் சிறிதளவு இலித்தியம் கூட்டுப் பொருளைச் சேர்க்கும் போது,அது அலுமினிய உற்பத்தியைக் குறிப்பிடும்படியாக அதிகரிக்கின்றது. தொட்டியின் வெப்ப நிலையைத்தாழ்வாக வைத்திருப்பதுடன், மின்சாரத்தையும் குறைந்த அளவிலும் எடுத்துக் கொள்கிறது.[13]
இலித்தியத்தின் மருத்துவப் பயன்கள்[தொகு]
இரத்தத்தில் யூரிக் அமில அதிகரிப்பு உடல் நலக் குறைவை ஏற்படுத்தும். இது முடக்கு வாதம் சிறுநீர்ப்பைக்கல், மன நோய், மன அழுத்தம் போன்ற குறைபாடுகளை ஏற்படுத்தும்.இதற்கு தூய இலித்தியம் கார்போனேட் டு மருந்தாக அளிக்கப் படுகின்றது.மனநலம் பாதிக்கப்பட்டு சித்தபிரமை பிடித்த நோயாளிகளுக்கான சிகிச்சை முறையில் இலித்தியம் கார்போனேட்டு பயன்படுகின்றது
இலித்தியத்தின் அணு இயற்பியல் பயன்கள்[தொகு]
ஒளிப்பொறிச் சிதறல் எண்ணி(Scintillation counter) களில் உடன் ஒளிர்வுப் பொருட்கள் (Phosphor) பயன்படுகின்றன. இதில் துத்தநாக சல்பைடு,பேரியம் பிளாட்டினோ சயனைடு போன்ற பொருட்களின் பூச்சுகள் பயன்படுத்தப் படுகின்றன. இவை கதிரியக்கக் கதிர்களுள் ஒன்றான ஆல்பா கதிர்களுக்குச் சிறப்பாகச் செயல்பட்டாலும், பீட்டா மற்றும் காமாக் கதிர்களுக்குப் பயனுறு திறன் குறைவாகப் பெற்றுள்ளன. தாலியம் கூடிய இலித்தியம் அயோடைடுப் படிகம் இக் குறைபாட்டை நீக்கியுள்ளது.

இலித்தியம் -6 என்ற அணு எண்மம்(Isotope) ஐதரசன் குண்டு தயாரிப்பில் முக்கியப் பங்கேற்றுள்ளது இது நொதுமியை (நியூட்ரானை) உள்வாங்கிக் கொள்ளும் தன்மை கொண்டதால், அதன் நிலைப்புத்தன்மைமை அணுக்கருவிற்குள் ஓரிரண்டு நொதுமிகளை (நியூட்ரான்கள) உட்புகுத்தி மாற்ற முடியும். நிலையற்ற தன்மையால் அது சிதைந்து ஈலியம் -4 ஆகவும் ஐதரசனின் கதிரியக்க அணு எண்மமான திரைட்டானாகவும் (triton) உருமாறுகின்றது. இது வெப்ப அணுக்கரு வினையில் முக்கிய மூலப் பொருளாக விளங்குகிறது.[14][15]
அணுக் கருப் பிளப்பு (Nuclear fission ) முறையை விட அணுக்கருப்பிணைவு முறை (Nuclear fusion) அனுகூலமிக்கது என்றாலும் அணுக்கள் தானாகப் பிணைந்து கொள்வதற்கான வெப்ப நிலை ஒரு மில்லியன் பாகை செல்சியஸ் என்ற நெடுக்கையில் உள்ளது. ஐதரசன் குண்டு தயாரிக்கும் வழி முறையில் எட்வர்டு டெல்லர் என்ற அறிவியலாளர் ஒரு புதுமையைப் புகுத்தினார். அவர் இலித்தியம் தியூட்ரைடு என்ற கூட்டுப் பொருளைப் பயன்படுத்தினார். அது குறைந்த வெளியில் அதிக அளவு தியூட்ரியத்தைப் பெற்றிருக்கின்றது. அத்திண்மத்தை நொதுமியின் (நியூட்ரானின்) வீச்சுக்கு உட்படுத்த, அதிலுள்ள இலித்தியம் நொதுமியை உட்கவர்ந்து அணுக்கரு வினையால் திரைட்டானை உருவாக்குகின்றது. அருகருகே உள்ள தியூட்ரானையும் திரைட்டானையும் பிணைக்கத் தேவையான வெப்பத்தை ஒரு வழக்கமான யுரேனிய அணு குண்டால் ஏற்படுத்திக் கொள்ள முடியும். யுரேனிய அணு குண்டில் நொதுமியின் (நியூட்ரானின்) செறிவை அதிகரிக்கும் போது அது பெருக்கமுற்று ஒரு கட்டத்தில் தானாக வெடிக்கின்றது. யுரேனிய அணு குண்டைச் சுற்றி இலித்தியம் தியூட்ரைடு படலத்தை ஏற்படுத்திக் கொண்டால், யுரேனியக் குண்டு வெடிக்கும் போது திரைட்டான் உற்பத்திக்குத் தேவையான நியூட்ரானை இலித்தியம்-6 க்கு வழங்குவதுடன் உற்பத்தி செய்யப்பட்ட திரைட்ரானும், தியூட்ரானும் பிணையத் தேவையான உயர் வெப்ப நிலையையும் தருகிறது.
அணு உலைகளில் நியூட்ரானின் எண்ணிக்கையை மட்டுப்படுத்தி கட்டுப்படுத்த காட்மியம் பயன் படுத்துகின்றார்கள். இதற்கு இலித்தியம்-6 ஒரு மாற்றுப் பொருளாகும். ஏவூர்திகளில் இலித்தியம் திண்ம எரிபொருளாகப் பயன்படுகிறது. இதன் எரிப்புறல்(Combustion ) ஒரு கிலோ கிராமுக்கு 10270 கிலோ காலரி. இதை விட பெரிலியம் மட்டுமே கூடுதலான எரிப்புறுமையைப் பெற்றுள்ளது .
விண் இயற்பியலும் இலித்தியமும்[தொகு]
விண்மீன்களின் வயதை மதிப்பிடும் ஒரு புதிய வழிமுறைக்கு இலித்தியம் கொடுத்துள்ளது. விண்மீன்களில் தொடக்க எரிபொருளாக இருப்பது ஐதரசன். ஐதரசனின் சேமிப்பு முழுவதும் தீர்ந்து போன நிலையில் அடுத்தடுத்த உயர் அணுவெண் அணுக்களும் வினையில் ஈடுபடுகின்றன. ஐதரசன் எரிதல் நிறை எல்லையில் இருக்கும் விண்மீன்களில் இலித்தியத்தின் செழுமை அதிகமாக இருக்கும் என எதிர்பார்க்கலாம். விண்மீன்களில் இலித்தியத்தின் செழுமையை அறிய நிறமாலையில் 6708 ஆம்ஸ்ட்ராம் (10^8m) அலை நீளத்தில் ஆராய்கின்றார்கள். இதன் ஒப்புச்செறிவிலிருந்து இலித்தியத்தின் செழுமையை மதிப்பிட முடியும். அதிலிருந்து விண்மீனின் வயதைக் கணக்கிட முடிகின்றது .
உற்பத்தி[தொகு]

இரண்டாம் உலகப் போரின் முடிவுக்குப் பின்னர் இலித்தியம் உற்பத்தியின் அளவு பெரிதும் அதிகரித்துள்ளது. எரிமலை வெடிப்பினால் உண்டான மற்ற தனிமங்களில் இருந்து இலித்தியம் உலோகம் பிரித்தெடுக்கப்படுகிறது. 55% இலித்தியம் குளோரைடும் 45% பொட்டாசியம் குளோரைடும் கலந்த கலவையை 450 பாகை செல்சியசு வெப்பநிலையில் மின்னாற்பகுப்புக்கு உட்படுத்தி ஈலியம் உற்பத்தி செய்யப்படுகிறது [16]. 2015 ஆம் ஆண்டு கணக்கெடுப்பின்படி உலகின் இலித்தியம் உற்பத்தியில் பெரும்பகுதி தென் அமெரிக்காவில் கிடைக்கிறது. அங்கு இலித்தியத்தைக் கொண்ட உப்புக்கரைசல் குளங்களின் நிலத்தடியிலிருந்து பிரித்தெடுக்கப்படுகிறது, மேலும் சூரிய ஆவியாக்கல் மூலம் அடர்விக்கப்படுகிறது. தரமான பிரித்தெடுத்தல் நுட்பம் வழியாக உப்பிலிருந்து நீரைப் ப்ரித்தெடுப்பது ஆகும். ஒவ்வொரு தொகுதியான தயாரிப்பு 18 முதல் 24 மாதங்கள் வரை ஆகும் [17]. 1998 இல் இலித்தியத்தின் விலை கிலோவுக்கு சுமார் 95 அமெரிக்க டாலர்கள் ஆகும் [18].
இலித்தியம் இருப்பு[தொகு]
உலக லித்தியம் இருப்புக்களின் துல்லியமான மதிப்பீட்டைக் கணக்கிடுவது கடினமாக இருந்தாலும்[19][20], அமெரிக்க புவியியல் ஆய்வு 2018 ஆம் ஆண்டு மதிப்பீட்டின்படி உலகளவில் கண்டறியப்பட்ட இலித்தியம் இருப்பு 16 மில்லியன் டன்களாக மதிப்பிடப்படுகிறது[21], இதற்கு கூறப்படும் ஒரே ஒரு காரணம் என்னவெனில் மிகுந்த இலித்தியம் வகைப்பாட்டு திட்டங்கள் திண்மநிலை தாது இருப்பை மையப்படுத்தியே உருவாக்கப்படுகின்றன, அதேசமயம் உப்புநீர் திரவமானது மாறுபட்ட செறிவுகள் மற்றும் உந்திசெலுத்தும் விளைவுகள் காரணமாக அதே வகைப்பாடு திட்டத்துடன் மதிப்பிடுவது சிக்கலானதாக இருக்கிறது[22]. உலகத்தில் 15 மில்லியன் டன் இலித்தியம் இருப்பு இருப்பதாக கணக்கிடப்பட்டுள்ளது. ஆனால் 65 மில்லியன் டன் இலித்தியம் இருப்பு இருக்கலாம் என்பதில் உண்மையும் இருக்கிறது. 75% இலித்தியம் இருப்பு 10 பெரிய படிவுகளாக காணப்படுவதாகக் கூறப்படுகிறது[23]. ஆறு உப்புநீர் ஊற்றுகள், இரண்டு தீப்பாறை வகை படிவுகள், இரண்டு படிவுப் பாறை படிவுகள் என மொத்தம் 83% இலித்திய இருப்பு உள்ளதாக மற்றொரு ஆய்வு முடிவு தெரிவிக்கிறது[24].
2016 ஆம் ஆண்டு அமெரிக்கப் புவியியல் கணக்கெடுப்பின் அடிப்படையில் உலகின் முதல் 3 லித்தியம் உற்பத்தி செய்யும் நாடுகள் பட்டியலில் ஆத்திரேரேலியா, சிலி மற்றும் அர்கெந்தினா நாடுகள் இடம் பிடிக்கின்றன [25]. சிலி, பொலிவியா, அர்கெந்தினா நாடுகளின் குறுக்குவெட்டு சந்திப்பு மண்டலம் இலித்திய முக்கோணம் என்று அழைக்கப்படுகிறது. இப்பிரதேசத்தில் கிடைக்கும் இலித்தியம் உயர் தரமானதாக இருக்கிறது. உலகில் இருப்பு இருப்பதாக நம்பப்படும் இலித்தியத்தில் 75% இம்முக்கோணத்தில்தான் இருக்கிறது. தென் அமெரிக்காவின் ஆண்டீசு மலைத் தொடர் பகுதியில் இலித்தியப் படிவுகள் காணப்படுவதாக அறியப்படுகிறது. இலித்தியம் உற்பத்தியில் சிலி முதலிடத்தையும் அதைத் தொடர்ந்து அர்கெந்தினா இரண்டாவது இடத்தையும் பிடிக்கின்றன. இவ்விரண்டு நாடுகளுமே இலித்தியத்தை உப்பு நீர் ஊற்றுகளில் இருந்தே பிரித்தெடுக்கின்றன. பொலிவிய பாலைவனத்திலும் 5.4 மில்லியன் டன் இலித்தியம் காணப்படுவதாக கூறப்படுகிறது [26][27].
அமெரிக்காவின் நெவிடாவில் உள்ள உப்புநீர் குளங்களில் இருந்து இலித்தியம் பிரித்தெடுக்கப்படுகிறது [28].ஆண்டீசு மலைத் தொடரின் மத்திய கிழக்கு சாய்வில் உள்ள பொலிவியா நாட்டில் உலகின் அறியப்பட்ட இருப்புக்களில் பெரும்பகுதி காணப்படுகின்றது. உப்புநீர் குளங்களிலிருந்து இலித்தியத்தைப் பிரித்தெடுப்பது தொடர்பாக பொலிவியா 2009 ஆம் ஆண்டில் சப்பான், பிரஞ்சு மற்றும் கொரிய நிறுவனங்களுடன் பேச்சுவார்த்தை நடத்தியது [26]. 2013 இல் கண்டுபிடிக்கப்பட்ட வயோமிங்சு படிவில் இலித்தியம் 228,000 டன்களைக் கொண்டுள்ளது எனக் கணக்கிடப்பட்டுள்ளது. அதே அமைப்பில் கூடுதல் வைப்புத்தொகை மேலும் 18 மில்லியன் டன் இருக்கலாம் எனவும் மதிப்பிடப்பட்டுள்ளது.
மேற்கோள்கள்[தொகு]
- ↑ 1.0 1.1 1.2 Krebs, Robert E. (2006). The History and Use of Our Earth's Chemical Elements : A Reference Guide. Westport, Conn.: Greenwood Press. பக். 47-50. பன்னாட்டுத் தரப்புத்தக எண்:0-313-33438-2. https://archive.org/details/historyuseofoure0000kreb.
- ↑ Kamienski et al. "Lithium and lithium compounds". Kirk-Othmer Encyclopedia of Chemical Technology. John Wiley & Sons, Inc. Published online 2004. எஆசு:10.1002/0471238961.1209200811011309.a01.pub2
- ↑ "Johan August Arfwedson". Periodic Table Live!. Archived from the original on 7 அக்டோபர் 2010. பார்க்கப்பட்ட நாள் 10 August 2009.
{{cite web}}: CS1 maint: unfit URL (link) - ↑ "Johan Arfwedson". Archived from the original on 5 ஜூன் 2008. பார்க்கப்பட்ட நாள் 10 August 2009.
{{cite web}}: Check date values in:|archivedate=(help) - ↑ 5.0 5.1 5.2 van der Krogt, Peter. "Lithium". Elementymology & Elements Multidict. பார்க்கப்பட்ட நாள் 2010-10-05.
- ↑ Per Enghag (2004). Encyclopedia of the Elements: Technical Data – History – Processing – Applications. Wiley. பக். 287–300. பன்னாட்டுத் தரப்புத்தக எண்:978-3-527-30666-4. https://archive.org/details/encyclopediaofel0000engh.
- ↑ Clark, Jim (2005). "Compounds of the Group 1 Elements". பார்க்கப்பட்ட நாள் 10 August 2009.
- ↑ Green, Thomas (11 June 2006). "Analysis of the Element Lithium". echeat.
- ↑ "Nitrogen, N2, Physical properties, safety, MSDS, enthalpy, material compatibility, gas liquid equilibrium, density, viscosity, inflammability, transport properties". Encyclopedia.airliquide.com. Archived from the original on 2011-07-21. பார்க்கப்பட்ட நாள் 2010-09-29.
- ↑ Krebs, Robert E. (2006). The history and use of our earth's chemical elements: a reference guide. Greenwood Publishing Group. பக். 47. பன்னாட்டுத் தரப்புத்தக எண்:0-313-33438-2. http://books.google.com/books?id=yb9xTj72vNAC&pg=PA47.
- ↑ Institute, American Geological; Union, American Geophysical; Society, Geochemical (1 January 1994). Geochemistry international. 31. p. 115. http://books.google.com/books?id=77McAQAAIAAJ.
- ↑ "XXIV.?On chemical analysis by spectrum-observations". Quarterly Journal of the Chemical Society of London 13 (3): 270. 1861. doi:10.1039/QJ8611300270.
- ↑ 13.0 13.1 Davis, Joseph R. ASM International. Handbook Committee (1993). Aluminum and aluminum alloys. ASM International. பக். 121–. பன்னாட்டுத் தரப்புத்தக எண்:978-0-87170-496-2. http://books.google.com/books?id=Lskj5k3PSIcC&pg=PA121. பார்த்த நாள்: 16 May 2011.
- ↑ Makhijani, Arjun and Yih, Katherine (2000). Nuclear Wastelands: A Global Guide to Nuclear Weapons Production and Its Health and Environmental Effects. MIT Press. பக். 59–60. பன்னாட்டுத் தரப்புத்தக எண்:0-262-63204-7. http://books.google.com/books?id=0oa1vikB3KwC&pg=PA60.
- ↑ National Research Council (U.S.). Committee on Separations Technology and Transmutation Systems (1996). Nuclear wastes: technologies for separations and transmutation. National Academies Press. பக். 278. பன்னாட்டுத் தரப்புத்தக எண்:0-309-05226-2. http://books.google.com/books?id=iRI7Cx2D4e4C&pg=PA278.
- ↑ Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ). Butterworth–Heinemann. பக். 73. பன்னாட்டுத் தரப்புத்தக எண்:0080379419.
- ↑ Martin, Richard (2015-06-08). "Quest to Mine Seawater for Lithium Advances". MIT Technology Review. பார்க்கப்பட்ட நாள் 2016-02-10.
- ↑ Ober, Joyce A. "Lithium" (PDF). United States Geological Survey. pp. 77–78. Archived from the original (PDF) on 11 சூலை 2007. பார்க்கப்பட்ட நாள் 19 ஆகத்து 2007.
- ↑ Jean-Marie Tarascon (2010). "Is lithium the new gold?". Nature Chemistry 2 (6): 510. doi:10.1038/nchem.680. பப்மெட்:20489722. Bibcode: 2010NatCh...2..510T.
- ↑ Lithium: The New California Gold Rush பரணிடப்பட்டது 29 சூலை 2017 at the வந்தவழி இயந்திரம், Forbes magazine. 2011-10-19
- ↑ Lithium Statistics and Information, U.S. Geological Survey, 2018, archived from the original on 3 March 2016, பார்க்கப்பட்ட நாள் 25 July 2002
- ↑ Houston, J.; Butcher, A.; Ehren, P.; Evans, K.; Godfrey, L. (2011). "The Evaluation of Brine Prospects and the Requirement for Modifications to Filing Standards". Economic Geology 106 (7): 1225–1239. doi:10.2113/econgeo.106.7.1225.
- ↑ Vikström, H.; Davidsson, S.; Höök, M. (2013). "Lithium availability and future production outlooks". Applied Energy 110 (10): 252–266. doi:10.1016/j.apenergy.2013.04.005 இம் மூலத்தில் இருந்து 11 October 2017 அன்று. பரணிடப்பட்டது.. https://web.archive.org/web/20171011182218/http://www.diva-portal.org/smash/record.jsf?pid=diva2:621281. பார்த்த நாள்: 11 October 2017.
- ↑ Grosjean, P.W.; Medina, P.A.; Keoleian, G.A.; Kesler, S.E.; Everson, M.P; Wallington, T.J. (2011). "Global Lithium Availability: A Constraint for Electric Vehicles?". Journal of Industrial Ecology 15 (5): 760–775. doi:10.1111/j.1530-9290.2011.00359.x.
- ↑ "8 Top Lithium-producing Countries". Commodity.com. December 14, 2017. பார்க்கப்பட்ட நாள் 2017-12-14.
- ↑ 26.0 26.1 Romero, Simon (2 February 2009). "In Bolivia, a Tight Grip on the Next Big Resource". The New York Times இம் மூலத்தில் இருந்து 1 July 2017 அன்று. பரணிடப்பட்டது.. https://web.archive.org/web/20170701054223/http://www.nytimes.com/2009/02/03/world/americas/03lithium.html?ref=world.
- ↑ "USGS Mineral Commodities Summaries 2009" (PDF). USGS. Archived from the original (PDF) on 14 சூன் 2010.
- ↑ Hammond, C. R. (2000). The Elements, in Handbook of Chemistry and Physics (81st ). CRC press. பன்னாட்டுத் தரப்புத்தக எண்:0-8493-0481-4. https://archive.org/details/crchandbookofche0000unse_u9i8.[page needed]
குறிப்புகள்[தொகு]
- ↑ Densities for all the gaseous elements can be obtained at Airliquide.com
புற இணைப்புகள்[தொகு]
- Lithium at The Periodic Table of Videos (University of Nottingham)
- International Lithium Alliance
- USGS: Lithium Statistics and Information
- Lithium Supply & Markets 2009 IM Conference 2009 Sustainable lithium supplies through 2020 in the face of sustainable market growth
- University of Southampton, Mountbatten Centre for International Studies, Nuclear History Working Paper No5.