போரான் டிரையாக்சைடு

| |
| |
| பெயர்கள் | |
|---|---|
| வேறு பெயர்கள்
போரான் ஆக்சைடு, டைபோரான் டிரையாக்சைடு, போரான் செசுகியுவாக்சைடு, போரிக் ஆக்சைடு, போரியா
போரிக் அமில நீரிலி | |
| இனங்காட்டிகள் | |
| 1303-86-2 | |
| ChEBI | CHEBI:30163 |
| ChemSpider | 452485 |
| EC number | 215-125-8 |
| யேமல் -3D படிமங்கள் | Image |
| பப்கெம் | 518682 |
| வே.ந.வி.ப எண் | ED7900000 |
SMILES
| |
| பண்புகள் | |
| B2O3 | |
| வாய்ப்பாட்டு எடை | 69.6182 கி/மோல் |
| தோற்றம் | வெண்மை,கண்ணாடி போன்ற திண்மம் |
| அடர்த்தி | 2.460 கி/செ.மீ3, நீர்மம்; 2.55 கி/செ.மீ 3, முக்கோணம்l; |
| உருகுநிலை | 450 °C (842 °F; 723 K) (முக்கோணம்) 510 °செ (நான்முகி) |
| கொதிநிலை | 1,860 °C (3,380 °F; 2,130 K) ,[1] sublimes at 1500 °C[2] |
| 1.1 கி/100மி.லி (10 °செ) 3.3 கி/100 மி.லி (20 °செ) 15.7 100 கி /100 மி.லி (100 °செ) | |
| கரைதிறன் | மெத்தனாலில் பகுதியாக கரையும் |
| காடித்தன்மை எண் (pKa) | ~ 4 |
| -39.0•10−6 செ.மீ3/மோல் | |
| வெப்பவேதியியல் | |
| Std enthalpy of formation ΔfH |
-1254 யூல்/மோல் |
| நியம மோலார் எந்திரோப்பி S |
80.8 யூல்/மோல் கெல்வின் |
| வெப்பக் கொண்மை, C | 66.9 யூல்/மோல் கெல்வின் |
| தீங்குகள் | |
| முதன்மையான தீநிகழ்தகவுகள் | எரிச்சலூட்டும்[3] |
| ஈயூ வகைப்பாடு | Repr. Cat. 2 |
| தீப்பற்றும் வெப்பநிலை | எரியாது |
| Lethal dose or concentration (LD, LC): | |
LD50 (Median dose)
|
3163 மி.கி/மீ (வாய்வழி, சுண்டெலி)[4] |
| அமெரிக்க சுகாதார ஏற்பு வரம்புகள்: | |
அனுமதிக்கத்தக்க வரம்பு
|
TWA 15 மி.கி/மீ3[3] |
பரிந்துரைக்கப்பட்ட வரம்பு
|
TWA 10 மி.கி/மீ3[3] |
உடனடி அபாயம்
|
2000 மி.கி/மீ3[3] |
மாறுதலாக ஏதும் சொல்லவில்லை என்றால் கொடுக்கப்பட்ட தரவுகள் யாவும் பொருள்கள் அவைகளின் இயல்பான வெப்ப அழுத்த நிலையில் (25°C, 100kPa) இருக்கும். | |
| | |
| Infobox references | |
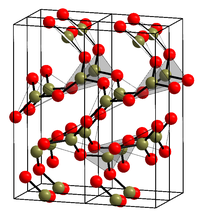
போரான் டிரையாக்சைடு (Boron trioxide) என்பது B2O3. என்ற மூலக்கூற்று வாய்ப்பாட்டால் விவரிக்கப்படும் ஒரு கனிம வேதியியல் சேர்மமாகும். டைபோரான் டிரையாக்சைடு, இருபோரான் மூவாக்சைடு என்ற பெயர்களாலும் போரானின் ஆக்சைடுகளில் ஒன்றான இது அழைக்கப்படுகிறது. வெள்ளை நிறத்தில் கண்ணாடி போல ஒரு திண்மமாக இது காணப்படுகிறது, படிக உருவமற்ற இச்சேர்மம் எப்போதும் கண்ணாடி பளபளப்பில் காணப்படுகிறது; இருப்பினும், விரிவான வெப்பமூட்டலுக்குப் பின்னர் போரான் டிரையாக்சைடை படிகமாக்கலாம்.
கண்ணாடி போரான் டிரையாக்சைடு அனேகமாக போராக்சால் வளையங்களால் ஆக்கப்பட்டிருக்கலாம். போராக்சல் என்பது மூன்று ஒருங்கிணைப்பு போரான் மற்றும் இரண்டு ஒருங்கிணைப்பு ஆக்சிசன் அணுக்களாலான ஆறு உறுப்பு வளையங்களாகும். பல போராக்சால் வளையங்களுடன் சரியான அடர்த்தியில் ஒழுங்கற்ற மாதிரிகளை உருவாக்குவதில் சிரமம் இருப்பதால், இந்த பார்வை ஆரம்பத்தில் சர்ச்சைக்குரியதாக இருந்தது. ஆனால் இதுபோன்ற மாதிரிகள் சமீபத்தில் கட்டமைக்கப்பட்டு, சோதனையுடன் சிறந்த உடன்பாட்டில் பண்புகளை வெளிப்படுத்துகின்றன [5]. கோட்பாட்டு மற்றும் பரிசோதனை முறை ஆய்வுகளில் இது தற்போது அங்கீகரிக்கப்பட்டுள்ளது [6][7][8][9][10]. இதன்படி கண்ணாடி போரான் டிரையாக்சைடிலுள்ள போராக்சால் வளையங்களுக்குச் சொந்தமான போரான் அணுக்களின் பின்னம் 0.73 மற்றும் 0.83 க்கு இடையில் எங்கோ உள்ளது, கிட்டத்தட்ட இதை 0.75 என்று மதிப்பிடலாம். வளையம் மற்றும் வளையமல்லாத அலகுகள் இடையே 1.1 விகிதம் உள்ளது என்றும் கருதலாம். அதிகரிக்கும் வெப்பநிலையுடன் திரவ நிலையில் போராக்சால் வளையங்களின் எண்ணிக்கை சிதைகிறது [11].
ஆல்பா நிலை படிக வடிவம் (α-B 2 O 3 ) பிரத்தியேகமாக BO 3 முக்கோணங்களால் ஆனது. இந்த முக்கோண, குவார்ட்சு போன்ற படிகக்கல் வலையமைப்பு 9.5 கிகாபாசுகல்கள் அழுத்தத்தில் ஒற்றைச் சாய்வு β-B 2 O 3 நிலைக்கு ஒரு கோயிசைட் கனிமம் போன்ற மாற்றத்திற்கு உட்படுகிறது.
தயாரிப்பு[தொகு]
போரான் டிரையாக்சைடை ஓர் இணைவு உலையில் கந்தக அமிலத்துடன் போராக்சை சேர்த்து வெப்பப்படுத்தல் மூலம் தயாரிக்கப்படுகிறது. 750° செல்சியசுக்கும் அதிகமான வெப்பநிலையில் உருகிய போரான் ஆக்சைடு அடுக்கு சோடியம் சல்பேட்டிலிருந்து பிரிகிறது. பின்னர் இது சிதைக்கப்பட்டு, குளிர்விக்கப்பட்டு 96-97 சதவீதம் தூய்மையாகப் பெறப்படுகிறது[2].
போரிக் அமிலத்தை ~300 °செல்சியசு வெப்பநிலைக்கு மேல் சூடாக்குவது மற்றொரு தயாரிப்பு முறையாகும். போரிக் அமிலம் முதலில் 170 பாகை செல்சியசு வெப்பநிலையில் நீராவியாகவும் (H2O(வாயு)) மெட்டாபோரிக் அமிலமாகவும் (HBO2) சிதைகிறது. மேலும் 300° செல்சியசு வெப்பநிலை வரை சூடுபடுத்தினால் அதிக நீராவியும் போரான் டிரையாக்சைடும் உருவாகும். வினைகள் கீழே கொடுக்கப்படுகின்றன:
- H3BO3 → HBO2 + H2O
- 2 HBO2 → B2O3 + H2O
போரிக் அமிலம் B2O3 வெப்பப்படுத்தப்பட்ட பாய்மநிலைப் படுகையில் நீரற்ற நுண்படிகமாக மாறுகிறது[12].
கவனமாக கட்டுப்படுத்தப்பட்ட வெப்ப விகிதம் நீர் வெளியாகும் சூழலை தவிர்க்கிறது. உருகிய போரான் ஆக்சைடு சிலிகேட்டுகளை தாக்குகிறது. உட்புற குழாய்கள் கிராபைட்டால் செய்யப்பட்ட காரணத்தால் அசிட்டிலீன் வெப்ப சிதைவை செயலற்றதாக்குகின்றன[13]
சுற்றுப்புற அழுத்தத்தில் உருகிய α-B2O3 இன் படிகமயமாக்கல் வலுவாக இயக்கவியல் ரீதியாக விரும்பப்படுவதில்லை. படிக உருவமற்ற திடப்பொருளின் படிகமயமாக்கலுக்கான நிலைமைகள் 10 கிலோபார் மற்றும் ~ 200° செல்சியசு வெப்பநிலை ஆகும் [14]. எதிர்வடிவமுள்ள இடக்குழுக்களில் அதன் முன்மொழியப்பட்ட படிக அமைப்பு P31(#144); P32(#145) ஆகும். (எ.கா:γ- கிளைசின்) இப்படிக அமைப்பின் திருத்தப்பட்ட வடிவம் P3121(#152); P3221(#154) (எ.கா. α-குவார்ட்சு) ஆகும்.
டைபோரேன் காற்றில் ஆக்சிசனுடன் வினைபுரிவதாலும் போரான் ஆக்சைடு உருவாகிறது.
- 2B2H6(g) + 3O2(g) → 2B2O3(s) + 6H2(g)
- B2H6(g) + 3H2O(g) → B2O3(s) + 6H2(g)[15]
பயன்கள்[தொகு]
கண்ணாடி மற்றும் பற்சிப்பிகள் பாய்ம முகவராக இது பயன்படுகிறது.
போரான் கார்பைடு போன்ற பிற போரான் சேர்மங்களை ஒருங்கிணைப்பதற்கான தொடக்கப் பொருள் இதுவாகும்
.
கண்ணாடி இழைகளில் பயன்படுத்தப்படும் ஒரு சேர்க்கைப் பொருள்.
போரோசிலிகேட்டு கண்ணாடி உற்பத்தியில் பகுதிக் கூறாகப் பயன்படுத்தப்படுகிறது.
கரிம தொகுப்பில் அமில வினையூக்கியாகப் பயன்படுகிறது.
மேற்கோள்கள்[தொகு]
- ↑ High temperature corrosion and materials chemistry: proceedings of the Per Kofstad Memorial Symposium. Proceedings of the Electrochemical Society. The Electrochemical Society. 2000. பக். 496. பன்னாட்டுத் தரப்புத்தக எண்:978-1-56677-261-7. https://books.google.com/books?id=ZrxSWmueNMQC&pg=PA496.
- ↑ 2.0 2.1 Patnaik, P. (2003). Handbook of Inorganic Chemical Compounds. McGraw-Hill. பக். 119. பன்னாட்டுத் தரப்புத்தக எண்:978-0-07-049439-8. https://books.google.com/books?id=Xqj-TTzkvTEC&pg=PA119. பார்த்த நாள்: 2009-06-06.
- ↑ 3.0 3.1 3.2 3.3 "NIOSH Pocket Guide to Chemical Hazards #0060". National Institute for Occupational Safety and Health (NIOSH).
- ↑ "Boron oxide". Immediately Dangerous to Life and Health. National Institute for Occupational Safety and Health (NIOSH).
- ↑ Ferlat, G.; Charpentier, T.; Seitsonen, A. P.; Takada, A.; Lazzeri, M.; Cormier, L.; Calas, G.; Mauri. F. (2008). "Boroxol Rings in Liquid and Vitreous B2O3 from First Principles". Phys. Rev. Lett. 101 (6): 065504. doi:10.1103/PhysRevLett.101.065504. பப்மெட்:18764473. Bibcode: 2008PhRvL.101f5504F.; Ferlat, G.; Seitsonen, A. P.; Lazzeri, M.; Mauri, F. (2012). "Hidden polymorphs drive vitrification in B2O3". Nature Materials Letters 11 (11): 925–929. doi:10.1038/NMAT3416. பப்மெட்:22941329. Bibcode: 2012NatMa..11..925F.
- ↑ Hung, I. (2009). "Determination of the bond-angle distribution in vitreous B2O3 by rotation (DOR) NMR spectroscopy". Journal of Solid State Chemistry 182 (9): 2402–2408. doi:10.1016/j.jssc.2009.06.025. Bibcode: 2009JSSCh.182.2402H.
- ↑ Soper, A. K. (2011). "Boroxol rings from diffraction data on vitreous boron trioxide". J. Phys.: Condens. Matter 23 (36): 365402. doi:10.1088/0953-8984/23/36/365402. பப்மெட்:21865633. Bibcode: 2011JPCM...23.5402S.
- ↑ Joo, C. (2000). "The ring structure of boron trioxide glass". Journal of Non-Crystalline Solids 261 (1–3): 282–286. doi:10.1016/s0022-3093(99)00609-2. Bibcode: 2000JNCS..261..282J.
- ↑ Zwanziger, J. W. (2005). "The NMR response of boroxol rings: a density functional theory study". Solid State Nuclear Magnetic Resonance 27 (1–2): 5–9. doi:10.1016/j.ssnmr.2004.08.004. பப்மெட்:15589722.
- ↑ Micoulaut, M. (1997). "The structure of vitreous B2O3 obtained from a thermostatistical model of agglomeration". Journal of Molecular Liquids 71 (2–3): 107–114. doi:10.1016/s0167-7322(97)00003-2.
- ↑ Alderman, O. L. G. Ferlat, G. Baroni, A. Salanne, M. Micoulaut, M. Benmore, C. J. Lin, A. Tamalonis, A. Weber, J. K. R. (2015). "Liquid B2O3 up to 1700K: X-ray diffraction and boroxol ring dissolution". Journal of Physics: Condensed Matter 27 (45): 455104. doi:10.1088/0953-8984/27/45/455104. பப்மெட்:26499978.
- ↑ Kocakuşak, S.; Akçay, K.; Ayok, T.; Koöroğlu, H. J.; Koral, M.; Savaşçi, Ö. T.; Tolun, R. (1996). "Production of anhydrous, crystalline boron oxide in fluidized bed reactor". Chemical Engineering and Processing 35 (4): 311–317. doi:10.1016/0255-2701(95)04142-7.
- ↑ Morelock, C. R. (1961). Research Laboratory Report #61-RL-2672M. General Electric.
- ↑ Aziz, M. J.; Nygren, E.; Hays, J. F.; Turnbull, D. (1985). "Crystal Growth Kinetics of Boron Oxide Under Pressure". Journal of Applied Physics 57 (6): 2233. doi:10.1063/1.334368. Bibcode: 1985JAP....57.2233A. http://dash.harvard.edu/handle/1/3645198.
- ↑ AirProducts (2011). Diborane Storage & Delivery. http://www.airproducts.com/~/media/downloads/other/D/en-diborane-electronics-technical-bulletin.pdf. பார்த்த நாள்: 2013-08-21.
