பொட்டாசியம் அசைடு
|
| |||
| |||
| பெயர்கள் | |||
|---|---|---|---|
| ஐயூபிஏசி பெயர்
பொட்டாசியம் அசைடு
| |||
| இனங்காட்டிகள் | |||
| 20762-60-1 | |||
InChI
| |||
| யேமல் -3D படிமங்கள் | Image | ||
| பப்கெம் | 10290740 | ||
SMILES
| |||
| பண்புகள் | |||
| KN 3 | |||
| வாய்ப்பாட்டு எடை | 81.1184 கி/மோல் | ||
| தோற்றம் | நிறமற்ற படிகங்கள்[1] | ||
| அடர்த்தி | 2.038 கி/செ.மீ3 [1] | ||
| உருகுநிலை | 350 °C (662 °F; 623 K) (in vacuum)[1] | ||
| கொதிநிலை | சிதைவடையும் | ||
| 41.4 கி/100 மி,லி (0 °செ) 50.8 கி/100 மி.லி (20 °செ) 105.7 கி/100 மி.லி (100 °செ) | |||
| கரைதிறன் | எத்தனாலில் கரையும் ஈதரில் கரையாது | ||
| வெப்பவேதியியல் | |||
| Std enthalpy of formation ΔfH |
-1.7 கியூ/மோல் | ||
| தீங்குகள் | |||
| முதன்மையான தீநிகழ்தகவுகள் | அதிக நச்சு, அதிகமாக சூடாக்கினால் வெடிக்கும் | ||
| Lethal dose or concentration (LD, LC): | |||
LD50 (Median dose)
|
27 மி.கி/கி.கி (வாய்வழி, எலி)[2] | ||
| தொடர்புடைய சேர்மங்கள் | |||
| ஏனைய நேர் மின்அயனிகள் | சோடியம் அசைடு, தாமிர(II) அசைடு, ஈய(II)அசைடு, வெள்ளி அசைடு | ||
மாறுதலாக ஏதும் சொல்லவில்லை என்றால் கொடுக்கப்பட்ட தரவுகள் யாவும் பொருள்கள் அவைகளின் இயல்பான வெப்ப அழுத்த நிலையில் (25°C, 100kPa) இருக்கும். | |||
| | |||
| Infobox references | |||
பொட்டாசியம் அசைடு (Potassium azide) என்பது KN3 என்ற மூலக்கூற்று வாய்ப்பாடு கொண்ட ஒரு கனிம வேதியல் சேர்மம் ஆகும். வெண்மை நிறத்தில் காணப்படும் இச்சேர்மம் தண்ணீரில் கரைகிறது. ஆய்வுக்கூடங்களில் வினைப்பொருளாகப் பயன்படுத்தப்படுகிறது. மண்ணில் நைட்ரசன் ஏற்றத்தை தடுக்கும் வேதிப்பொருளாக விளங்குகிறது[3].
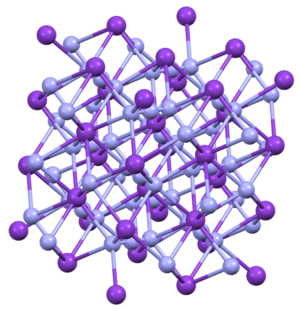
அமைப்பு[தொகு]
KN3, RbN3, CsN3, மற்றும் TlN3 ஆகிய சேர்மங்கள் யாவும் ஒரே வகையான நாற்கோண மூலக்கூற்று [4]அமைப்பிலேயே படிகமாகின்றன. அசைடானது நேரெதிரான மறைக்கப்பட்ட திசையமைவுகளில் எட்டு நேர்அயனிகளுடன் பிணைக்கப்பட்டுள்ளது. இந்நேர் அயனிகள் விளிம்புநிலை எட்டு நைட்ரசன் மையங்களுடன் பிணைக்கப்பட்டுள்ளன[5].

தயாரிப்பு மற்றும் வினைகள்[தொகு]
பொட்டாசியம் கார்பனேட்டை அவ்விடத்தில்[6] உருவான ஐதரசோயிக் அமிலத்துடன் சேர்த்து வினைப்படுத்துவதால் பொட்டாசியம் அசைடு தயாரிக்கலாம். மாறாக இதனையொத்த சோடியம் அசைடோ விசுலைசெனசு செயல்முறையில் சோடியம் அசைடையும் நைட்ரசு ஆக்சைடையும் சேர்த்து தயாரிக்கப்படுகிறது[7] .
சூடுபடுத்தும் போது அல்லது புற ஊதாக்கதிர் கதிர்வீச்சுக்கு உட்படுத்தும் போது பொட்டாசியம் உலோகமாகவும் நைட்ரசன் வாயுவாகவும் சிதைவடைகிறது[8] . கார உலோக அசைடுகள் சிதைவடையும் வெப்ப அளவுகள் வருமாறு: NaN3 (275 °செ), KN3 (355 °செ), RbN3 (395 °செ), CsN3 (390 °செ).[9]
தீங்குகள்[தொகு]
சோடியம் அசைடு போலவே பொட்டாசியம் அசைடும் நச்சுத்தன்மை மிக்கது ஆகும். இதனுடன் தொடர்புடைய சோடியம் அசைடின் அதிகபட்ச அடர்த்தி ஏற்பு மதிப்பு மில்லியன் பகுதிகளுக்கு 0.07 பகுதிகளாகும். அசைடுகளின் நச்சுத்தன்மை அவற்றின் சைட்டோகுரோம் ஆக்சிடேசு எதிர்ப்பில் இருந்து தோன்றுகின்றன.
மேற்கோள்கள்[தொகு]
- ↑ 1.0 1.1 1.2 Dale L. Perry; Sidney L. Phillips (1995). Handbook of inorganic compounds. CRC Press. பக். 301. பன்னாட்டுத் தரப்புத்தக எண்:0-8493-8671-3. https://archive.org/details/handbookofinorga0000unse.
- ↑ http://chem.sis.nlm.nih.gov/chemidplus/rn/20762-60-1
- ↑ T. D. Hughes; L. F. Welch (1970). "Potassium Azide as a Nitrification Inhibitor". Agronomy Journal (American Society of Agronomy) 62: 595–599. doi:10.2134/agronj1970.00021962006200050013x.
- ↑ Khilji, M. Y.; Sherman, W. F.; Wilkinson, G. R. (1982). "Variable temperature and pressure Raman spectra of potassium azide KN
3". Journal of Raman Spectroscopy 12 (3): 300–303. doi:10.1002/jrs.1250120319. Bibcode: 1982JRSp...12..300K. https://archive.org/details/sim_journal-of-raman-spectroscopy_1982-06_12_3/page/300. - ↑ Ulrich Müller "Verfeinerung der Kristallstrukturen von KN3, RbN3, CsN3 und TIN3" Zeitschrift für anorganische und allgemeine Chemie 1972, Volume 392, 159–166. எஆசு:10.1002/zaac.19723920207
- ↑ P. W. Schenk "Alkali Azides from Carbonates" in Handbook of Preparative Inorganic Chemistry, 2nd Ed. Edited by G. Brauer, Academic Press, 1963, NY. Vol. 1. p. 475.
- ↑ Horst H. Jobelius, Hans-Dieter Scharff "Hydrazoic Acid and Azides" in Ullmann's Encyclopedia of Industrial Chemistry, 2005, Wiley-VCH, Weinheim. எஆசு:10.1002/14356007.a13_193
- ↑ Tompkins, F. C.; Young, D. A. (1982). "The Photochemical and Thermal Formation of Colour Centres in Potassium Azide Crystals". Proceedings of the Royal Society of London. Series A, Mathematical and Physical Sciences 236 (1204): 10–23.
- ↑ E. Dönges "Alkali Metals" in Handbook of Preparative Inorganic Chemistry, 2nd Ed. Edited by G. Brauer, Academic Press, 1963, NY. Vol. 1. p. 475.


