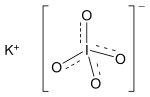
பொட்டாசியம் பெர் அயோடேட்டு
| |

| |
| பெயர்கள் | |
|---|---|
| ஐயூபிஏசி பெயர்
பொட்டசியம் அயோடேட்டு
| |
| வேறு பெயர்கள்
பொட்டாசியம் மெட்டாபெ அயோடேட்டு
| |
| இனங்காட்டிகள் | |
| 7790-21-8 | |
| ChemSpider | 128877 |
| EC number | 232-196-0 |
| யேமல் -3D படிமங்கள் | Image |
| பப்கெம் | 516896 |
SMILES
| |
| பண்புகள் | |
| KIO4 | |
| வாய்ப்பாட்டு எடை | 230.00 கி மோல்−1 |
| தோற்றம் | வெண் படிகத்தூள் |
| மணம் | நெடியற்றது |
| அடர்த்தி | 3.618 கி/செ.மீ3 |
| உருகுநிலை | 582 °C (1,080 °F; 855 K) (சிதைவடையும்) |
| 0.17 கி/100 மி.லி (0 °செ) 0.42 கி/100 மி.லி (20 °செ) 4.44 கி/100 மி.லி (80 °செ) 7.87 கி/100 மி.லி (100 °செ) | |
| கட்டமைப்பு | |
| படிக அமைப்பு | நாற்கோணகம் |
| தீங்குகள் | |
| முதன்மையான தீநிகழ்தகவுகள் | ஆக்சிசனேற்றி |
| பொருள் பாதுகாப்பு குறிப்பு தாள் | External MSDS |
| தொடர்புடைய சேர்மங்கள் | |
| ஏனைய எதிர் மின்னயனிகள் | பொட்டாசியம் அயோடேட்டு பொட்டசியம் அயோடைட்டு |
| ஏனைய நேர் மின்அயனிகள் | சோடியம் பெர் அயோடேட்டு |
மாறுதலாக ஏதும் சொல்லவில்லை என்றால் கொடுக்கப்பட்ட தரவுகள் யாவும் பொருள்கள் அவைகளின் இயல்பான வெப்ப அழுத்த நிலையில் (25°C, 100kPa) இருக்கும். | |
| | |
| Infobox references | |
பொட்டாசியம் பெர் அயோடேட்டு (Potassium periodate ) என்பது KIO4 என்ற மூலக்கூற்று வாய்ப்பாடு கொண்ட ஒரு கனிம வேதியியல் சேர்மமாகும். பொட்டாசியம் நேர்மின் அயனிகளும் பெர் அயோடேட்டு எதிர்மின் அயனிகளும் சேர்ந்து இச்சேர்மத்தை உருவாக்குகின்றன. பெர் அயோடிக் அமிலத்தின் பொட்டாசியம் உப்பாக இச்சேர்மம் கருதப்படுகிறது. சோடியம் பெர் அயோடேட்டு, பெர் அயோடிக் அமிலம் போன்ற பொதுவான பெர் அயோடேட்டு போல அல்லாமல் இது சிற்றுறுதி நிலை வடிவிலேயே கிடைக்கிறது. இதனுடன் தொடர்புடைய பொட்டாசியம் ஆர்த்தோ பெர் அயோடேட்டு எதுவும் கண்டறியப்படவில்லை.
தயாரிப்பு[தொகு]
பொட்டாசியம் அயோடேட்டின் நீர்த்த கரைசலை குளோரின் மற்றும் பொட்டாசியம் ஐதாரக்சைடைப் பயன்படுத்தி ஆக்சிசனேற்றம் செய்து இதைத் தயாஎஇக்கிறார்கள் [1].
KIO3 + Cl2 + 2 KOH → KIO4 + 2 KCl + H2O
பொட்டாசியம் அயோடேட்டை மின்வேதியியல் முறையில் ஆக்சிசனேற்றம் செய்தும் இதைத் தயாரிக்கலாம். இருப்பினும் பொட்டாசியம் குளோரேட்டின் குறைவான கரைதிறன் காரணமாக இப்பயன்பாடு குறைந்த அளவிலேயே காணப்படுகிறது.
வேதிப் பண்புகள்[தொகு]
பொட்டாசியம் பெர் அயோடேட்டு 582 ° செல்சியசு வெப்பநிலையில் சிதைவடைந்து பொட்டசியம் அயோடேட்டு மற்றும் ஆக்சிசனைக் கொடுக்கிறது.
KIO4 இன் குறைந்த கரைதிறன் பொட்டாசியம் மற்றும் சீரியம் தனிமங்களை உறுதிபடுத்தலுக்கு பயன்படுகிறது. தண்ணீரில் சிறிதளவு கரைந்து அதிகமான எதிர்மின் அயனிகளைத் தருகிறது. இக்கரைசல் சிறிதளவு காரத்தன்மை கொண்ட கரைசலாகச் செயல்படுகிறது. வினையூக்கியாக மாங்கனீசு(IV) ஆக்சைடுடன் சேர்த்து சூடுபடுத்தினால் இது பொட்டாசியம் அயோடேட்டு மற்றும் ஆக்சிசனாக சிதைவடைகிறது.
சீலைட்டு வகை நாற்கோண படிகங்களாக KIO4 உருவாகிறது (இடக்குழு I41/a) [2]. .
மேற்கோள்கள்[தொகு]
- ↑ Riley, edited by Georg Brauer ; translated by Scripta Technica, Inc. Translation editor Reed F. (1963). Handbook of preparative inorganic chemistry. Volume 1 (2nd ). New York, N.Y.: Academic Press. பக். 325. பன்னாட்டுத் தரப்புத்தக எண்:978-0121266011.
- ↑ Al-Dhahir, T.A.; Dhanaraj, G.; Bhat, H.L. (June 1992). "Growth of alkali metal periodates from silica gel and their characterization". Journal of Crystal Growth 121 (1-2): 132–140. doi:10.1016/0022-0248(92)90182-I. https://archive.org/details/sim_journal-of-crystal-growth_1992-06_121_1-2/page/132.
