வனேடியம் நாற்குளோரைடு
| |
| பெயர்கள் | |
|---|---|
| ஐயூபிஏசி பெயர்s
வனேடியம் டெட்ராகுளோரைடு
வனேடியம்(IV) குளோரைடு | |
| இனங்காட்டிகள் | |
| 7632-51-1 | |
| ChemSpider | 19956660 |
| EC number | 231-561-1 |
| யேமல் -3D படிமங்கள் | Image |
| பப்கெம் | 24273 |
| வே.ந.வி.ப எண் | YW2625000 |
| |
| பண்புகள் | |
| VCl4 | |
| வாய்ப்பாட்டு எடை | 192.75 கி/மோல் |
| தோற்றம் | அடர்சிவப்பு நிறத்திரவம், ஈரத்தால் பாதிக்கப்படும் |
| மணம் | காரநெடி |
| அடர்த்தி | 1.816 கி/செ.மீ3, திரவம் |
| உருகுநிலை | −24.5 °C (−12.1 °F; 248.7 K) |
| கொதிநிலை | 148 °C (298 °F; 421 K) |
| சிதைவடையும் | |
| கரைதிறன் | ஈதர், எத்தனால் கரைப்பான்களில் கரையும் |
| ஆவியமுக்கம் | 7.9 Pa |
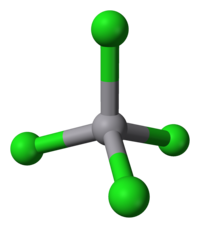
| கட்டமைப்பு | |
| ஒருங்கிணைவு வடிவியல் |
நான்முகம் |
| இருமுனைத் திருப்புமை (Dipole moment) | 0 D |
| தீங்குகள் | |
| முதன்மையான தீநிகழ்தகவுகள் | ஆக்சிகரணி; நீராற்பகுப்பால் HCl வயுவை வெளியிடுகிறது. |
| Lethal dose or concentration (LD, LC): | |
LD50 (Median dose)
|
160 மி.கி/கி.கி (எலி,வாய்வழி) |
| தொடர்புடைய சேர்மங்கள் | |
| ஏனைய எதிர் மின்னயனிகள் | வனேடியம் நான்குபுளோரைடு, வனேடியம் இருசல்பைடு, வனேடியம் நான்குபுரோமைடு |
| ஏனைய நேர் மின்அயனிகள் | தைட்டானியம் நாற்குளோரைடு, குரோமியம் நாற்குளோரைடு, நையோபியம் நாற்குளோரைடு, டாண்ட்டலம் நாற்குளோரைடு |
மாறுதலாக ஏதும் சொல்லவில்லை என்றால் கொடுக்கப்பட்ட தரவுகள் யாவும் பொருள்கள் அவைகளின் இயல்பான வெப்ப அழுத்த நிலையில் (25°C, 100kPa) இருக்கும். | |
வனேடியம் நாற்குளோரைடு (Vanadium tetrachloride) என்பது VCl4 என்ற மூலக்கூற்று வாய்ப்பாடு கொண்ட ஒரு கனிம வேதியியல் சேர்மமாகும். அடர் சிவப்பு நிறத்தில் உள்ள இத்திரவம் மற்ற வனேடியம் சேர்மங்களைத் தயாரிப்பதற்கு உதவும் ஒரு பயனுள்ள வினைப்பொருளாக உள்ளது.
தயாரிப்பு மற்றும் பண்புகள்
[தொகு]எதிர்காந்தத் தன்மையுள்ள TiCl4 சேர்மத்தைவிட கூடுதலாக ஒரு இணைதிறன் எலக்ட்ரானைப் பெற்று இணைக்காந்த பண்பு கொண்ட திரவமாக வனேடியம் நாற்குளோரைடு உள்ளது. அறை வெப்பநிலையில் இணைக்காந்தப் பண்பு கொண்டுள்ள மிகச்சில சேர்மங்களில் இதுவும் ஒன்றாகும்.
வனேடியம் உலோகத்தை குளோரினேற்றம் செய்து வனேடியம் நாற்குளோரைடு தயாரிக்க முடியும். இவ்வினையில் VCl5 உருவாவதில்லை. ஆக்சிசனேற்றும் திறன் பற்றாக்குறை காரணமாக குளோரினால் வனேடியம் நாற்குளோரைடை தாக்க முடிவதில்லை.
மாறாக NbCl5 மற்றும் TaCl5 போன்ற கனமான இதனையொத்த சேர்மங்கள் நிலைப்புத் தன்மையுடனும் குறிப்பாக ஆக்சிசனேற்றப் பண்பு இல்லாமலும் இருக்கின்றன. இயல்பாக உள்ள VF5 சேர்மத்தில் குளோரினுடன் ஒப்பிடுகையில் புளோரினின் ஆக்சிசனேற்றும் பண்பு மிகுந்துள்ளது. சாதாராண அழுத்தத்தில், வனேடியம் நாற்குளோரைடானது அதன் கொதிநிலையில் குளோரினை வெளியேற்றி வனேடியம்(III) குளோரைடைத் தருகிறது என்பதை இதனுடைய ஆக்சிசனேற்றத் திறன் குறிப்பாகத் தெரிவிக்கிறது.
வினைகள்
[தொகு]இதனுடைய உயர் ஆக்சிசனேற்றத் திறனுக்கு இசைவாக இது 50 ° செ வெப்பநிலையில் ஐதரசன் புரோமைடுடன் வினைபுரிந்து வனேடியம் முப்புரோமைடை உருவாக்குகிறது. இவ்வினை VBr
4 உருவாதல் வழியாக நிகழ்கிறது. அறை வெப்பநிலைக்கு சூடாக்கும் போது VBr4 புரோமினை வெளியேற்றுகிறது.[1]
- 2 VCl4 + 8 HBr → 2 VBr3 + 8 HCl + Br2
VCl4பல வழங்கு ஈனிகளுடன் வினைபுரிந்து கூட்டு விளை பொருட்களைத் தருகிறது. உதாரணம்: VCl4(THF)2. வனேடோசீன் இருகுளோரைடு தயாரிப்பதற்கான முன்னோடிச் சேர்மமாகவும் இது இருக்கிறது.
பயன்கள்
[தொகு]ஆல்க்கீன்களின் பல்லுறுப்பியாக்கும் வினையில், குறிப்பாக இரப்பர் தொழிலில் வனேடியம் நாற்குளோரைடு வினையூக்கியாகச் செயல்படுகிறது. வனேடியம் ஆல்க்கைல்களின் இடைநிலைப்பட்ட பண்புடன் நிகழும் சீக்ளர்- நட்டா வினையூக்கியுடன் இவ்வினை தொடர்புடையது ஆகும்
கரிம வேதியியல்
[தொகு]கரிம வேதியியல் தொகுப்பு வினைகளில் வனேடியம் நாற்குளோரைடு இணைப்பு பீனால்களாகப் பயன்படுத்தப்படுகிறது. உதாரணமாக, இது பீனாலை 4,4'- இருபீனாலாக மாற்றுகிறது[2]. இப்பீனால் மூன்று படிநிலைகளில் VCl3 ஆகக் ஒடுக்கப்படுகிறது.
- 2 C6H5OH + 2 VCl4 → HOC6H4–C6H4OH + 2 VCl3 + 2 HCl
இவ்வினை VCl4, இன் ஆக்சிசனேற்றும் திறனை உயர்த்திக் காட்டுகிறது.
பதுகாப்பு நடவடிக்கை
[தொகு]VCl4 துரிதமாக ஆவியாகும். தீவிரமான ஆக்சிகரணியாக இருப்பதால் உடனடியாக நீராற்பகுக்கப்பட்டு ஐதரசன் குளோரடை வெளிவிடுகிறது.
மேற்கோள்கள்
[தொகு]- ↑ Calderazzo, F.; Maichle-Mossmer, C.; Pampaloni, G. and Strähle, J. (1993). "Low-temperature Syntheses of Vanadium(III) and Molybdenum(IV) Bromides by Halide Exchange". Dalton Transactions: 655–8. doi:10.1039/DT9930000655.
- ↑ M. K. O’Brien, B. Vanasse, “Vanadium(IV) Chloride” in Encyclopedia of Reagents for Organic Synthesis (Ed: L. Paquette) 2004, J. Wiley & Sons, New York.
