ஆல்க்கீன்

கரிம வேதியியலில் ஆல்க்கீன் (alkene), ஒலிபீன் (olefine), ஒலிபைன் (olefine), அல்லது மதுக்கணுகம் என்பது ஒரு நிறைவுறாத வேதியியல் சேர்மம் ஆகும். இது குறைந்தது ஒரு கரிமம்–கரிமம் இரட்டைப் பிணைப்பைக் கொண்டிருக்கும். ஆல்கீன்கள் கரிம-கரிம இரட்டைப் பிணைப்பை வினைத் தொகுதியாகக் கொண்ட நீரகக்கரிமம் (ஐதரோகார்பன்) ஆகும். இவை இயற்கையில் தாராளமாகக் கிடைக்கின்றன.[1] ஒரே ஒரு இரட்டைப் பிணைப்பைக் கொண்டு வேறு எந்த செயல்படு தொகுதியும், இல்லாத எளிய வளையமில்லா ஆல்கீன்கள் ஒற்றை-ஈன்கள் (mono-enes) எனப்படுகின்றன. இவை படிவரிசை ஐதரோகார்பன் சேர்மங்களைத் தருகின்றன. இப்படிவரிசை ஆல்கீன்களின் பொது வாய்ப்பாடு CnH2n ஆகும்.[2]. ஆல்கீன்கள் அவற்றோடு தொடர்புடைய ஆல்க்கேன்களை விட இரண்டு ஐதரசன் அணுக்களைக் குறைவாகப் பெற்றுள்ளன (ஆனால் கார்பன் அணுக்களின் எண்ணிக்கை சமமாக இருக்கும்).
மிக எளிய ஆல்கீனுக்கு எடுத்துக்காட்டு எத்திலீன் (C2H4) ஆகும். இதன் ஐயுபிஏசி பெயர் எத்தீன். ஆல்கீன்களை ஒலிபீன்கள் என்றும் (குறிப்பாக எரியெண்ணெய், வேதியியல் தொழில் நிறுவனங்கள்) அழைக்கின்றனர். நறுமண சேர்மங்களான வளைய ஆல்கீன்கள் கட்டமைப்பு மற்றும் பண்புகளில் மாறுபட்டிருப்பதால் அவை ஆல்கீன்களாக கருதப்படுவதில்லை.[2]
அமைப்பு[தொகு]
பிணைப்பு[தொகு]

ஒற்றை சகப் பிணைப்புகள் போலவே, இரட்டைப் பிணைப்புகளையும் அணு ஒழுக்கல்கள் மேற்பொருந்துவதால் உருவாகும் அணுக்களுக்கிடைப்பட்ட பிணைப்பு என்று விவரிக்க முடியும். ஆனால், ஒற்றை சகப் பிணைப்பிலுள்ளது போல ஒரு சிக்மா பிணைப்பை மட்டும் கொண்டில்லாமல் இரட்டைப் பிணைப்பு ஒரு சிக்மா பிணைப்பையும் ஒரு பை பிணைப்பையும் கொண்டுள்ளது. இத்தகைய இரட்டைப் பிணைப்பு ஒற்றை சகப்பிணைப்பை விட வலுவானது. (C=C இரட்டைப் பிணைப்பிற்கு 611கிலோயூல்/மோல், C–C ஒற்றைப் பிணைப்பிற்கு 347 கிலோயூல்/மோல்)[1], மேலும் சராசரியாக 1.33 ஆங்ஸ்டிராம் (133 பீக்கோமீட்டர்) அளவிற்கு பிணைப்பின் நீளமும் குறைவாக உள்ளது.
இரட்டை பிணைப்பில் உள்ள ஒவ்வொரு கார்பன் அணுவும் அதன் மூன்று sp² கலப்பின ஒழுக்குகளையும் (orbitals) பயன்படுத்தி மூன்று அணுக்களுக்கும் சிக்மா பிணைப்பை உருவாக்கிக் கொள்கின்றன. இம்மூன்று sp² கலப்பின ஆர்பிட்டால்களின் அச்சுகளால் உருவான சமதளத்திற்கு செங்குத்தாக உள்ள கலப்பற்ற 2p அணு ஒழுக்குகள் இணைந்து பை பிணைப்பு உருவாகிறது. இந்த பை பிணைப்பின் ஒரு பாதி பிரதான C-C அச்சின் ஒரு பக்கத்திலும் மறுபாதி மற்றொரு பக்கத்திலுமாக வெளிப்பகுதியில் அமைந்துள்ளது,
பை பிணைப்பு உடைத்தலுக்கு அதிக அளவிலான ஆற்றல் தேவைப்படுகிறது. (எத்திலீனில் 264 கிலோ யூல்/மோல்) இத்தகைய உடைத்தலில் கார்பன், கார்பன் இரட்டைப் பிணைப்பு பங்கேற்பதால் அதன் சுழற்சி கட்டுப்படுத்தப்படுகிறது. இதன் விளைவாக, சிஸ் அல்லது டிரான்ஸ் என்ற இரண்டு சமபகுதியங்களும் (ஐசோமெர்) ஒன்றாக இருக்கவும் வாய்ப்பு இருக்கிறது. E-Z குறியீட்டைப் பயன்படுத்தி பெயரிடப்பட்ட மிகவும் சிக்கலான ஆல்க்கீன்கள் மூன்று அல்லது நான்கு வெவ்வேறு மாற்றுகள் (பக்க குழுக்கள்) கொண்ட மூலக்கூறுகளைப் பற்றி விவரிக்கப் பயன்படுகிறது. எடுத்துக்காட்டாக, பியூட்டினின் (Z)-பியூட்-2- ஈன் (சிஸ்-2- பியூட்டீன்) சமபகுதியங்களில் உள்ள இரண்டு மீத்தைல் தொகுதிகளும் இரட்டைப்பிணைப்பின் ஒரேபக்கத்தை நோக்கியவாறு உள்ளன. மற்றும் (E)- பியூட்-2- ஈன் ( டிரான்ஸ்-2- பியூட்டீன்) சமபகுதியத்தில் உள்ள இரண்டு மீத்தைல் தொகுதிகளும் இரட்டைப்பிணைப்பின் எதிரெதிர் பக்கங்களை நோக்கியவாறு உள்ளன. பியூட்டினின் இந்த இரண்டு சமபகுதியங்களும் தங்கள் வேதியியல் மற்றும் இயற்பியல் பண்புகளில் சிறிதளவு வித்தியாசத்தைக் கொண்டுள்ளன.
இரட்டைப் பிணைப்பை சுழற்றுவது என்பது நிச்சயமாக முடியாததல்ல. உண்மையில் இரட்டைப் பிணைப்பின் ஒரு 90° சுழற்சிக்கு ஏறத்தாழ பை பிணைப்பின் வலிமையில் பாதி வலிமைக்கு சமமான ஆற்றல் தேவைப்படுகிறது. பட்டைக்கூம்பு வடிவமாதலின் விளைவாக p சுற்றுப்பாதைகளின் ஒழுங்கின்மை எதிர்பார்ப்பை விட குறைவாகவே இருக்கும். டிரான்ஸ்-வளையஆக்டேன் என்ற 137° இரு முகக்கோணமும் 18° பட்டைக்கூம்பு வடிவமாதல் பாகையும் கொண்ட, நிலையான நிலைப்புத்தன்மையற்ற ஆல்க்கீனின் சுற்றுவட்ட ஒழுங்கின்மை 19° மட்டுமேயாகும். 0.8டி இருமுனையித் திருப்புத்திறன் கொண்ட வளைய-எப்டேனின் டிரான்சு-சமபகுதியம் குறைந்த வெப்பநிலையில் மட்டுமே நிலைப்புத்தன்மை கொண்டது. ஆனால் 0.4டி வலிமை கொண்ட சிஸ் மாற்றமைப்புச் சேர்மத்திற்கு சுழிய மதிப்பு எதிர்பார்க்கப்படுகிறது.[3]
வடிவம்[தொகு]
இணைதிறன் கூடு இலத்திரன் சோடி விலக்கல் (valence shell electron pair repulsion, VSEPR) கொள்கையானது பல அணு மூலக்கூறுகளின் வடிவமைப்புகளை எளிய முறையில் நிர்ணயிக்க உதவுகிறது. இக்கொள்கையின்படி ஆல்க்கீன்களின் இரட்டைப் பிணைப்பில் உள்ள ஒவ்வொரு கார்பன் அணுவின் பிணைப்புக் கோணமும் கிட்டத்தட்ட 120° ஆகும். இரட்டைப் பிணைப்பைக் கொண்ட கார்பன் அணுக்களுடன் இணைந்துள்ள செயல்படு தொகுதிகளினால் உருவாகும் பிணைப்பற்ற இடைவிசைகள் அறிமுகப்படுத்தும் கொள்ளிட இறுக்கம் (steric strain) காரணமாக பிணைப்புக் கோணம் மாறுபடலாம். எடுத்துக்காட்டாக புரோப்பிலீனில் உள்ள C-C-C யில் பிணைப்புக் கோணம் 123.9° ஆகும்.
இயற்பியற் பண்புகள்[தொகு]
ஆல்க்கீன்களின் இயற்பியல் பண்புகள் ஆல்க்கேன்களின் இயற்பியல் பண்புகளோடு ஒப்பிடக்கூடியதாகவே உள்ளன. ஆல்க்கீன்களின் அமிலத்தன்மை ஆல்கேன்களின் அமிலத்தன்மையை விட சற்று அதிகமாக உள்ளது என்பதே இவ்விரண்டின் இயற்பியற் பண்புகளுக்கிடையே உள்ள முக்கிய வேறுபாடு ஆகும் ஆல்க்கீன்களின் இயற்பியல் தன்மைகள் அவற்றினுடைய மூலக்கூற்று நிறையை அடிப்படையாக கொண்டுள்ளன. எளிய ஆல்க்கீன்களான எத்தீன், புரோப்பீன், மற்றும் பியூட்டீன் முதலியன வளிமங்களாக உள்ளன. தோராயமாக 5 முதல் 16 வரையிலான கார்பன் அணுக்களைக் கொண்ட கிளைகளற்ற நேர்கோட்டு ஆல்க்கீன்கள் திரவ நிலையிலும் அதற்கு மேற்பட்ட கார்பன் அணுக்கள் கொண்டவை மெழுகையொத்த திண்மங்களாகவும் காணப்படுகின்றன.
வேதிவினைகள்[தொகு]
ஆல்க்கீன்களில் கார்பன் – கார்பன் பை பிணைப்பு காணப்படுவதால் இவை ஆல்க்கேன்களைக் காட்டிலும் அதிக வினைபுரியும் தன்மையைக் கொண்டுள்ளன. மேலும் இவற்றின் மூலக்கூறுகளில் பை-இலத்திரன்களைக் கொண்டிருப்பது ஆல்க்கீன்களுக்குரிய தனிச்சிறப்பு ஆகும். ஆல்க்கீன்களின் பெரும்பாலான வேதிவினைகள் பை பிணைப்பில் முறிவு ஏற்பட்டுப் புதிய ஒற்றைப் பிணைப்புகள் உருவாவதால் நிகழ்கின்றன.
ஆல்க்கீன்கள் பல்வேறு வகையான வினைகளில் பங்கேற்பதால் அவை பெட்ரோலிய வேதியியல் தொழிற்துறைக்கு மூலப்பொருளாக நின்று சேவையாற்றுகின்றன.
கூட்டு வினைகள்[தொகு]
ஆல்க்கீன்களில் உள்ள இரட்டைப் பிணைப்பு திறப்பின் காரணமாக ஆல்க்கீன்கள் பல கூட்டு வினைகளில் பங்கேற்கின்றன. பெரும்பாலான கூட்டு வினைகள் இலத்திரன்கவர் சேர்ப்பு (electrophilic addition) இயக்க அமைப்பின் அடிப்படையைப் பின்பற்றுகின்றன. இத்தைகய கூட்டு வினைகளுக்கு எடுத்துக்காட்டாக. பின்வருவனவற்றைக் குறிப்பிடலாம்:
ஐதரசனேற்றம்[தொகு]
ஆல்க்கீன்களை ஐதரசனேற்றம் (hydrogenation) செய்வதன் மூலமாக அதனோடு தொடர்புடைய ஆல்க்கேன்களைப் பெற முடியும். உலோக ஊக்கி முன்னிலையில், அழுத்தம் பிரயோகித்து ஆல்க்கீன்களை எளிதில் ஐதரசனேற்றம் செய்ய முடியும். சுமார் 200 – 300° செ. வெப்பநிலையில் உலோக வினையூக்கி அலுமினா மீது படிந்த நிக்கல் நல்ல பயனுள்ள ஊக்கியாக உபயோகமாகிறது. பொதுவாக தொழிற்சாலைகளில் பிளாட்டினம், நிக்கல், பலேடியம் போன்ற வினையூக்கிகள் பயன்படுத்தப்படுகின்றன. ஆய்வகங்களில் பொதுவாக நிக்கல்-அலுமினியம் கலப்புலோகம் உலோக ஊக்கியாக பயனாகிறது. (செபேடியர் – சென்ட்ரன் ஒடுக்கம்). மிகவும் எளிய கூட்டு வினைக்கு உதாரணம் எத்திலீனில் இருந்து எத்தேன் பெறும் வினையாகும்
- CH2=CH2 + H2 → CH3-CH3
நீரேற்றம்[தொகு]
எளிய ஆல்க்கீன்களுடன் நீர் மூலக்கூறு கூடி ஆல்ககால்கள் உண்டாகின்றன. வலிமை மிக்க அமில ஊக்கியான கந்தக அமிலத்தின் முன்னிலையில் நீர் ஆல்க்கீனுடன் கூட்டு வினையில் ஈடுபடுகிறது. தொழில்துறையில் எத்தனால் இம்முறையில் தயாரிக்கப்படுகிறது.
- CH2=CH2 + H2O → CH3-CH2OH
ஆல்க்கீன்களை ஆக்சிமெர்குரேசன் (oxymercuration) வினை மூலமாகவும் ஆல்ககால்களாக மாற்ற இயலும்.
ஆலசனேற்றம்[தொகு]
எலக்ட்ரோபிலிக் ஆலசனேற்ற வினைகளில் ஆல்க்கீன்கள் புரோமின், குளோரின் ஆகியவற்றுடன் எளிதாக வினையில் ஈடுபட்டு டைபுரோமோ மற்றும் டைகுளோரோ ஆல்கேன்கள் கிடைக்கின்றன. (1,2 – டைஆலைடுகள் அல்லது எத்திலீன் டைஆலைடுகள்). இவ்வினையில் புரோமின் நிறமிழக்கிறது. இந்த சோதனை நிறைவுறா தன்மையை கண்டறியப் பயன்படுகிறது.
- CH2=CH2 + Br2 → BrCH2-CH2Br
ஐதரோஆலசனேற்றம்[தொகு]
ஐதரோஆலசனேற்றம் என்பது ஐதரசன் குளோரைடு (HCl) அல்லது ஐதரசன் அயோடைடு (HI) போன்ற ஐதரசன் ஆலைடுகளுடன் ஆல்க்கீன்கள் கூட்டுவினை புரிந்து ஆல்கைல் ஆலைடுகளைத் தருகிற வினையாகும்.
- CH3-CH=CH2 + HI → CH3-CHI-CH2-H
புரொபலீன் ஐதரசஅயோடைடுடன் வினைபுரிந்து இரண்டு விளைபொருட்களை புரொபைல் அயோடைடு, ஐசோபுரொபைல் அயோடைடு ஆகியவற்றை விளைவிக்க முடியும். ஆனால் ஐதரசஅயோடைடு புரொபலீனுடன் கூடி உண்மையில் ஐசோபுரொபைல் அயோடைடு மட்டுமே கிடைக்கிறது. இவ்வாறு இரு விளைபொருட்கள் கிடைக்க வாய்ப்பிருந்தாலும் உண்மையில் ஒரே ஒரு விளைபொருள் கிடைப்பதை மார்க்காவ்னிகாவ் என்ற உருசிய வேதியியலாளர் விளக்கினார். இவ்விளக்கத்தையே "மார்க்காவ்னிகாவ் விதி" என்கிறோம். இவ்விதியின்படி கூடும் மூலக்கூறிலுள்ள எதிர்மின் பகுதி, ஆல்க்கீனிலுள்ள குறைந்த ஐதரசன் அணுக்களுடன் பிணைக்கப்பட்டுள்ள கார்பன் அணுவுடனேயே இணைகிறது.
இவ்வினையில் கார்போகேட்டயான் இடைநிலை சேர்மமாக உண்டாகிறது. அதிக பதிலீடு அடைந்த கார்போகேட்டயான், குறைபதிலீடு அடைந்த கார்போகேட்டயானை விட இடைநிலை சேர்மமாக உண்டாக இவ்வினையில் அதிக வாய்ப்புள்ளது. ஏனெனில் முன்னது பின்னதைவிட அதிக நிலைத்தன்மை உடையது.
மாறாக தீவிர ஊக்கிகள் அல்லது மற்ற வேதிப்பொருட்களின் பயன்பாடு காரணமாக இவ்வினையில் எதிர் விளைவுகள் ஏற்படலாம், ஆனால் எதிர்வினை-இடைநிலை கட்டமைப்புகள் மற்றும் வழிமுறைகள் வேறுபட்டிருக்கும். குறிப்பாக ஐதரோபுரோமிக் அமிலம் பல்வேறு மாசுக்கள் அல்லது வளிமண்டல ஆக்சிஜன் முன்னிலையில் பாதிப்புக்குள்ளாகி மார்கானிகாவ் விதியை தலைகீழாக்க வழிவகுத்தது:[4]
- CH3-CH=CH2 + HBr → CH3-CHH-CH2-Br
ஆலோயைட்ரின் உண்டாதல்[தொகு]
ஆல்க்கீன்கள் நீர் மற்றும் ஆலசன்களுடன் கூட்டுவினை புரிந்து ஆலோயைட்ரின் (halohydrin) உண்டாகிறது. தகுந்த சூழ்நிலையில் HOCl, HOBr ஆகியவை ஆல்க்கீன்களுடன் கூடி 1,2 ஆலோ ஆல்ககால் அல்லது ஆலோயைட்ரின் உண்டாகிறது. ஆல்க்கீன்கள் HOCl அல்லது HOBr உடன் நேரடியாக வினை புரிந்து ஆலோயைட்ரின்கள் உண்டாவதில்லை. மாறாக, நீர் முன்னிலையில் புரோமின் அல்லது குளோரின் ஆல்க்கீனுடன் வினைபுரிந்து வினைபொருளைத் தருகிறது.
- CH2=CH2 + X2 + H2O → XCH2-CH2OH + HX
ஆக்சிசனேற்றம்[தொகு]
ஆல்க்கீன்கள் அதிக அளவிலான ஆக்சிசனேற்றிகளினால் எளிதாக ஆக்சிசனேற்றம் அடைகின்றன. ஆக்சிசன் முன்னிலையில், ஆல்க்கீன்கள் பிரகாசமான சுடருடன் எரிந்து கார்பன் டை ஆக்சைடு மற்றும் நீரை கொடுக்கின்றன. வினையூக்கிகள் முன்னிலையில் ஆல்க்கீன்களை ஆக்சிசனேற்றம் செய்யும்போது அல்லது கார்பாக்சிலிக் அமிலத்துடன் வினை புரியும்போது ஈபாக்சைடு (epoxide) பெறப்படுகிறது.
ஓசோனுடன் ஆல்க்கீன்கள் வினைபுரியும் போது ஆல்க்கீனில் உள்ள இரட்டைப்பிணைப்பு உடைந்து இரண்டு ஆல்டிகைடுகள் அல்லது இரண்டு கீட்டோன்கள் உருவாகின்றன. அடர்த்தியான KMnO4 உடன் அமிலக்கரைசலில் வினைபுரிந்து கீட்டோன்கள் அல்லது கார்பாக்சிலிக் அமிலங்கள் விளைகின்றன.
- R1-CH=CH-R2 + O3 → R1-CHO + R2-CHO + H2O
அடையாளம் தெரியாத ஆல்க்கீன் இரட்டைப்பிணைப்பின் இருப்பிடத்தை இவ்வினையின் மூலமாக கண்டறியலாம்.
குறைவான வெப்பநிலையில் மிதமான KMnO4 அல்லது ஆஸ்மியம் டெட்ராக்சைடு அல்லது பிற ஆக்சிசனேற்றிகளின் உதவியை பயன்படுத்தி ஆக்சிசனேற்றம் நிகழ்வதை தடுக்கலாம்.
பலபடியாக்கல்[தொகு]
ஒருமம் (monomer) என அழைக்கப்படும் எளிய மூலக்கூறுகள் பல இணைந்து பல்லுறுப்பிகள் (polymers) எனும் பேரளவு மூலக்கூறு உண்டாகும் வினைக்கு பல்லுறுப்பாக்கல் (அல்லது பலபடியாக்கல்) வினை என்று பெயர். ஆல்க்கீன்கள் பலபடியாகல் வினைகளில் ஈடுபட்டு தொழில்துறை முக்கியத்துவம் பெற்ற நெகிழிகள், பாலிஎத்தீலீன் மற்றும் பாலிபுரொபைலீன் போன்ற பல்லுறுப்பிகளைத் தருகின்றன. ஆல்க்கீன் மானோமர்களிடம் இருந்து தயாரிக்கப்படும் பல்லுறுப்பிகள் பொதுவாக பாலிஒலிபின்கள் என்று அழைக்கப்படுகின்றன. சில வேளைகளில் அவை பாலிஆல்க்கீன்கள் என்றும் அழைக்கப்படுவதுண்டு. ஆல்ப்பா ஒலிபீன்களிட்ம் இருந்து பெறப்படும் பல்லுறுப்பிகள் பாலிஆல்ப்பாஒலிபீன் (polyalphaolefin, PAO) என்றழைக்கப்படுகின்றன. தனி உறுப்புகள் அல்லது அயனிப் பிணைப்பு மூலமாக பலபடியாக்கல் வினை முன்னெடுக்கப்படுகிறது. இம்முறையில் இரட்டைப்பிணைப்பை ஒற்றைப்பிணைப்பாக மாறவும் புதிய ஒற்றைப் பிணைப்பை உருவாக்கிடவும் அவை பிற மானோமர்களுடன் இணைந்து ஒற்றைப்பிணைப்பு உருவாகவும் வழி உண்டாகிறது.
nCH2 = CH2 → (- CH2 - CH2)n
உலோகக் கலவைகளாதல்[தொகு]
உலோகக் கல்வைகளில், ஆல்க்கீன்கள் ஈந்தணைவிகளாகச் (ஈனிகள்) செயல்பட முடிகிறது. ஆல்க்கீன்களிலுள்ள இரண்டு கார்பன் மையங்களும் C-C ’பை’ கூடுகளைப் பயன்படுத்தி உலோகங்களுடன் பிணைகின்றன. பெரும்பாலும் மோனோ மற்றும் டை ஒலிபீன்கள் நிலையான உலோகக் கலவைகளில் ஈந்தணைவிகளாகப் பயன்படுத்தப்படுகின்றன. சைக்ளோஆக்டாடையீன் மற்றும் நார்போர்னாடையீன் முதலிய ஐதரோகார்பன்கள் அதிகளவில் கொடுக்கிகளாகப் பயன்படுத்தப்படுகின்றன. மற்றும் சிலவேளைகளில் எத்திலீனும் ஈனியாகப் பயன்படுகிறது. இதற்கு பொட்டாசியம் டிரைகுளோரோ எத்தீன் பிளாட்டினேட் (K[PtCl3(C2H4)]·H2O, Zeise's salt) ஓர் உதாரணமாகும். உலோக-இயைபியக்க வினைகளான ஐதரசனேற்றம், ஐதரோபார்மைலேற்றம், பலபடியாக்கல் போன்ற வினைகளில் உலோக – ஆல்க்கீன் கலவைகள் இடைநிலைகளாக உள்ளன.
வேதிவினைகள் கண்ணோட்டம்[தொகு]
| வினையின் பெயர் | விளைபொருள் | கருத்து |
|---|---|---|
| ஐதரசனேற்றம் | ஆல்க்கேன் | ஐதரசன் கூட்டு வினை |
| ஐதரோ ஆல்க்கீனேற்றம் | ஆல்க்கீன் | ஐதரோ உலோக ஏற்றம் / நீக்கல் வினை / உலோக வினையூக்கி |
| ஆலஜன் கூட்டு வினை | 1,2- டைஆலைடு | ஆலஜன்கள் கூட்டு வினை |
| ஐதரோ ஆலஜனேற்றம் (மார்க்கோநிக்காவ்) | ஆலோஆல்க்கேன் | ஐதரோ ஆலிக் அமிலங்கள் கூட்டு வினை |
| எதிர் மார்க்கோநிக்காவ் ஐதரோ ஆலஜனேற்றம் | ஆலோஆல்கேன்கள் | தனி உறுப்புகளால் ஐதரோ ஆலிக் அமிலங்களின் கூட்டு வினை |
| ஐதரோ அமைனேற்றம் | அமைன்கள் | இரட்டைப்பிணைப்பின் குறுக்கே N-H பிணைப்பு கூட்டு வினை |
| ஐதரோபார்மைலேற்றம் | ஆல்டிகைடுகள் | தொழிற்துறை உற்பத்தி, CO மற்றும் H2 கூட்டு வினை |
| பிஸ் ஐதரோ ஆக்சைலேற்றம் | டையால்கள் | ஆக்சிசனேற்றம், கரணி: ஆஸ்மியம் டெட்ராக்சைடு, சிர்ரல் ஈனி |
| ஊட்டார்டு சிஸ் ஐதரோ ஆக்சைலேற்றம் | டையால்கள் | ஆக்சிசனேற்றம், கரணிகள்: அயோடின்,வெள்ளி அசிட்டேட் |
| ஓசோனாக்கல் | ஆல்டிகைடுகள் அல்லது கீட்டோன்கள் | கரணி: ஓசோன் |
| ஒலிபீன் மெட்டாவரைவு | ஆல்க்கீன் | இரண்டு ஆல்க்கீன்கள் அமைப்பு மாற்றமைடந்து புதிய இரண்டு ஆல்க்கீன்கள் தோன்றுதல் |
| டையீல்- ஆல்டர் எதிர்வினை | வளைய எக்சேன்கள் | ஒரு டையீனுடன் வளையம் இணைதல் |
| பௌசன் - காண்ட் எதிர்வினை | வளைய பெண்டனோன் | ஆல்கைன் மற்றும் CO உடன் வளையம் இணைதல் |
| ஐதரோ போரேனாதல் – ஆக்சிசனேற்றம் | ஆல்ககால்கள் | கரணிகள்: போரேன், பின்னர் ஒரு பெராக்சைடு |
| ஆக்சி பாதரசமேற்றம்- ஒடுக்கவினை | ஆல்ககால்கள் | பாதரச அசிட்டேட்டுடன் கூட்டு வினை பின்னர் ஒடுக்க வினை |
| பிரின் எதிர்வினை | 1,3-டையால் | ஆல்டிகைடு அல்லது கீட்டோனுடன் கூட்டு வினை |
| பேட்டிமோ-புச்சி எதிர்வினை | ஆக்சிடேன்கள் | ஆல்டிகைடு அல்லது கீட்டோனுடன் ஒளிவேதியல் எதிர்வினைகள் |
| ஈபாக்சிசனேற்றம் | ஈபாக்சைடு | பெராக்சைடு கூட்டு வினை |
| வளைய புரோபேனேற்றம் | வளைய புரோபேன் | கார்பீன்கள் அல்லது கார்பனாயிடுகள் கூட்டு வினை |
| ஐதரோஅசைலேற்றம் | கீட்டோன்கள் | ஆக்சிசனேற்ற கூட்டு வினை / ஒடுக்கம் உலோக வினையூக்கி நீக்கம் |
தொகுப்பு முறைகள்:-[தொகு]
தொழிற்துறை தயாரிப்பு முறைகள்:-[தொகு]
ஐதரோ கார்பன்களைப் பிளப்பதன் மூலமாக ஆல்க்கீன்கள் உற்பத்தி செய்யப்படுகின்றன. செறிவூட்டப்பட்ட இயற்கை எரிவாயு (முக்கியமாக ஈதேன் மற்றும் புரொப்பேன்) பெரும்பாலும் அமெரிக்கா மற்றும் மத்திய கிழக்கு நாடுகளில் மூலப்பொருளாக உள்ளது. ஐரோப்பா மற்றும் ஆசியாவில் இரசக்கற்பூரத்தைலம் மூலப்பொருளாக உள்ளது. ஜியோலைட் ஊக்கி முன்னிலையில், அதிக வெப்பநிலையில் ஆல்க்கேன்கள் தனியாக உடைந்து, வளையமில்லா ஆல்க்கீன்களும் குறைந்த மூலக்கூறு எடை கொண்ட ஆல்க்கேன்களும் கலந்த கலவையை தருகிறது. உபயோகிக்கப்ப்படும் மூலப்பொருள் மற்றும் வெப்பநிலையைச் சார்ந்துள்ள இக்கலவை பின்னக்காய்ச்சி வடித்தல் மூலம் பிரிக்கப்படுகிறது. இம்முறையில் ஆறு கார்பன்கள் வரையிலான சிறிய ஆல்க்கீன்கள் தயாரிக்கப்படுகின்றன.
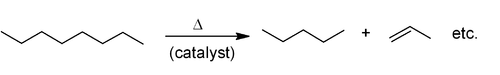
n-ஆக்டேன் இம்முறையில் பெண்ட்டேன் மற்றும் புரோபீனைத் தருகிறது.
தொடர்புடைய இந்த வினையூக்கி ஐதரசன் இறக்க வினையில், ஒரு ஆல்க்கேன் அதிகவெப்பநிலையில் ஐதரசனை இழந்து அத்னுடன் தொடர்புடைய ஆல்க்கீனை உற்பத்தி செய்கிறது. ஆல்க்கீனின் வினையூக்கி ஐதரசனேற்ற வினைக்கு தலைகீழாக இம்முறை உள்ளது.

பியூட்டேன் ஐதரசன் இழப்பு வினையில் பியூட்டா டையீனையும் பியூட்டீனின் மாற்றமைப்புகளையும் தருகிறது.
இந்த செயல்முறை மறுசீரமைப்பு முறை என்றும் அழைக்கப்படுகிறது. இரண்டு செயல்முறைகளும் அதிக வெப்பநிலையில் வெப்பங்கொள் வினை மற்றும் என்ட்ரோபி மூலம் ஆல்க்கீனை நோக்கி இயக்கப்படுகிறது.
அதிக கார்பன்கள் கொண்ட ஆல்க்கீன்களை ( RCH = CH2 வகை) நிக்கல், கோபால்ட், அல்லது பிளாட்டினம் வினையூக்கி முன்னிலையில் சேதனவுலோகமான டிரைஈத்தைல் அலுமினியத்தை எத்திலீன் உடன் சேர்த்தல் என்ற எதிர்வினை மூலம் அடைய முடியும்.
நீக்க வினைகள்:-[தொகு]
நீக்கவினைகள் சேர்க்கை அல்லது கூட்டுவினைகளுக்கு எதிரானவை. நீக்க வினையில் ஒரு வினைபொருளின் மூலக்கூறின் அடுத்தடுத்த இரு கார்பன் அணுக்களில் இணைந்துள்ள அணூக்கள் அல்லது மூலக்கூறுகள் நீக்கப்பட்டு இரட்டைப்பிணைப்பு உண்டாகிறது. எடுத்துக்காட்டாக, ஆல்ககால் கலந்த ஆல்கலிகள் கொண்டு ஆல்கைல் ஆலைடுகளிலிருந்து ஐதரசன் ஆலைடுகளை அகற்றும் வினைகளைச் செய்யலாம்.
R - CH2 - CH2 - X → R -CH = CH2 + H2O + X
ஆய்வுக்கூடத்தில் ஆல்க்கீன்கள் தொகுப்புக்கான முக்கிய முறைகளில் ஒன்றாக ஆல்கைல் ஆலைடுகள் உள்ளது போலவே ஆல்ககால் மற்றும் அதையொத்த சேர்மங்கள் நீக்கப்படுகின்றன.பொதுவாக நீக்க வினைகள் இரு வகைகளாகப் பிரிக்கப்படுகின்றன.
1) E2 வினைகள் 2) E1வினைகள்.
E2 வினைகள்:-
E2 என்பது இரு மூலக்கூறு நீக்கல் வினையைக் குறிக்கிறது. ஒரு நீக்கல் வினையின் வேகம் வினைப்பொருள் மற்றும் கருக்கவர் பொருள் ஆகிய இரண்டின் செறிவுகளைப் பொருத்திருந்தால், அவ்வினையின் வினைபடி இரண்டு; அவ்வினை ஒரு E2 வினை. E2 வினை ஒரு படியில் நிகழும் வினை. இதில் பீட்டா கார்பனில் இருந்து ஒரு புரோட்டான் பறிக்கப்படுவதும் ஆல்பா கார்பனிலிருந்து ஒரு ஆலைடு அயனி வெளித்தள்ளப்படுவதும் ஒரே சமயத்தில் நிகழ்கின்றன.இதன் வினைவழி முறை கீழே தரப்பட்டுள்ளது.

2) E1வினைகள்:-
E1 என்பது ஒரு மூலக்கூறு நீக்கல் வினையைக் குறிக்கிறது. ஒரு நீக்கல் வேகம் வினைப் பொருளின் செறிவை மட்டும் சார்ந்திருந்தால் அவ்வினையின் வினைப்படி எண் ஒன்று. அவ்வினை ஒரு E1வினை எனப்படுகிறது. E1வினைகள் இரண்டு படிகளில் நிகழும் வினைகளாகும். முதல் படியில் ஆல்கைல் ஆலைடு அயனியுற்று கார்பன் நேர் அயனியைத் தருகிறது. கார்பன் நேரயனி இரண்டாவது படியில் 2-மீத்தைல் புரோப்பீனைத் தருகிறது.
ஆல்ககால்கள் நீரிறக்கம் செய்யப்பட்டு ஆல்க்கீன்கள் தொகுக்கப்படுகின்றன. இவ்வினையில் E1 வினை வழிமுறையில் முதலில் நீர் இழக்கப்படுகிறது. எடுத்துக்காட்டாக எத்தனாலை நீரிறக்கம் செய்யும்போது எத்தீன் கிடைக்கிறது.
பெயரிடும் முறை:-[தொகு]
ஐயுபிஏசி பெயர்கள்
ஐயுபிஏசி விதிகளின்படி ஆல்க்கீன்களுக்கு பெயரிடுகையில் தாய் ஆல்க்கேனில் உள்ள -ஏன் என்ற பின்னொட்டுக்குப் பதிலாக -யீன் என்ற பின்னொட்டு சேர்க்கப்படுகிறது. எடுத்துக்காட்டாக, CH3-CH3 ஈத்தேன் என்ற தாய்ஆல்க்கேனில் உள்ள - ஏன் என்ற பின்னொட்டுக்குப் பதிலாக CH2 = CH2 என்ற ஆல்க்கீனில் -ஈன் என்ற பின்னொட்டு சேர்க்கப்பட்டு ஈத்தீன் என்று பெயரிடப்படுகிறது.
மாற்றீயங்கள் காணப்படும் அதிக எண்ணிக்கையிலான கார்பன் அணுக்களைக் கொண்ட ஆல்க்கீன்களில் கீழ்க்காணும் மூன்று படிகள் பயன்படுத்தப்படுகின்றன.
- இரட்டைப்பிணைப்பு உடைய பெரிய சங்கிலித் தொடரை கண்டறிந்து, பின்னர் அதற்குத் தகுந்த சேர்மத்தை எழுதி, பின்னொட்டாக -யீன் சேர்க்கவேண்டும்.
- சங்கிலித்தொடரின் இறுதியில் பக்கத்தில் இருக்கும் இரட்டைப் பிணைப்பினைப் பொறுத்து எண்களிடப்படுகின்றன.
CH3 - CH2 - CH2 - CH = CH - CH3
இந்த ஆல்க்கீனுக்கு பெயரிடும்போது எக்-2-ஈன் அல்லது 2-எக்சீன் எனப் பெயரிடுதல் சரியான முறையாகும். மாறாக 4-எக்சீன் எனப் பெயரிடுதல் தவறான முறையாகும்.
இரு முனைகளிலிருந்தும் இரட்டைப் பிணைப்பு சமமான இடத்தில் இருப்பின் எந்த முனையிலிருந்து குறைந்த எண்ணுடைய கார்பன் அணுவில் பதிலீடு உள்ளதோ, அந்த முனையிலிருந்து பெயரிடல் வேண்டும்.
- ஒன்றுக்கு மேற்பட்ட இரட்டைப் பிணைப்புகள் இருப்பின், ஒவ்வொரு இரட்டைப் பிணைப்பின் இடத்தினை,-டையீன்,-டிரையீன் மற்றும் டெட்ரயீன் என்று பெயரிடப்படுகிறது.
CH2 = C(CH3) - CH = CH2
இந்த ஆல்க்கீன் 2 - மெத்தில் -1,3- பியூட்டாடையீன் என்று பெயரிடப்படுகிறது.

ஒருபக்க(Cis),மறுபக்க(trans) மாற்றியம்:-[தொகு]
மாற்றியங்கள் அவற்றிலுள்ள அணுக்கள், தொகுதிகளின் புறவெளி அமைப்பில் மாறுபட்டு ஒருபக்க மாற்றியம் என்றும் மறுபக்க மாற்றியம் என்றும் அழைக்கப்படுகின்றன.

வடிவ மாற்றத்திற்கான முக்கியமானதும். போதுமானதுமான நிபந்தனை - ஒரு கார்பன் அணுவுடன் பிணைக்கப்பட்டுள்ள இரு தொகுதிகள் அல்லது அணுக்கள் வெவ்வேறானதாக இருத்தல் வேண்டும்.முதன்மை வரிசையில் ஒன்றாக உள்ள இரு தொகுதிகள் அல்லது அணுக்கள் இரட்டைப்பிணைப்பின் ஒரே பக்கத்தில் இருக்குமேயானால் அது Z அல்லது ஒ மாற்றியம் எனப்படுகிறது. (செர்மன் மொழியில் சுசாமன் என்றால் ஒன்றாக கூடி இருப்பது என்று பொருள்).அவை எதிர்திசைகளில் அமைக்கப்பட்டிருப்பின் அது E அல்லது எ மாற்றியம் எனப்படுகிறது.(செர்மன் மொழியில் எண்டசன் என்றால் எதிர்பக்கம் என்று பொருள்)

ஆல்க்கீன்களின் பயன்கள் :-[தொகு]
1. பாலித்தீன், பாலி புரொபலீன்,பாலிவினைல் குளோரைடு,பாலி ஸ்டைரின்,டெப்லான்,ஆர்லான்,அக்ரிலான்,பாலி வினைல் அசிட்டேட், பாலி வினைல் ஆல்ககால் போன்ற பல்லுறுப்பிகள் தயாரிப்ப்பில் ஆல்க்கீன்கள் பெரும் பங்கு வகிக்கின்றன.
2. குறைந்த எண்ணிக்கையிலான கார்பன் அணுக்களைக் கொண்ட ஆல்க்கீன்கள் எரிபொருட்களாகவும் ஒளியூட்டிகளாகவும் திகழ்கின்றன.
3. எத்திலீன் பழங்களைப் பழுக்க வைக்கப் பயன்படுகிறது.
4. மதுச்சாரம் அல்லது ஆல்ககால், ஆல்டிகைடு போன்ற தொழிற்துறை வேதிப்பொருட்களை தயாரிக்க ஆல்க்கீன்கள் பயன்படுகின்றன.
5. தொழிற்துறையில் பயன்படும் எத்திலீன் டை குளோரைடு, கிளைக்கால், டையாக்சன் போன்ற கரைப்பான்களைத் தயாரிக்க ஆல்க்கீன்கள் பயன்படுகின்றன.
6. செயற்கை இரப்பர் தயாரிப்பு மற்றும் மயக்கமூட்டிகளாக ஆல்க்கீன்கள் பயன்படுகின்றன.
மேற்கோள்கள்[தொகு]
- ↑ 1.0 1.1 Wade, L.G. (Sixth Ed., 2006). Organic Chemistry. Pearson Prentice Hall. பக். 279. பன்னாட்டுத் தரப்புத்தக எண்:1-4058-5345-X.
- ↑ 2.0 2.1 Moss, G. P.; Smith, P. A. S.; Tavernier, D. (1995). "Glossary of Class Names of Organic Compounds and Reactive Intermediates Based on Structure (IUPAC Recommendations 1995)". Pure and Applied Chemistry 67 (8–9): 1307–1375. doi:10.1351/pac199567081307.
- ↑ Barrows, Susan E.; Eberlein, Thomas H. (2005). "Understanding Rotation about a C=C Double Bond". J. Chem. Educ. 82 (9): 1329. doi:10.1021/ed082p1329. Bibcode: 2005JChEd..82.1329B. http://jchemed.chem.wisc.edu/Journal/Issues/2005/Sep/abs1329.html.
- ↑ Andrew Streitwieser; Clayton Heathcock; Kosower, E.M. (1992). "11.6.G. Alkenes: Reacttions: Free Radical Additions". Introduction to Organic Chemistry (4th ). New York: Macmillan. பக். 288.


