நைட்ரசன்: திருத்தங்களுக்கு இடையிலான வேறுபாடு
சி r2.7.1) (தானியங்கி இணைப்பு: ba:Азот |
சி r2.7.2) (Robot: Modifying yo:Nítrójínì to yo:Nítrójìn |
||
| வரிசை 178: | வரிசை 178: | ||
[[xal:Шүтөр]] |
[[xal:Шүтөр]] |
||
[[yi:אזאט]] |
[[yi:אזאט]] |
||
[[yo: |
[[yo:Nítrójìn]] |
||
[[zh:氮]] |
[[zh:氮]] |
||
[[zh-min-nan:Chit-sò͘]] |
[[zh-min-nan:Chit-sò͘]] |
||
06:04, 7 திசம்பர் 2012 இல் நிலவும் திருத்தம்
| நைட்ரசன் | |||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
7N
| |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| தோற்றம் | |||||||||||||||||||||||||
நிறமிலி வளிமம், திரவம், அல்லது திண்மம் திரவ நைட்ரசன் நைதரசனின் நிறமாலைக் கோடுகள் | |||||||||||||||||||||||||
| பொதுப் பண்புகள் | |||||||||||||||||||||||||
| பெயர், குறியீடு, எண் | நைட்ரசன், N, 7 | ||||||||||||||||||||||||
| உச்சரிப்பு | /ˈnaɪtr[invalid input: 'ɵ']dʒən/ NYE-trə-jən | ||||||||||||||||||||||||
| தனிம வகை | அலோகம் | ||||||||||||||||||||||||
| நெடுங்குழு, கிடை வரிசை, குழு | 15, 2, p | ||||||||||||||||||||||||
| நியம அணு நிறை (அணுத்திணிவு) |
14.0067(2) | ||||||||||||||||||||||||
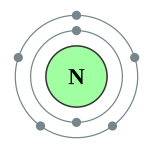
| இலத்திரன் அமைப்பு | 1s2 2s2 2p3 2, 5 | ||||||||||||||||||||||||
| வரலாறு | |||||||||||||||||||||||||
| கண்டுபிடிப்பு | D. Rutherford (1772) | ||||||||||||||||||||||||
| பெயரிட்டவர் | J. Chaptal (1790) | ||||||||||||||||||||||||
| இயற்பியற் பண்புகள் | |||||||||||||||||||||||||
| நிலை | வளிமம் | ||||||||||||||||||||||||
| அடர்த்தி | (0 °C, 101.325 kPa) 1.251 g/L | ||||||||||||||||||||||||
| திரவத்தின் அடர்த்தி கொ.நி.யில் | 0.808 g·cm−3 | ||||||||||||||||||||||||
| உருகுநிலை | 63.15 K, -210.00 °C, -346.00 °F | ||||||||||||||||||||||||
| கொதிநிலை | 77.36 K, -195.79 °C, -320.33 °F | ||||||||||||||||||||||||
| மும்மைப் புள்ளி | 63.1526 K (-210°C), 12.53 kPa | ||||||||||||||||||||||||
| மாறுநிலை | 126.19 K, 3.3978 MPa | ||||||||||||||||||||||||
| உருகலின் வெப்ப ஆற்றல் | (N2) 0.72 கி.யூல்·மோல்−1 | ||||||||||||||||||||||||
| வளிமமாக்கலின் வெப்ப ஆற்றல் | (N2) 5.56 கி.யூல்·மோல்−1 | ||||||||||||||||||||||||
| வெப்பக் கொண்மை | (N2) 29.124 யூல்.மோல்−1·K−1 | ||||||||||||||||||||||||
| ஆவி அழுத்தம் | |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| அணுப் பண்புகள் | |||||||||||||||||||||||||
| ஒக்சியேற்ற நிலைகள் | 5, 4, 3, 2, 1, -1, -2, -3 (வலுவான காடிய ஆக்ஸைடு) | ||||||||||||||||||||||||
| மின்னெதிர்த்தன்மை | 3.04 (பாலிங் அளவையில்) | ||||||||||||||||||||||||
| மின்மமாக்கும் ஆற்றல் (மேலும்) |
1வது: 1402.3 kJ·mol−1 | ||||||||||||||||||||||||
| 2வது: 2856 kJ·mol−1 | |||||||||||||||||||||||||
| 3வது: 4578.1 kJ·mol−1 | |||||||||||||||||||||||||
| பங்கீட்டு ஆரை | 71±1 pm | ||||||||||||||||||||||||
| வான்டர் வாலின் ஆரை | 155 பிமீ | ||||||||||||||||||||||||
| பிற பண்புகள் | |||||||||||||||||||||||||
| படிக அமைப்பு | hexagonal | ||||||||||||||||||||||||
| காந்த சீரமைவு | diamagnetic | ||||||||||||||||||||||||
| வெப்ப கடத்துத் திறன் | 25.83 × 10−3 W·m−1·K−1 | ||||||||||||||||||||||||
| ஒலியின் வேகம் | (gas, 27 °C) 353 மீ.செ−1]] | ||||||||||||||||||||||||
| CAS எண் | 7727-37-9 | ||||||||||||||||||||||||
| மிக உறுதியான ஓரிடத்தான்கள் (சமதானிகள்) | |||||||||||||||||||||||||
| முதன்மைக் கட்டுரை: நைட்ரசன் இன் ஓரிடத்தான் | |||||||||||||||||||||||||
| |||||||||||||||||||||||||
நைட்ரசன் (இலங்கை வழக்கு- நைதரசன்) ஒரு தனிமம் ஆகும். இதன் அணு எண் 7. இது ஒரு நிறமற்ற, மணமற்ற, சுவைற்ற ஒரு வாயு ஆகும். வளிமண்டலத்தில் 78.1% இவ்வாயுவால் நிரப்பப்பட்டுள்ளது. தொழில்ரீதியான முக்கியத்துவம் வாய்ந்த சேர்வைகளான அமோனியா, நைத்திரிக் அமிலம், சயனைட்டுக்கள் போன்றவை நைதரசனைக் கொண்டுள்ளன. வளிமண்டலக் காற்றில் நைட்ரஜனின் செழுமை மிக அதிகமாக 78 % உள்ளது. வளிமண்டலத்தில் இதன் பருமன் ஆக்சிஜனை விட 4 மடங்கு அதிகமாய் உள்ளது . தனிம அட்டவணையில் நைட்ரஜன் தொகுதியில் (V. A) உள்ள எல்லாத் தனிமங்களும் உலோகம் அல்லது உலோகம் போன்றதாக இருக்க நைட்ரஜன் மட்டும் வளிம நிலையில் இருக்கின்றது.
கண்டுபிடிப்பு
இங்கிலாந்து நாட்டு மருத்துவரான டானியல் ரூதர்போர்டு 1772 ல் நைட்ரஜன் வளிமத்தைக் கண்டுபிடித்தார்.ஒரு மணி வடிவ ஜாடியில் வளி மண்டலக் காற்றை எடுத்துக் கொண்டு, அதில் ஒரு பொருளை எரித்து அதிலுள்ள ஆக்சிஜன் முழுவதையும் நீக்கிக் கொண்டார். அதனுள் ஒரு உயிருள்ள எலியை விட, அது ஆக்சிஜன் இல்லா வெளியில் உடல் நலக் கோளாறால் பாதிக்கப்பட்டது, இறுதியில் இறந்தும் போனது. இதன் மூலம் ஆக்சிஜன் நீக்கப் பெற்று எஞ்சிய வளி மண்டலக் காற்றை அவர் நைட்ரஜன் என அழைத்தார். லத்தீன் மொழிச் சொல்லான நைட்ரியம், கிரேக்க மொழியில் நைட்ரஜனாக மாறி இதற்கு மூலமாகி N என்ற குறியீட்டையும் தந்தது. பிரான்சு நாட்டின் அந்துவான் இலவாசியே இதற்கு அசோட்(azote)எனப் பெயரிட்டார்.'a'என்ற ஒட்டு கிரேக்க மொழியில் எதிர் மறையையும் 'சோ' என்றால் வாழ்க்கை பொருளையும் குறிக்கும். அசோட் என்றால் வாழ்க்கை இல்லா நிலை என்று பொருள். ஆக்சிஜன் இல்லாத நைட்ரஜன் வளிமத்தால் மட்டும் வாழ்க்கை நிலைபடாது என்பதால் இந்த வளிமம் முதலில் அப்பெயர் பெற்றது. 19ll ல் லார்டு ரலே என்பார் வினை திறமிக்க நைட்ர ஜனைக்(active nitrogen)கண்டறிந்தார்.
உற்பத்தி
காற்றை நீர்மமாக்கி அதிலிருந்து நைட்ரஜன் நீர்மத்தைக் காய்ச்சி வடித்தல் மூலம் பெறுகின்றார்கள்.நீர்மக் காற்றை கொஞ்சம் கொஞ்சமாகச் சூடுபடுத்தி, வெவ்வேறு கொதி நிலை உடைய வளிமங்களை ஆவியாக்கி குளிர்வித்து நீர்மமாக்கி செழுமையூட்டுவர். நைட்ரஜனின் கொதி நிலை - 195.8 டிகிரி C ஆகும். காற்று வெளியில் பொட்டாசியம் பைரோ காலேட்டை வைத்து அதிலுள்ள ஆக்சிஜன் மற்றும் கார்பன்டைஆக்சைடை நீக்கி நைட்ரஜன் மட்டும் எஞ்சுமாறு செய்கின்றாகள். வளி மண்டலக் காற்றிலிருந்து பெறப்படும் நைட்ரஜன் தூய்மையானதில்லை. ஏனெனில் அதில் மந்த வளிமங்களான ஆர்கான், கிரப்பிட்டான் போன்றவை சிறிதளவு கலந்திருக்கும். எனவே தூய நைட்ரஜன் பெற வேதியியல் வினைகளையே அணுக வேண்டியுள்ளது. செம்பையும் நைட்ரிக் அமிலத்தையும் சமவிகிதத்தில் கலக்க நைட்ரிக் ஆக்சைடு உற்பத்தி ஆகும். இதை சூடுபடுத்தப்பட்ட செம்புத் துருவல்கள் வழியே செலுத்திக் கிடைக்கும் வளிமத்தைச் சேகரிக்க அது நைட்ரஜனாகும். அமோனியம் நைட்ரேட்டை நீரில் கரைத்துச் சூடுபடுத்தி நைட்ரஜனை எளிதாகப் பெறலாம்.
பண்புகள்
நைட்ரஜன் நிறம்,மணம் சுவையற்ற ஒரு வளிமம். இது காற்றை விட மிகச்சிறிதளவே இலேசானது. நீரில் மிகச் சிறிதளவே கரைகிறது. இது நச்சுத் தன்மையற்றது. காற்றில் எரிவதில்லை. எரிதலின்றி வாழ்க்கைக்கு உறுதுணையாகவும் இல்லை. சுண்ணாம்பு நீரைப் பால்போல வெண்மையாக்குவதில்லை. இதன் அணு எண் 7. அணு நிறை 14.007. அடர்த்தி 1.165 கிகி /கமீ. இதன் உறை நிலையும் கொதி நிலையும் முறையே 70.25 ,77.31 K ஆகும். நைட்ரஜன் வினையில் மந்தமாக ஈடுபடுகிறது. சற்று உயர்வெப்ப நிலையில் இது மக்னீசியம், லித்தியம், கால்சியம் போன்ற பல உலோகங்களுடன் கூடி நைட்ரைடுகளை உண்டாக்குகின்றது. அது போலவே அலோகங்களான போரான், சிலிகானுடன் வினை யாற்றுகின்றது. இன்னும் கூடுதலான வெப்ப நிலையில் நைட்ரஜன் ஆக்சிஜனுடன் நேரடியாகக் கூடி அமோனியா மற்றும் நைட்ரிக் ஆக்சைடை உண்டாக்குகின்றது. கார்பன் மின் வில் லின் (Carbon arc)சுடரொளியில் நைட்ரஜனுடன் கூடுகிறது. கந்தகமும், ஹாலஜன்களும் எந்த வெப்ப நிலையிலும் நைட்ரஜனுடன் கூடுவதில்லை. துருவ ஒளி என்பது சூரியனிலிருந்து வீசப்படும் மின்னேற்றக் கொண்ட துகள்கள், அயனிகள் வளி மண்டலத்தை ஊடுருவும் போது புவி காந்தப் புலத்தோடு இடையீட்டுச் செயல் புரிந்துவெளிப்படும் ஒளியாகும். நைட்ரஜன் மூலக்கூறு ஆரஞ்சு-சிவப்பு ,நீலம் -பச்சை, நீலம்- கருநீலம் மற்றும் ஊதா போன்ற வண்ணங்களைத் துருவ ஒளியில் தருகிறது.
மாற்றுருக்கள்
திண்ம நைட்ரஜன் இரு வேற்றுருக்களைக்(allotropic forms) கொண்டுள்ளது. அவற்றை ஆல்பா ,பீட்டா நைட்ரஜன் என்பர். - 237 டிகிரி C வெப்ப நிலையில் இதன் நிலை மாற்றம் நிகழ்கிறது.
பயன்கள்
தாழ்ந்த அழுத்தத்தில் நைட்ரஜன் வழி மின்னிறக்கம் செய்ய,அது மஞ்சள் நிற வெப்பொளியைத் (thermo luminescence)தருகிறது. இது வினைத்திறன் மிக்கதாய் இருப்பதால் பெரும்பாலான உலோகங்கள் ஆலோகங்களுடன் நேரடியாகக் கூடுகிறது. வெள்ளைப் பாஸ்பரஸ் சிவப்பாகவும், அயோடின் நீலப் புகையாகவும் மாற்றம் பெறுகின்றன. இதையே வினைத்திறன் மிக்க நைட்ரஜன் என்பர்.இதனை லார்டு ராலே என்பவர் 1911-ல் கண்டறிந்தார்.
உற்பத்தி
ஓரளவு மந்தமான வளிமம் என்றாலும் நைட்ரஜன் பல ஆயிரக்கணக்கான வேதிச் சேர்மங்களில் இணைந்திருக்கின்றது. இது வேளாண்மையில் உரமாகவும்,தொழிற்துறையில் உணவுப் பொருளுற்பத்தி மற்றும் அவை கெடாமல் பாதுகாக்கவும், வெடி மருந்து, நஞ்சுப் பொருட்கள், நைட்ரிக் அமிலம் போன்ற வேதிப் பொருட்களின் உற்பத்திக்கு மூலப்பொருளாகவும் விளங்குகிறது. அம்மோனிய உப்புக்கள் உரமாகப் பயன்படுகின்றன. அம்மோனியாவை ஆக்சிஜனேற்ற வினைக்கு உட்படுத்தி நைட்ரிக் அமிலத்தையும் உற்பத்தி செய்ய முடியும்.
நீர்ம நைட்ரஜன்
நீர்ம நைட்ரஜன் உணவுப் பொருட்களின் குளிர்பதனப் பாதுகாப்புக்கும், உயிர் பொருட்களைப் பாதுகாத்துப் பிற்பாடு பயன்படுத்திக் கொள்வதற்கும் பயன்தருகிறது. எடுத்துக் காட்டாக மனிதர்கள் மற்றும் விலங்கினங்களின் விந்துக்களை நீர்ம நைட்ரஜனில் முக்கி வைத்து பிற்பாடு செயற்கையாகக் கருத்தரித்தலுக்குப் பயன்படுத்திக் கொள்கின்றார்கள். மிகவும் தீவிரமாக வினையில் ஈடுபடக் கூடிய வளிமண்டல வளிமங்களிலிருந்து, அதனால் பாதிக்கப்படும் புதிய உற்பத்திப் பொருட்களை விலக்கி வைக்க நைட்ரஜன் வளிமத்தை மூடு திரையாகப் பயன்படுத்துகின்றார்கள்.
பொருட்களின் பாதுகாப்பு
டிரான்சிஸ்டர்,டையோடு போன்ற மின்னணுவியல் சாதனங்களை உற்பத்தி செய்யும் போது அவை வளி மண்டலக் காற்றால் பாதிக்கப்படாதிருக்க இவ் வழிமுறையைப் பின்பற்றுகின்றார்கள். மது பானங்கள் ஆக்சிஜனேற்றம் பெறுவதைத் தடுக்க புட்டிகளில் நைட்ரஜனை இட்டு நிரப்புவார்கள். பழங்கள் அழுகி விடாமல் பாதுகாக்கவும் நைட்ரஜன் வளிமம் பயன்தருகிறது. ஆப்பிள் பழங்களைத் தாழ்ந்த வெப்ப நிலை மற்றும் நைட்ரஜன் வெளியில் 30 மாதங்கள் வரை பாதுகாக்க முடியும்.
எண்ணெய்க் கிணறுகளில்
எண்ணைய்க் கிணறுகளில் நைட்ரஜனை அழுத்தி குழாய் வழியாக பூமிக்கு அடியில் செலுத்த, அது அங்குள்ள எண்ணையை எக்கி வெளிக்கொண்டு வருகிறது. இதையே கூடுதல் எண்ணெய் உற்பத்தி (enhanced oil production) என்பர். இதற்கு வளி மண்டலக் காற்றைப் பயன்படுத்துவதில்லை. ஏனெனில் இதிலுள்ள சில வளிமக் கூறுகள் எண்ணையோடு வினை புரிந்து வேண்டாத விளை பொருட்களை உற்பத்தி செய்து விடுகின்றன. நைட்ரஜனைக் கொண்டுள்ள பல சேர்மங்கள் தாவரங்கள் மற்றும் விலங்கினங்களின் உயிர் வாழ்க்கைக்கு மிகவும் இன்றியமையாததாக இருக்கின்றன. இவற்றுள் முக்கியமானவை புரதங்களும் நியூக்ளிக் அமிலங்களுமாகும்.
வெடி பொருள்கள்
நைட்ரிக் அமிலம்
நைட்ரஜனின் மற்றொரு முக்கியச் சேர்மம் நைட்ரிக் அமிலம். அமோனியம் நைட்ரேட் போன்ற உரங்கள், வெடி மருந்துகள் நைலான் மற்றும் பாலியுரித்தேன்(Polyurethane) போன்ற நெகிழ்மங்களின் உற்பத்தி முறையில் இது மூலப் பொருளாக உள்ளது. நைட்ரிக் அமிலம் கிளிசராலுடன் வினை புரியும் போது அது நைட்ரோ கிளிசரின் என்ற வலிமைமிக்க வெடி மருந்தை உற்பத்தி செய்கிறது.மிகச் சிறிய அசைவு கூட இதை வெடிக்கச் செய்துவிடும். அப்போது மிகுந்த அளவு வெப்பம், நைட்ரஜன் மற்றும் கார்பன் டை ஆக்சைடு வளிமங்கள் வெளிப்படுகின்றன. வளிமங்களின் வெப்பஞ்சார்ந்த விரை வேகப் பெருக்கமே வெடியாகிறது.
டைனமைட்
நைட்ரோ கிளிசரினின் ஒரு துணைப் பொருள் டைனமைட்டாகும். 1867 ல் ஆல்பிரட் நோபல் என்பார் இதைக் கண்டுபிடித்தார். நைட்ரோ கிளிசரினைக் களிமண்ணுடன் கலக்க அது அதிர்வுகளினால் வெடிப்பதில்லை என்ற உண்மையை இவர் கண்டறிந்தார். இதை எடுத்துச் சென்று தேவையான இடங்களில் வெடிக்கச் செய்ய முடிந்ததால் அக் கண்டுபிடிப்பைக் கொண்டு பெரும் பொருளீட்டினார். எனினும் பிற்பாடு மனித குலத்திற்குச் செய்த தவறுகளுக்கு மாற்றாக தாம் ஈட்டிய பொருள் அனைத்தையும் நோபெல் பரிசாக, மக்களுக்கு நன்மை பயக்கும் நல்ல கண்டுபிடிப்புகளைச் செய்த விஞ்ஞானிகளுக்கு அளித்தார்.
சோடியம் அசைடு
சோடியம் அசைடு(NaN3)என்ற சேர்மம் இன்றைக்கு வளிமப் பொதியுறைகளில் பயன்படுத்தப்படுகிறது. இது ஒரு வெடி பொருள். மோதலின் போது அல்லது எரிக்கும் போது இது விரைந்து சிதைவுற்று மிகுந்த அளவு நைட்ரஜனை வெளிப்படுத்துகிறது. இது பொதியுறையை உப்பச் செய்து மோதலினால் ஏற்படும் விபத்துக்களின் தீவிரத்தை மட்டுப்படுத்துகிறது. இது கடலில் பயணிப்போருக்கு விபத்துக்களின் போது பாதுகாப்பு உறையாகப் பயன்தருகிறது.
பிற
1999 ல் கார்ல் ஒ கிறிஸ்டி (Karl-o-Christie) மற்றும் வில்லியம் டபில்யூ வில்சன் (William W Wilson) என்ற வேதியியலார் நைட்ரஜனின் ஒரு புதிய சேர்மத்தைக் கண்டறிந்தனர். இதில் 5 நைட்ரஜன் அணுக்கள் 'V' என்ற வடிவில் ஒன்றோடொன்று பிணைந்துள்ளன. நைட்ரஜன்-13 உமிழும் பாசிட்ரான்(Positron) உடல் உள்ளுறுப்புகளின் நிழல் படம் காட்டியில்(Positron emission tomography) பயன்படுகிறது.இதன் அரை வாழ்வு 9.97 நிமிடங்கள் என்பதால் நோயாளிகளுக்குக் கதிரியக்கத்தால் பெரும் தீங்கு விளைவதில்லை. விரைவிலேயே சிதைந்து அழிந்து விடுகின்றது. சிரிப்பூட்டும் வாயு அல்லது சிரிப்பு வளிமம் எனப்படும் நைட்ரஸ் ஆக்சைடு(N2O)மயக்க மருந்தாக அறுவைச் சிகிச்சையின் போது பயன்படுகிறது.
நைட்ரஜன் மாசுகள்
நைட்ரிக் ஆக்சைடு(NO), நைட்ரஜன் பெராக்சைடு(NO2) போன்றவை தானியங்கு வண்டிகள் உமிழும் புகையாலும், நைட்ரஸ் ஆக்சைடு (N2O) நைட்ரேட் உரங்களின் பயன்பாட்டினாலும் வளிமண்டலத்தில் மாசுகளாகச் சேருகின்றன. மின் உற்பத்தி நிலையங்களும் நைட்ரிக் ஆக்சைடை உற்பத்தி செய்து வளிமண்டலத்தில் கலக்கின்றன. இவற்றால் வளிமண்டலத்தில் அடர்த்தியான மூடுபனி ஏற்படுகிறது. வளிமண்டலத்தின் உயரடுக்குகளுக்கு ஊடுபரவி அங்குள்ள ஓசோனைத் தாக்குவதில் NO முக்கியப் பங்கு வகிக்கின்றது. இதனால் தானியக்க உந்துவண்டிகளில் வினையூக்கிப் பரிமாற்றி (Catalytic converter) பொருத்தி மாசுகளைத் தீமையற்றதாக மாற்றிக்கொள்கிறார்கள்.