அலோகம்: திருத்தங்களுக்கு இடையிலான வேறுபாடு
Nan (பேச்சு | பங்களிப்புகள்) No edit summary |
No edit summary |
||
| வரிசை 1: | வரிசை 1: | ||
| ⚫ | [[File:Periodic table (polyatomic).svg|thumb|right|350px|தனிம வரிசை அட்டவணையில் அலோகங்கள்:<br/>{{legend|{{Element color|polyatomic nonmetal}}|[[#polyatomic nonmetal|பலவணு அலோகங்கள்]]}}{{legend|{{Element color|diatomic nonmetal}}|[[#Diatomic nonmetals|ஈரணு அலோகங்கள்]]}}{{legend|{{Element color|Noble gas}}|[[#Noble gases|மந்த வாயுக்கள்]]}} அட்டவணையில் [[ஐதரசன்]] தவிர மற்ற அலோகங்கள், [[p-தொகுதி]] யில் அடுக்கப்பட்டுள்ளன. [[ஹீலியம்]], s-தொகுதி தனிமம் பொதுவாக மந்த வாயுக்களுக்கான பண்புகளைப் பெற்றிருப்பதால் [[நியான்| நியானுக்கு மேலாக (p-தொகுதி) வைக்கப்பட்டுள்ளது]].]] |
||
'''மாழையிலி''' அல்லது '''அலோகம்''' (''Non-metal'') என்பது [[வேதியியல்|வேதியியலில்]] வேதிப் பொருட்களை வகைப்படுத்தும் பொழுது தங்கம், வெள்ளி இரும்பு போன்ற [[உலோகம்|மாழை]] எனப்படும் பொருள்களில் இருந்து மாறுபடும் மாழை அல்லாத வேதிப்பொருட்களைக் குறிக்கும். தனிம அட்டவணையில் 17 தனிமங்கள்தாம் மாழையிலி என்று வகைப்படுத்தப்படுகின்றன. ஆனால் தனிமங்களில் சுமார் 80 -உக்கும் மேலானவை மாழைகள் எனப்படுகின்றன. எனவே தனிம அட்டவணையில் உள்ள ஒவ்வொரு தனிமத்தையும் [[இயற்பியல்]] [[வேதியியல்]] பண்புகளின் அடிப்படையில் ஒன்று மாழையாகவோ அல்லது மாழையிலி ஆகவோ வகைப்படுத்த முடியும். ஒருசில தனிமங்கள் இரண்டிற்கும் இடைப்பட்ட பண்புகள் கொண்டுள்ளன - அவைகளை மாழையனை (மாழை போன்றவை) எனப்படும். |
|||
[[வேதியியல்|வேதியியலில்]], '''அலோகம்''' அல்லது '''மாழையிலி''' (''non-metal'') என்பது [[உலோகம்|உலோகப்]] பண்புகளைப் பெற்றிருக்காத வேதியியல் தனிமங்கள் ஆகும். அலோகங்கள் எளிதில் [[ஆவியாதல்|ஆவியாகக்]] கூடியனவாகவும், [[வெப்பம்|வெப்பத்தையும்]] [[மின்சாரம்|மின்சாரத்தையும்]] எளிதில் கடத்தாத காப்புப் பொருட்களாகவும், குறைவான நெகிழ்வுத் தன்மை கொண்டவையாகவும் காணப்படுகின்றன. வேதியியல் பண்புகளின் அடிப்படையில் இவை அதிக [[அயனியாக்கும் ஆற்றல்]] மற்றும் இலத்திரன் கவர் ஆற்றல் மதிப்புகளைக் கொண்டுள்ளன. அலோகங்கள் ஏனைய [[தனிமம்|தனிமங்கள்]] அல்லது [[வேதியியற் சேர்மம்|சேர்மங்களுடன்]] வினைபுரியும் போது [[இலத்திரன்]]களைப் பெற அல்லது பகிர்ந்து கொள்ள முனைகின்றன. |
|||
17 |
[[தனிம அட்டவணை]]யில் சுமார் எண்பதிற்கும் மேலானவை உலோகங்கள் ஆகும். ஆனால், 17 தனிமங்களே பொதுவாக அலோகங்களாக வகைப்படுத்தப்பட்டுள்ளன. இவற்றுள் பெரும்பாலானவை வாயுக்கள். ([[ஐதரசன்]], [[ஈலியம்]], [[நைட்ரசன்]], [[ஆக்சிசன்]], [[புளோரின்]], [[நியான்]], [[குளோரின்]], [[ஆர்கான்]], [[கிரிப்டான்]], [[செனான்]] மற்றும் [[ரேடான்]]) [[புரோமின்]] மட்டும் [[திரவம்| திரவநிலையில்]] உள்ளது. [[கார்பன்]], [[பாஸ்பரஸ்]], [[கந்தகம்]], [[செலினியம்]] மற்றும் [[அயோடின்]] போன்ற வெகுசில அலோகங்கள் [[திண்மம்|திடநிலையில்]] காணப்படுகின்றன. |
||
தனிம அட்டவணையில் உள்ள ஒவ்வொரு தனிமத்தையும் [[இயற்பியல்]] [[வேதியியல்]] பண்புகளின் அடிப்படையில் ஒன்று உலோகமாகவோ அல்லது அலோகமாகவோ வகைப்படுத்த முடியும். ஒருசில தனிமங்கள் இரண்டிற்கும் இடைப்பட்ட பண்புகள் கொண்டுள்ளன. அவை மாழையனை (மாழை போன்றவை) எனப்படும். |
|||
==மாழையிலிகள்== |
|||
*[[ஹைட்ரஜன்]] |
|||
==அலோகங்கள்== |
|||
*[[ஐதரசன்]] |
|||
*[[நெடுங்குழு]] 14ல்: [[கரிமம்]] |
*[[நெடுங்குழு]] 14ல்: [[கரிமம்]] |
||
*நெடுங்குழு 15ல்: [[நைதரசன்]], [[பாசுபரசு]] |
*நெடுங்குழு 15ல்: [[நைதரசன்]], [[பாசுபரசு]] |
||
| வரிசை 13: | வரிசை 15: | ||
*நெடுங்குழு 18ல் எல்லாத் தனிமங்களும் - [[நிறைவுடை வளிமங்கள்]] (Noble gases) |
*நெடுங்குழு 18ல் எல்லாத் தனிமங்களும் - [[நிறைவுடை வளிமங்கள்]] (Noble gases) |
||
== |
==உலோகங்களின் பண்புகள்== |
||
உலோகம், அலோகம் என்னும் பாகுபாடுக்குத் துல்லியமான வரையறைகள் ஏதும் இல்லை. அலோகங்களின் பொதுவான பண்புகள் கீழே காட்டப்பட்டுள்ளன: |
|||
# வெப்பத்தையும், மின்னாற்றலையும் அவ்வளவாகக் கடத்தா (வெப்ப, மின், வன்கடத்திகள்) |
# வெப்பத்தையும், மின்னாற்றலையும் அவ்வளவாகக் கடத்தா (வெப்ப, மின், வன்கடத்திகள்) |
||
| வரிசை 24: | வரிசை 26: | ||
{{தனிம வரிசை அட்டவணை}} |
{{தனிம வரிசை அட்டவணை}} |
||
| ⚫ | தனிம வரிசை அட்டவணையில் அலோகங்கள்:<br/>{{legend|{{Element color|polyatomic nonmetal}}|[[#polyatomic nonmetal|பலவணு அலோகங்கள்]]}}{{legend|{{Element color|diatomic nonmetal}}|[[#Diatomic nonmetals|ஈரணு அலோகங்கள்]]}}{{legend|{{Element color|Noble gas}}|[[#Noble gases|மந்த வாயுக்கள்]]}} அட்டவணையில் [[ஐதரசன்]] தவிர மற்ற அலோகங்கள், [[p-தொகுதி]] யில் அடுக்கப்பட்டுள்ளன. [[ஹீலியம்]], s-தொகுதி தனிமம் பொதுவாக மந்த வாயுக்களுக்கான பண்புகளைப் பெற்றிருப்பதால் [[நியான்| நியானுக்கு மேலாக |
||
[[பகுப்பு:தனிமக் குழுக்கள்]] |
[[பகுப்பு:தனிமக் குழுக்கள்]] |
||
09:34, 30 ஆகத்து 2014 இல் நிலவும் திருத்தம்
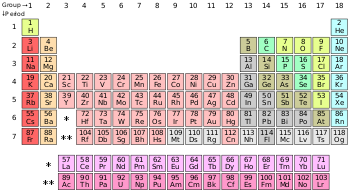
அட்டவணையில் ஐதரசன் தவிர மற்ற அலோகங்கள், p-தொகுதி யில் அடுக்கப்பட்டுள்ளன. ஹீலியம், s-தொகுதி தனிமம் பொதுவாக மந்த வாயுக்களுக்கான பண்புகளைப் பெற்றிருப்பதால் நியானுக்கு மேலாக (p-தொகுதி) வைக்கப்பட்டுள்ளது.
வேதியியலில், அலோகம் அல்லது மாழையிலி (non-metal) என்பது உலோகப் பண்புகளைப் பெற்றிருக்காத வேதியியல் தனிமங்கள் ஆகும். அலோகங்கள் எளிதில் ஆவியாகக் கூடியனவாகவும், வெப்பத்தையும் மின்சாரத்தையும் எளிதில் கடத்தாத காப்புப் பொருட்களாகவும், குறைவான நெகிழ்வுத் தன்மை கொண்டவையாகவும் காணப்படுகின்றன. வேதியியல் பண்புகளின் அடிப்படையில் இவை அதிக அயனியாக்கும் ஆற்றல் மற்றும் இலத்திரன் கவர் ஆற்றல் மதிப்புகளைக் கொண்டுள்ளன. அலோகங்கள் ஏனைய தனிமங்கள் அல்லது சேர்மங்களுடன் வினைபுரியும் போது இலத்திரன்களைப் பெற அல்லது பகிர்ந்து கொள்ள முனைகின்றன.
தனிம அட்டவணையில் சுமார் எண்பதிற்கும் மேலானவை உலோகங்கள் ஆகும். ஆனால், 17 தனிமங்களே பொதுவாக அலோகங்களாக வகைப்படுத்தப்பட்டுள்ளன. இவற்றுள் பெரும்பாலானவை வாயுக்கள். (ஐதரசன், ஈலியம், நைட்ரசன், ஆக்சிசன், புளோரின், நியான், குளோரின், ஆர்கான், கிரிப்டான், செனான் மற்றும் ரேடான்) புரோமின் மட்டும் திரவநிலையில் உள்ளது. கார்பன், பாஸ்பரஸ், கந்தகம், செலினியம் மற்றும் அயோடின் போன்ற வெகுசில அலோகங்கள் திடநிலையில் காணப்படுகின்றன.
தனிம அட்டவணையில் உள்ள ஒவ்வொரு தனிமத்தையும் இயற்பியல் வேதியியல் பண்புகளின் அடிப்படையில் ஒன்று உலோகமாகவோ அல்லது அலோகமாகவோ வகைப்படுத்த முடியும். ஒருசில தனிமங்கள் இரண்டிற்கும் இடைப்பட்ட பண்புகள் கொண்டுள்ளன. அவை மாழையனை (மாழை போன்றவை) எனப்படும்.
அலோகங்கள்
- ஐதரசன்
- நெடுங்குழு 14ல்: கரிமம்
- நெடுங்குழு 15ல்: நைதரசன், பாசுபரசு
- நெடுங்குழு 16ல் உயிர்வளிக்குழுவைச் சேர்ந்தவை: ஆக்சிசன், கந்தகம், செலீனியம்
- நெடுங்குழு 17ல் எல்லாத் தனிமங்களும் - உப்பீனிகள் (ஆலசன்கள்)
- நெடுங்குழு 18ல் எல்லாத் தனிமங்களும் - நிறைவுடை வளிமங்கள் (Noble gases)
உலோகங்களின் பண்புகள்
உலோகம், அலோகம் என்னும் பாகுபாடுக்குத் துல்லியமான வரையறைகள் ஏதும் இல்லை. அலோகங்களின் பொதுவான பண்புகள் கீழே காட்டப்பட்டுள்ளன:
- வெப்பத்தையும், மின்னாற்றலையும் அவ்வளவாகக் கடத்தா (வெப்ப, மின், வன்கடத்திகள்)
- இவை காடி ஆக்சைடுகளாகும் (ஆனால் மாழைகளோ கார ஆக்சைடுகள் ஆகும்)
- திண்மநிலையில் பளபளப்பு ஏதும் இல்லாமலும் (மங்கியதாகவும்), வளையாமல் எளிதில் உடையக்கூடியதாகவும் இருக்கும். (மாழைகள் பளபளம்மாகவும், வளைந்து கொடுக்கவும், தட்டி, கொட்டி நீட்சி பெறச் செய்ய வல்லதாகவும் இருக்கும்)
- அடர்த்திக் குறைவானது (மாழைகளைக் காட்டிலும்)
- குறைந்த உருகுநிலைகளும் கொதிநிலைகளும் கொண்டவை
- அதிக எதிர்மின்னிப்பிணைவீர்ப்பு (electronegativity) கொண்டவை.
