கோபால்ட்(II) நைட்ரேட்டு

| |
| பெயர்கள் | |
|---|---|
| வேறு பெயர்கள்
கோபால்டியஸ் நைட்ரேட்
நைட்ரிக் அமிலத்தின் கோபால்ட்(2+) உப்பு | |
| இனங்காட்டிகள் | |
| 10141-05-6 | |
| ChEBI | CHEBI:86209 |
| ChemSpider | 23369 |
| EC number | 233-402-1 |
| யேமல் -3D படிமங்கள் | Image |
| பப்கெம் | 25000 |
| வே.ந.வி.ப எண் | GG1109000 |
SMILES
| |
| UNII | 65W79BFD5V |
| பண்புகள் | |
| Co(NO3)2 | |
| வாய்ப்பாட்டு எடை | 182.943 கி/மோல் (நீரற்ற சேர்மம்) 291.03 கி/மோல் (எக்சாஐதரேட்டு) |
| தோற்றம் | வெளிர் சிவப்பு நிறத்தூள் (நீரற்ற சேர்மம்) சிவப்பு படிகம் (எக்சாஐதரேட்டு) |
| மணம் | மணமற்றது(எக்சாஐதரேட்டு) |
| அடர்த்தி | 2.49 கி/செமீ3(நீரற்ற சேர்மம்) 1.87 கி/செமீ3 (எக்சாஐதரேட்டு) |
| உருகுநிலை | 100 °C (212 °F; 373 K) சிதைவுறுகிறது (நீரற்ற சேர்மம்) 55 °செ (எக்சாஐதரேட்டு) |
| கொதிநிலை | 100 முதல் 105 °C (212 முதல் 221 °F; 373 முதல் 378 K) நீரற்ற சேர்மம் சிதைவுறுகிறது[சான்று தேவை] 74 °செல்சியசு வெப்பநிலையில் சிதைகிறது (எக்சாஐதரேட்டு) |
| anhydrous:[1] 84.03 கி/100 மிலி (0 °செ) 334.9 கி/100 மிலி (90°செல்சியசு) கரையக்கூடியது (நீரற்ற சேர்மம்) | |
| கரைதிறன் | மதுசாரம், அசிட்டோன், எத்தனால், அமோனியா ஆகியவற்றில் கரைகிறது (எக்சாஐதரேட்டு), மெத்தனால் 2.1 கி/100 மிலி |
| கட்டமைப்பு | |
| ஒருங்கிணைவு வடிவியல் |
ஒற்றைச் சாய்வு (எக்சாஐதரேட்டு) |
| தீங்குகள் | |
| பொருள் பாதுகாப்பு குறிப்பு தாள் | Cobalt (II) Nitrate MSDS |
| ஈயூ வகைப்பாடு | Carc. Cat. 2 Muta. Cat. 3 Repr. Cat. 2 Toxic (T) Dangerous for the environment (N) |
| R-சொற்றொடர்கள் | R49, R60, R42/43, R68, R50/53 |
| S-சொற்றொடர்கள் | S53, S45, S60, S61 |
| Lethal dose or concentration (LD, LC): | |
LD50 (Median dose)
|
434 மிகி/கிகி; எலி, வாய்வழி (நீரற்ற சேர்மம்) 691 மிகி/கிகி; எலி, வாய்வழி (எக்சாஐதரேட்டு) |
| தொடர்புடைய சேர்மங்கள் | |
| ஏனைய எதிர் மின்னயனிகள் | கோபால்ட்(II) சல்பேட்டு கோபால்ட்(II) குளோரைடு கோபால்ட்(II) ஆக்சலேட்டு |
| ஏனைய நேர் மின்அயனிகள் | இரும்பு(III) நைட்ரேட்டு நிக்கல்(II) நைட்ரேட்டு |
மாறுதலாக ஏதும் சொல்லவில்லை என்றால் கொடுக்கப்பட்ட தரவுகள் யாவும் பொருள்கள் அவைகளின் இயல்பான வெப்ப அழுத்த நிலையில் (25°C, 100kPa) இருக்கும். | |
| | |
| Infobox references | |
கோபால்ட் நைட்ரேட்டு (Cobalt Nitrate) என்பது Co (NO3)2 xH2Oஎன்ற மூலக்கூற்று வாய்ப்பாட்டை உடைய ஒரு கனிமச் சேர்மம் ஆகும். இது கோபால்ட் (II) உப்பு ஆகும். மிகவும் பொதுவான வடிவம் Co(NO3)2·6H2O என்ற எக்சாஐதரேட்டு ஆகும். இச்சேர்மம் செம்பழுப்பு நிறமுடைய நீர் உறிஞ்சும் திறன் உடைய நீர் மற்றும் பிற முனைவுத்திறன் கொண்ட கரைப்பான்களில் கரையக்கூடிய உப்பு ஆகும்.[2]
இயைபு மற்றும் கட்டமைப்புகள்[தொகு]
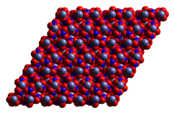
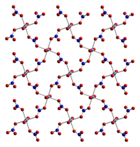
நீரற்ற சேர்மமான Co(NO3)2 மற்றும் கோபால்ட்(II) நைட்ரேட்டின் பல ஐதரேட்டுகளும் உள்ளன. இந்த ஐதரேட்டுகள் Co(NO3)2·n H 2 O என்ற மூலக்கூற்று வாய்ப்பாட்டைக் கொண்டுள்ளன. இங்கு n = 0, 2, 4, 6 ஆகும்.
நீரற்ற கோபால்ட்(II) நைட்ரேட்டு ஒரு முப்பரிமாண பலபடி வலையமைப்பு கட்டமைப்பைக் கொண்டுள்ளது. ஒவ்வொரு கோபால்ட்(II) அணுவும் தோராயமாக எண்முகி வடிவில் ஆறு ஆக்சிசன் அணுக்களால் ஈந்திணைவுப் பிணைப்பால் சூழப்பட்டுள்ளன. இந்த ஆறு ஆக்சிசன் அணுக்களில் ஒவ்வொன்றும் வெவ்வேறு நைட்ரேட் அயனிகளிலிருந்து உள்ளவை ஆகும். ஒவ்வொரு நைட்ரேட்டு அயனியும் மூன்று கோபால்ட் அணுக்களுடன் இணைகின்றன.[3] டைஐதரேட்டு என்பது இரு பரிமாண பலபடி ஆகும். இதில் கோபால்ட்(II) மையங்களுக்கு இடையில் நைட்ரேட் பாலங்களைக் கொண்டுள்ளன. அடுக்குகளை ஒன்றாக வைத்திருக்க ஐதரசன் பிணைப்புகள் உதவுகின்றன. டெட்ராஐதரேட்டு தனித்துவமான, எண்முகி [(H2O)4 Co(NO3)2] மூலக்கூறுகளைக் கொண்டுள்ளது. எக்சா ஐதரேட்டானது எச்சாகோபால்ட் (II) நைட்ரேட், [Co(OH2)6 ] [NO3]2 என விவரிக்கப்படுகிறது. ஏனெனில் இது தனித்துவமான [Co (OH2)6]2+ மற்றும் [NO3] - அயனிகளைக் கொண்டுள்ளது.[4] 55° செல்சியசிற்கு மேல், எக்சாஐதரேட்டு மூவைதரேட்டாகவும் அதிக வெப்பநிலையில் ஒற்றை ஐதரேட்டாகவும் மாறுகிறது.[2]
பயன்கள்[தொகு]
இது பொதுவாக உலோக உயர் தூய்மை கோபால்டாக குறைக்கப்படுகிறது.[2] பிசர்-டிராப்ஸ் வினையூக்கத்தில் பயன்படுத்த பல்வேறு வினையூக்கி துணைப்பொருட்களில் இது உட்கவரப்படலாம்.[5] இது சாயங்கள் மற்றும் மைகளை தயாரிப்பதில் பயன்படுத்தப்படுகிறது.[6]
கோபால்ட் நைட்ரேட்டு சோதனை[தொகு]
கோபால்ட் நைட்ரேட் சோதனை என்பது கரிக்குழி சோதனையின் நீட்டிப்பு ஆகும். கொடுக்கப்பட்ட உப்பை சோடியம் கார்பனேட்டுடன் கலந்து, கரியின் குழிவுப் பகுதியில் வைத்து கலவையை ஒரு ஊது குழலைக் கொண்டு சூடாக்குவதன் மூலம் கரிக்குழி சோதனை செய்யப்படுகிறது. உப்பானது தொடர்புடைய உலோக ஆக்சைடுகளாக மாற்றமடைகிறது. இந்த ஆக்சைடுகள் ஒவ்வொன்றும் தனக்கே உரித்தான வண்ணங்களைக் கொண்டவையாகும். கோபால்ட் நைட்ரேட் சோதனையில், கரிக்குழியில் எஞ்சியிருக்கும் எச்சத்தில் கோபால்ட் நைட்ரேட் கரைசலின் ஒரு துளி சேர்க்கப்படுகிறது. இது ஒரு ஆக்ஸிஜனேற்ற சுடரில் சூடாக்கப்படுகிறது. எரிதலின் போது வெளிப்படும் நிறம் தொடர்புடைய நேரயனியைக் குறிக்கிறது.
உற்பத்தி[தொகு]
எக்சாஐதரேட்டு உலோக கோபால்ட் அல்லது அதன் ஆக்சைடுகள், ஐதராக்சைடுகள் அல்லது கார்பனேட்டுகள் ஆகியவற்றில் ஒன்றுடன் நைட்ரிக் அமிலத்தை வினைப்படுத்துவதன் மூலம் தாயரிக்கப்படுகிறது :
- Co + 4 HNO3 + 4 H2O → Co(H2O)6(NO3)2 + 2 NO2
- CoO + 2 HNO3 + 5 H2O → Co(H 2O)6(NO3)2
- Co CO3 + 2 HNO3 + 5 H2O → Co(H2O)6 (NO3)2 + CO2
வினைதிறன்[தொகு]
அல்கைல் எசுத்தர்கள் மற்றும் உலோக மற்றும் அலோக நைட்ரேட்டுகள் இவற்றின் கலவை அல்கைல் நைட்ரேட்டுகள் உருவாவதன் காரணமாக வெடிக்க நேரிடலாம். பாசுபரசு, வெள்ளீய(II) குளோரைடு அல்லது பிற ஒடுக்கிகளுடன் நைட்ரேட்டின் கலவைகள் வெடிக்கும் விதமாக செயல்படக்கூடும்
பாதுகாப்பு மற்றும் கையாளுதல்[தொகு]
இச்சேர்மத்தை சுவாச வழியாக உள்ளிழுப்பது மூச்சுத் திணறல் மற்றும் இருமலை ஏற்படுத்துகிறது; நிரந்தர இயலாமை ஏற்படலாம். இச்சேர்மத்தை வாய் வழியாக உட்கொள்வது வலி மற்றும் வாந்தியை ஏற்படுத்துகிறது. கண்கள் அல்லது தோலுடன் தொடர்பு ஏற்படும் போது எரிச்சலை ஏற்படுத்துகிறது.[7]
|
|

|

|
குறிப்புகள்[தொகு]
- ↑ Perrys' Chem Eng Handbook, 7th Ed
- ↑ 2.0 2.1 2.2 John Dallas Donaldson, Detmar Beyersmann, "Cobalt and Cobalt Compounds" in Ullmann's Encyclopedia of Industrial Chemistry, Wiley-VCH, Weinheim, 2005. எஆசு:10.1002/14356007.a07_281.pub2
- ↑ Tikhomirov, G. A.; Znamenkov, K. O.; Morozov, I. V.; Kemnitz, E.; Troyanov, S. I. (2002). "Anhydrous Nitrates and Nitrosonium Nitratometallates of Manganese and Cobalt, M(NO3)2, NO[Mn(NO3)3], and (NO)2[Co(NO3)4]: Synthesis and Crystal Structure". Z. anorg. allg. Chem. 628 (1): 269–273. doi:10.1002/1521-3749(200201)628:1<269::AID-ZAAC269>3.0.CO;2-P.
- ↑ Prelesnik, P. V.; Gabela, F.; Ribar, B.; Krstanovic, I. (1973). "Hexaaquacobalt(II) nitrate". Cryst. Struct. Commun. 2 (4): 581–583.
- ↑ Ernst B, Libs S, Chaumette P, Kiennemann A. Appl. Catal. A 186 (1-2): 145-168 1999
- ↑ Lewis, Richard J., Sr. (2002). Hawley's Condensed Chemical Dictionary (14th Edition). John Wiley & Sons. http://www.knovel.com/knovel2/Toc.jsp?BookID=704&VerticalID=0
- ↑ "Cobalt Nitrate".
| HNO3 | He | ||||||||||||||||
| LiNO3 | Be(NO3)2 | B(NO 3)− 4 |
RONO2 | NO− 3 NH4NO3 |
HOONO2 | FNO3 | Ne | ||||||||||
| NaNO3 | Mg(NO3)2 | Al(NO3)3 | Si | P | S | ClONO2 | Ar | ||||||||||
| KNO3 | Ca(NO3)2 | Sc(NO3)3 | Ti(NO3)4 | VO(NO3)3 | Cr(NO3)3 | Mn(NO3)2 | Fe(NO3)2 Fe(NO3)3 |
Co(NO3)2 Co(NO3)3 |
Ni(NO3)2 | CuNO3 Cu(NO3)2 |
Zn(NO3)2 | Ga(NO3)3 | Ge | As | Se | BrNO3 | Kr |
| RbNO3 | Sr(NO3)2 | Y(NO3)3 | Zr(NO3)4 | Nb | Mo | Tc | Ru(NO3)3 | Rh(NO3)3 | Pd(NO3)2 Pd(NO3)4 |
AgNO3 Ag(NO3)2 |
Cd(NO3)2 | In(NO3)3 | Sn(NO3)4 | Sb(NO3)3 | Te | INO3 | Xe(NO3)2 |
| CsNO3 | Ba(NO3)2 | Hf(NO3)4 | Ta | W | Re | Os | Ir | Pt(NO3)2 Pt(NO3)4 |
Au(NO3)3 | Hg2(NO3)2 Hg(NO3)2 |
TlNO3 Tl(NO3)3 |
Pb(NO3)2 | Bi(NO3)3 BiO(NO3) |
Po(NO3)4 | At | Rn | |
| FrNO3 | Ra(NO3)2 | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | |
| ↓ | |||||||||||||||||
| La(NO3)3 | Ce(NO3)3 Ce(NO3)4 |
Pr(NO3)3 | Nd(NO3)3 | Pm(NO3)3 | Sm(NO3)3 | Eu(NO3)3 | Gd(NO3)3 | Tb(NO3)3 | Dy(NO3)3 | Ho(NO3)3 | Er(NO3)3 | Tm(NO3)3 | Yb(NO3)3 | Lu(NO3)3 | |||
| Ac(NO3)3 | Th(NO3)4 | PaO2(NO3)3 | UO2(NO3)2 | Np(NO3)4 | Pu(NO3)4 | Am(NO3)3 | Cm(NO3)3 | Bk(NO3)3 | Cf | Es | Fm | Md | No | Lr | |||
