சோடியம் சல்பேட்டு: திருத்தங்களுக்கு இடையிலான வேறுபாடு
No edit summary |
|||
| வரிசை 1: | வரிசை 1: | ||
{{cleanup may 2017}} |
{{cleanup may 2017}} |
||
{{Chembox|Name=சோடியம் சல்பேட்<br>|ImageFileL1=Sodium sulfate.jpg|ImageFileR1=Sodium sulfate.png|ImageName=Sodium sulfate|ImageSize=150px|OtherNames=[[Thenardite]] (mineral)<br/>Glauber's salt (decahydrate)<br/>Sal mirabilis (decahydrate)<br/>[[Mirabilite]] (decahydrate)<br/>Disodium sulfate|Section1={{Chembox Identifiers | UNII_Ref = {{fdacite|correct|FDA}} | UNII = 36KCS0R750 | InChI = 1S/2Na.H2O4S/c;;1-5(2,3)4/h;;(H2,1,2,3,4)/q2*+1;/p-2 | InChIKey1 = PMZURENOXWZQFD-UHFFFAOYSA-L | InChI1 = 1S/2Na.H2O4S/c;;1-5(2,3)4/h;;(H2,1,2,3,4)/q2*+1;/p-2 | CASNo = 7757-82-6 | CASNo_Ref = {{cascite|correct|CAS}} | CASNo2_Ref = {{cascite|changed|??}} | CASNo2 = 7727-73-3 | CASNo2_Comment = (decahydrate) | ChEMBL_Ref = {{ebicite|correct|EBI}} | ChEMBL = 233406 | PubChem = 24436 | RTECS = WE1650000 | ChemSpiderID_Ref = {{chemspidercite|correct|chemspider}} | ChemSpiderID = 22844 | ChEBI_Ref = {{ebicite|correct|EBI}} | ChEBI = 32149 | StdInChIKey_Ref = {{stdinchicite|correct|chemspider}} | StdInChIKey = PMZURENOXWZQFD-UHFFFAOYSA-L | SMILES = [Na+].[Na+].[O-]S([O-])(=O)=O | StdInChI_Ref = {{stdinchicite|correct|chemspider}} | StdInChI = 1S/2Na.H2O4S/c;;1-5(2,3)4/h;;(H2,1,2,3,4)/q2*+1;/p-2 }}|Section2={{Chembox Properties | Formula = Na<sub>2</sub>SO<sub>4</sub> | MolarMass = 142.04 g/mol (anhydrous)<br/>322.20 g/mol (decahydrate) | Appearance = white crystalline solid <br> [[ |
{{Chembox|Name=சோடியம் சல்பேட்<br>|ImageFileL1=Sodium sulfate.jpg|ImageFileR1=Sodium sulfate.png|ImageName=Sodium sulfate|ImageSize=150px|OtherNames=[[Thenardite]] (mineral)<br/>Glauber's salt (decahydrate)<br/>Sal mirabilis (decahydrate)<br/>[[Mirabilite]] (decahydrate)<br/>Disodium sulfate|Section1={{Chembox Identifiers | UNII_Ref = {{fdacite|correct|FDA}} | UNII = 36KCS0R750 | InChI = 1S/2Na.H2O4S/c;;1-5(2,3)4/h;;(H2,1,2,3,4)/q2*+1;/p-2 | InChIKey1 = PMZURENOXWZQFD-UHFFFAOYSA-L | InChI1 = 1S/2Na.H2O4S/c;;1-5(2,3)4/h;;(H2,1,2,3,4)/q2*+1;/p-2 | CASNo = 7757-82-6 | CASNo_Ref = {{cascite|correct|CAS}} | CASNo2_Ref = {{cascite|changed|??}} | CASNo2 = 7727-73-3 | CASNo2_Comment = (decahydrate) | ChEMBL_Ref = {{ebicite|correct|EBI}} | ChEMBL = 233406 | PubChem = 24436 | RTECS = WE1650000 | ChemSpiderID_Ref = {{chemspidercite|correct|chemspider}} | ChemSpiderID = 22844 | ChEBI_Ref = {{ebicite|correct|EBI}} | ChEBI = 32149 | StdInChIKey_Ref = {{stdinchicite|correct|chemspider}} | StdInChIKey = PMZURENOXWZQFD-UHFFFAOYSA-L | SMILES = [Na+].[Na+].[O-]S([O-])(=O)=O | StdInChI_Ref = {{stdinchicite|correct|chemspider}} | StdInChI = 1S/2Na.H2O4S/c;;1-5(2,3)4/h;;(H2,1,2,3,4)/q2*+1;/p-2 }}|Section2={{Chembox Properties | Formula = Na<sub>2</sub>SO<sub>4</sub> | MolarMass = 142.04 g/mol (anhydrous)<br/>322.20 g/mol (decahydrate) | Appearance = white crystalline solid <br> [[நீர் உறிஞ்சும் திறன்]] | Odor = odorless | Density = 2.664 g/cm<sup>3</sup> (anhydrous)<br/>1.464 g/cm<sup>3</sup> (decahydrate) | Solubility = ''anhydrous:'' <br> 4.76 g/100 mL (0 °C)<br />13.9 g/100 mL (20 °C)<ref>{{cite web|url=http://pubs.acs.org/doi/pdf/10.1021/je980243v|publisher=American Chemical Society}}</ref><br>42.7 g/100 mL (100 °C) <hr> ''heptahydrate:'' <br> 19.5 g/100 mL (0 °C) <br> 44 g/100 mL (20 °C) | SolubleOther = insoluble in [[எத்தனால்]] <br> soluble in [[கிளிசரால்]], [[நீர்]] and [[ஐதரசன் அயோடைடு]] | MeltingPtC = 884 | MeltingPt_notes = (anhydrous) <br> 32.38 °C (decahydrate) | BoilingPtC = 1429 | BoilingPt_notes = (anhydrous) | RefractIndex = 1.468 (anhydrous) <br> 1.394 (decahydrate) | MagSus = −52.0·10<sup>−6</sup> cm<sup>3</sup>/mol }}|Section3={{Chembox Structure | Coordination = | CrystalStruct = [[orthorhombic]] or [[Hexagonal crystal system|hexagonal]] (anhydrous) <br> [[monoclinic]] (decahydrate) }}|Section6={{Chembox Pharmacology | ATCCode_prefix = A06 | ATCCode_suffix = AD13 | ATC_Supplemental = {{ATC|A12|CA02}} }}|Section7={{Chembox Hazards | ExternalSDS = [http://www.ilo.org/public/english/protection/safework/cis/products/icsc/dtasht/_icsc09/icsc0952.htm ICSC 0952] | MainHazards = Irritant | NFPA-H = 1 | NFPA-F = 0 | NFPA-R = 0 | FlashPt = Non-flammable }}|Section8={{Chembox Related | OtherAnions = [[Sodium selenate]]<br/>[[Sodium tellurate]] | OtherCations = [[இலித்தியம் சல்பேட்டு]]<br/>[[Potassium sulfate]]<br/>[[Rubidium sulfate]]<br/>[[சீசியம் சல்பேட்டு]] | OtherCompounds = [[Sodium bisulfate]]<br/>[[Sodium sulfite]]<br/>[[Sodium persulfate]] }}|Verifiedfields=changed|Watchedfields=changed|verifiedrevid=477315271}} |
||
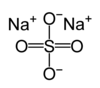
'''சோடியம் சல்பேட்''' Na<sub>2</sub>SO<sub>4 என்ற மூலக்கூறு வாய்ப்பாட்டை உடைய கனிம சேர்மம். இது சோடாவின் சல்பேட் எனவும் அழைக்கப்படுகிறது. மேலும் பல்வேறு ஐதரேட்டுகளையும் கொண்டுள்ளது. அனைத்து வடிவங்களும் வெண்மை நிறத் திண்மங்கள் மற்றும் நீரில் எளிதில் கரையும் தன்மையுடையவை. டெகாஐதரேட்டானது அதிகமாக உற்பத்தி செய்யக்கூடிய அதாவது ஆண்டொன்றுக்கு 6 மில்லியன் டன்கள் உற்பத்தியாகக்கூடிய வேதிச்சேர்மமாக உள்ளது. இந்தச் சேர்மமானது அதிக அளவில் துாய்மையாக்கிகள் தயாரிப்பிலும், காகிதத்தை சுத்தம் செய்யும் க்ராப்ட் முறையிலும் பயன்படுகிறது. </sub><ref>Helmold Plessen "Sodium Sulfates" in Ullmann's Encyclopedia Of Industrial Chemistry Wiley-VCH, 2000, Weinheim. {{Doi|10.1002/14356007.a24_355}}</ref> |
'''சோடியம் சல்பேட்''' Na<sub>2</sub>SO<sub>4 என்ற மூலக்கூறு வாய்ப்பாட்டை உடைய கனிம சேர்மம். இது சோடாவின் சல்பேட் எனவும் அழைக்கப்படுகிறது. மேலும் பல்வேறு ஐதரேட்டுகளையும் கொண்டுள்ளது. அனைத்து வடிவங்களும் வெண்மை நிறத் திண்மங்கள் மற்றும் நீரில் எளிதில் கரையும் தன்மையுடையவை. டெகாஐதரேட்டானது அதிகமாக உற்பத்தி செய்யக்கூடிய அதாவது ஆண்டொன்றுக்கு 6 மில்லியன் டன்கள் உற்பத்தியாகக்கூடிய வேதிச்சேர்மமாக உள்ளது. இந்தச் சேர்மமானது அதிக அளவில் துாய்மையாக்கிகள் தயாரிப்பிலும், காகிதத்தை சுத்தம் செய்யும் க்ராப்ட் முறையிலும் பயன்படுகிறது. </sub><ref>Helmold Plessen "Sodium Sulfates" in Ullmann's Encyclopedia Of Industrial Chemistry Wiley-VCH, 2000, Weinheim. {{Doi|10.1002/14356007.a24_355}}</ref> |
||
| வரிசை 15: | வரிசை 15: | ||
==இயற்பியல் மற்றும் வேதிப்பண்புகள்== |
==இயற்பியல் மற்றும் வேதிப்பண்புகள்== |
||
சாதாரண வெப்பநிலைகளில் சோடியம் சல்பேட்டானது ஆக்சிஜனேற்றிகள் மற்றும் ஒடுக்க வினைபொருட்களுடன் வினைபுரியும் தன்மையற்று நிலையான சேர்மமாக உள்ளது. உயர் வெப்பநிலைகளில் கார்போவெப்ப ஒடுக்க வினைகளின் மூலமாக சோடியம் சல்பைடாக மாற்றமடைகிறது. <ref name='crc'>{{cite book|title = Handbook of Chemistry and Physics|edition = 71st|publisher = [[CRC Press]]|location = [[ |
சாதாரண வெப்பநிலைகளில் சோடியம் சல்பேட்டானது ஆக்சிஜனேற்றிகள் மற்றும் ஒடுக்க வினைபொருட்களுடன் வினைபுரியும் தன்மையற்று நிலையான சேர்மமாக உள்ளது. உயர் வெப்பநிலைகளில் கார்போவெப்ப ஒடுக்க வினைகளின் மூலமாக சோடியம் சல்பைடாக மாற்றமடைகிறது. <ref name='crc'>{{cite book|title = Handbook of Chemistry and Physics|edition = 71st|publisher = [[CRC Press]]|location = [[ஏன் ஆர்பர் (மிச்சிகன்)]], [[மிச்சிகன்]]|year = 1990}}</ref> |
||
: Na<sub>2</sub>SO<sub>4</sub> + 2 C → Na<sub>2</sub>S + 2 CO<sub>2</sub> |
: Na<sub>2</sub>SO<sub>4</sub> + 2 C → Na<sub>2</sub>S + 2 CO<sub>2</sub> |
||
===அமில-கார வினைகள்=== |
===அமில-கார வினைகள்=== |
||
| வரிசை 22: | வரிசை 22: | ||
இந்த வினைக்கான சமநிலை மாறிலியானது செறிவு மற்றும் வெப்பநிலையைச் சார்ந்தே உள்ளது. |
இந்த வினைக்கான சமநிலை மாறிலியானது செறிவு மற்றும் வெப்பநிலையைச் சார்ந்தே உள்ளது. |
||
===கரைதிறன் மற்றும் அயனிப்பரிமாற்றம்=== |
===கரைதிறன் மற்றும் அயனிப்பரிமாற்றம்=== |
||
சோடியம் சல்பேட்டானது வழக்கத்திற்கு மாறான நீரில் கரைதிறன் பண்புகளைக் கொண்டுள்ளது. <ref>{{cite book|first = W.F.|last = Linke|author2=A. Seidell |title = Solubilities of Inorganic and Metal Organic Compounds|edition = 4th|publisher = Van Nostrand|year = 1965|isbn = 0-8412-0097-1}}</ref> நீரில் இதனுடைய கரைதிறனானது 0 °C முதல் 32.384 °C வரையிலான வெப்பநிலையில் பத்து மடங்குக்கும் மேலாக அதிகரிக்கிறது. இது அதிகபட்சநிலையை 49.7 g/100 mL இல் அதிகரிக்கிறது. இந்த வெப்பநிலையில் கரைதிறன் வளைவின் சாய்வு மாறுகிறது. மேலும், இந்த நிலையில் கரைதிறனானது, வெப்பநிலையைப் பொறுத்து மாறாத நிலையைப் பெறுகிறது. 32.384 °C யில் வெப்பநிலையானது படிகத்தில் உள்ள நீரானது வெளியேறக்கூடிய, நீரேற்றப்பட்ட உப்பு உருகக்கூடிய வெப்பநிலையாகும். இந்த வெப்பநிலை வெப்பநிலைமானிகளில் அளவுகள் குறிப்பதற்கு மிகத் துல்லியமான ஒரு நிலையாகப் பயன்படுகிறது. சோடியம் சல்பேட்டானது, நிலைமின்னியல் கவர்ச்சியை அடிப்படையாகக் கொண்ட, சோடியம் Na<sup>+</sup> அயனியையும், சல்பேட் SO<sub>4</sub><sup>2−</sup> அயனியையும் கொண்ட அயனிப்பிணைப்பு சேர்மமாகும். சல்பேட் அயனிகளின் இருப்பினை பேரியம் [[ |
சோடியம் சல்பேட்டானது வழக்கத்திற்கு மாறான நீரில் கரைதிறன் பண்புகளைக் கொண்டுள்ளது. <ref>{{cite book|first = W.F.|last = Linke|author2=A. Seidell |title = Solubilities of Inorganic and Metal Organic Compounds|edition = 4th|publisher = Van Nostrand|year = 1965|isbn = 0-8412-0097-1}}</ref> நீரில் இதனுடைய கரைதிறனானது 0 °C முதல் 32.384 °C வரையிலான வெப்பநிலையில் பத்து மடங்குக்கும் மேலாக அதிகரிக்கிறது. இது அதிகபட்சநிலையை 49.7 g/100 mL இல் அதிகரிக்கிறது. இந்த வெப்பநிலையில் கரைதிறன் வளைவின் சாய்வு மாறுகிறது. மேலும், இந்த நிலையில் கரைதிறனானது, வெப்பநிலையைப் பொறுத்து மாறாத நிலையைப் பெறுகிறது. 32.384 °C யில் வெப்பநிலையானது படிகத்தில் உள்ள நீரானது வெளியேறக்கூடிய, நீரேற்றப்பட்ட உப்பு உருகக்கூடிய வெப்பநிலையாகும். இந்த வெப்பநிலை வெப்பநிலைமானிகளில் அளவுகள் குறிப்பதற்கு மிகத் துல்லியமான ஒரு நிலையாகப் பயன்படுகிறது. சோடியம் சல்பேட்டானது, நிலைமின்னியல் கவர்ச்சியை அடிப்படையாகக் கொண்ட, சோடியம் Na<sup>+</sup> அயனியையும், சல்பேட் SO<sub>4</sub><sup>2−</sup> அயனியையும் கொண்ட அயனிப்பிணைப்பு சேர்மமாகும். சல்பேட் அயனிகளின் இருப்பினை பேரியம் [[பேரியம்|Ba<sup>2+</sup>]] மற்றும் காரீய அயனிகளின் [[ஈயம்|Pb<sup>2+</sup>]] உப்புக்களோடு வினைபுரியும் போது கரையாத சல்பேட்டுகள் உருவாவதிலிருந்து உறுதிப்படுத்தப்படலாம். |
||
: Na<sub>2</sub>SO<sub>4</sub> + BaCl<sub>2</sub> → 2 NaCl + BaSO<sub>4</sub> |
: Na<sub>2</sub>SO<sub>4</sub> + BaCl<sub>2</sub> → 2 NaCl + BaSO<sub>4</sub> |
||
[[File:Na2SO4 solubility.png|thumb|சோடியம் சல்பேட்டின் Na<sub>2</sub>SO<sub>4</sub> கரைதிறன் Vs வெப்பநிலை - வரைபடம்]] |
[[File:Na2SO4 solubility.png|thumb|சோடியம் சல்பேட்டின் Na<sub>2</sub>SO<sub>4</sub> கரைதிறன் Vs வெப்பநிலை - வரைபடம்]] |
||
02:13, 3 சூன் 2017 இல் நிலவும் திருத்தம்
மே 2017ல் உருவான இக்கட்டுரை தமிழக ஆசிரியர்களுக்கான விக்கிப்பீடியா பங்களிப்புப் பயிற்சிகள் மூலம் உருவாக்கப்பட்டிருக்கலாம். இக்கட்டுரை அல்லது இக்கட்டுரையின் பகுதி விக்கிப்பீடியாவின் கட்டுரைகளைப் போல் இல்லை. விக்கிப்பீடியாவில் எத்தகைய தலைப்புகளில் கட்டுரைகள் எழுதலாம் என்பதற்கு எடுத்துக்காட்டுத் தலைப்புகளைப் பார்க்கவும். ஒரு கட்டுரையை எப்படி எழுத வேண்டும் என்ற அறிய மாதிரிக் கட்டுரைகளைக் காண்க. கட்டுரையை மேம்படுத்துவது தொடர்பான ஆலோசனைகளுக்கு இக்கட்டுரையின் பேச்சுப் பக்கத்தையோ அல்லது உங்கள் பயனர் பேச்சுப் பக்கத்தையோ கவனியுங்கள். தொகுத்தலுக்கான உதவிப் பக்கம், நடைக் கையேடு ஆகியவற்றைப் படித்தறிந்து, இந்தக் கட்டுரையைச் செம்மைப்படுத்தி உதவலாம். கூடுதல் உதவி தேவை எனில் ஒத்தாசைப் பக்கத்தில் கேளுங்கள். |
| |||
| பெயர்கள் | |||
|---|---|---|---|
| வேறு பெயர்கள்
Thenardite (mineral)
Glauber's salt (decahydrate) Sal mirabilis (decahydrate) Mirabilite (decahydrate) Disodium sulfate | |||
| இனங்காட்டிகள் | |||
| 7757-82-6 7727-73-3 (decahydrate) | |||
| ChEBI | CHEBI:32149 | ||
| ChEMBL | ChEMBL233406 | ||
| ChemSpider | 22844 | ||
| யேமல் -3D படிமங்கள் | Image | ||
| பப்கெம் | 24436 | ||
| வே.ந.வி.ப எண் | WE1650000 | ||
SMILES
| |||
| UNII | 36KCS0R750 | ||
| பண்புகள் | |||
| Na2SO4 | |||
| வாய்ப்பாட்டு எடை | 142.04 g/mol (anhydrous) 322.20 g/mol (decahydrate) | ||
| தோற்றம் | white crystalline solid நீர் உறிஞ்சும் திறன் | ||
| மணம் | odorless | ||
| அடர்த்தி | 2.664 g/cm3 (anhydrous) 1.464 g/cm3 (decahydrate) | ||
| உருகுநிலை | 884 °C (1,623 °F; 1,157 K) (anhydrous) 32.38 °C (decahydrate) | ||
| கொதிநிலை | 1,429 °C (2,604 °F; 1,702 K) (anhydrous) | ||
| anhydrous: 4.76 g/100 mL (0 °C) 13.9 g/100 mL (20 °C)[1] 42.7 g/100 mL (100 °C) heptahydrate: 19.5 g/100 mL (0 °C) 44 g/100 mL (20 °C) | |||
| கரைதிறன் | insoluble in எத்தனால் soluble in கிளிசரால், நீர் and ஐதரசன் அயோடைடு | ||
| −52.0·10−6 cm3/mol | |||
| ஒளிவிலகல் சுட்டெண் (nD) | 1.468 (anhydrous) 1.394 (decahydrate) | ||
| கட்டமைப்பு | |||
| படிக அமைப்பு | orthorhombic or hexagonal (anhydrous) monoclinic (decahydrate) | ||
| தீங்குகள் | |||
| முதன்மையான தீநிகழ்தகவுகள் | Irritant | ||
| பொருள் பாதுகாப்பு குறிப்பு தாள் | ICSC 0952 | ||
| தீப்பற்றும் வெப்பநிலை | Non-flammable | ||
| தொடர்புடைய சேர்மங்கள் | |||
| ஏனைய எதிர் மின்னயனிகள் | Sodium selenate Sodium tellurate | ||
| ஏனைய நேர் மின்அயனிகள் | இலித்தியம் சல்பேட்டு Potassium sulfate Rubidium sulfate சீசியம் சல்பேட்டு | ||
மாறுதலாக ஏதும் சொல்லவில்லை என்றால் கொடுக்கப்பட்ட தரவுகள் யாவும் பொருள்கள் அவைகளின் இயல்பான வெப்ப அழுத்த நிலையில் (25°C, 100kPa) இருக்கும். | |||
| | |||
| Infobox references | |||
சோடியம் சல்பேட் Na2SO4 என்ற மூலக்கூறு வாய்ப்பாட்டை உடைய கனிம சேர்மம். இது சோடாவின் சல்பேட் எனவும் அழைக்கப்படுகிறது. மேலும் பல்வேறு ஐதரேட்டுகளையும் கொண்டுள்ளது. அனைத்து வடிவங்களும் வெண்மை நிறத் திண்மங்கள் மற்றும் நீரில் எளிதில் கரையும் தன்மையுடையவை. டெகாஐதரேட்டானது அதிகமாக உற்பத்தி செய்யக்கூடிய அதாவது ஆண்டொன்றுக்கு 6 மில்லியன் டன்கள் உற்பத்தியாகக்கூடிய வேதிச்சேர்மமாக உள்ளது. இந்தச் சேர்மமானது அதிக அளவில் துாய்மையாக்கிகள் தயாரிப்பிலும், காகிதத்தை சுத்தம் செய்யும் க்ராப்ட் முறையிலும் பயன்படுகிறது. [2]
வடிவங்கள்
- டெகாஐதரேட், மிராபிலைட் என்ற கனிமமாக வேதித்தொழில் துறையில் பயன்படுகிறது. இது கிளாபரின் உப்பு எனவும் அழைக்கப்படுகிறது.
- தெனார்டைட் எனப்படுகின்ற அரிய வகை கனிமமாக, நீரற்ற வடிவமாக, காணப்படுகிறது.கரிமச்சேர்மங்களின் தொகுப்புமுறைகளில் உலர்த்தும் காரணியாகப் பயன்படுகிறது..
- கெப்டாஐதரேட் எனப்படும் மிக அரிய வடிவம்.
வரலாறு
சோடியம் சல்பேட்டின் டெகாஐதரேட்டானது நெதர்லாந்து/செருமனி நாட்டைச் சேர்ந்த வேதியியலாளா் அபோதேகாரி ஜோகன் ரூடால்ப் கிளாபர் (1604–1670) என்பவரால் ஆசுதிரிய நாட்டின் நீரூற்றுகளில் காணப்படும் நீரில் இருந்து கண்டுபிடிக்கப்பட்டது. இதன் காரணமாக இந்த உப்பானது கிளாபரின் உப்பு என அழைக்கப்பட்டது. .அவா் இந்த உப்பிற்கு இதன் மருத்துவப் பண்புகள் காரணமாக சால் மிராபிலிசு (அதிசய உப்பு) எனப் பெயரிட்டார். 1900 ஆண்டுகளில் வேறு திறன் படைத்த மலமிளக்கிகள் உபயோகத்திற்கு வருவதற்கு முன்னதாக, சோடியம் சல்பேட்டானது பொதுவான மலமிளக்கியாகப் பயன்படுத்தப்பட்டு வந்தன. [3][4]
18 ஆம் நுாற்றாண்டில், வேதித்தொழிற்துறையில் சோடியம் கார்பனேட் தயாரிப்பில் கிளாபரின் உப்பு அதிக அளவில் பயன்படுத்தப்பட்டது. பொட்டாசியம் கார்பனேட்டுடன் இந்த உப்பினை வினைப்படுத்தி சோடியம் கார்பனேட் தயாரிக்கப்பட்டது. சோடா சாம்பலின் (சோடியம் கார்பனேட்) தேவை அதிகரிக்க, அதிகரிக்க சோடியம் சல்பேட்டின் உற்பத்தி அளவும் அதிகரித்தது. பத்தொன்பதாம் நுாற்றாண்டில், லெப்லாங்கு முறை அதிக அளவில் சோடா சாம்பலைத் தயாரிக்கும் முறையாக மாறியது. இந்த முறையில் முக்கிய இடைவினைபொருளாக சோடியம் சல்பேட்டானது தொகுப்பு முறையில் தயாரிக்கப்பட்டது. [5]
இயற்பியல் மற்றும் வேதிப்பண்புகள்
சாதாரண வெப்பநிலைகளில் சோடியம் சல்பேட்டானது ஆக்சிஜனேற்றிகள் மற்றும் ஒடுக்க வினைபொருட்களுடன் வினைபுரியும் தன்மையற்று நிலையான சேர்மமாக உள்ளது. உயர் வெப்பநிலைகளில் கார்போவெப்ப ஒடுக்க வினைகளின் மூலமாக சோடியம் சல்பைடாக மாற்றமடைகிறது. [6]
- Na2SO4 + 2 C → Na2S + 2 CO2
அமில-கார வினைகள்
சோடியம் சல்பேட்டானது நடுநிலையான உப்பாகும். இதன் நீரிய கரைசல்கள் pH மதிப்பு 7 ஆக உள்ளது. இத்தகைய கரைசல்களின் நடுநிலைத்தன்மையானது சல்பேட்டானது வலிமை மிக்க அமிலங்களிலிருந்து, அதாவது கந்தக அமிலத்திலிருந்து பெறப்பட்டிருக்கலாம் என்பது தெரிகிறது. மேலும், Na+ அயனியானது, உலோக அயனிகள் நீர்க்கரைசல்களில் இருக்கும் போது ஒரே ஒரு நேர்மின் சுமையுடன் நீர் மூலக்கூறுகளை மிகவும் பலவீனமாக முனைவுறுத்துகிறது. சோடியம் சல்பேட்டானது கந்தக அமிலத்துடன் வினைபுரிந்து சோடியம் பை சல்பேட் எனும் அமில உப்பைத் தருகிறது. [7][8]
- Na2SO4 + H2SO4 ⇌ 2 NaHSO4
இந்த வினைக்கான சமநிலை மாறிலியானது செறிவு மற்றும் வெப்பநிலையைச் சார்ந்தே உள்ளது.
கரைதிறன் மற்றும் அயனிப்பரிமாற்றம்
சோடியம் சல்பேட்டானது வழக்கத்திற்கு மாறான நீரில் கரைதிறன் பண்புகளைக் கொண்டுள்ளது. [9] நீரில் இதனுடைய கரைதிறனானது 0 °C முதல் 32.384 °C வரையிலான வெப்பநிலையில் பத்து மடங்குக்கும் மேலாக அதிகரிக்கிறது. இது அதிகபட்சநிலையை 49.7 g/100 mL இல் அதிகரிக்கிறது. இந்த வெப்பநிலையில் கரைதிறன் வளைவின் சாய்வு மாறுகிறது. மேலும், இந்த நிலையில் கரைதிறனானது, வெப்பநிலையைப் பொறுத்து மாறாத நிலையைப் பெறுகிறது. 32.384 °C யில் வெப்பநிலையானது படிகத்தில் உள்ள நீரானது வெளியேறக்கூடிய, நீரேற்றப்பட்ட உப்பு உருகக்கூடிய வெப்பநிலையாகும். இந்த வெப்பநிலை வெப்பநிலைமானிகளில் அளவுகள் குறிப்பதற்கு மிகத் துல்லியமான ஒரு நிலையாகப் பயன்படுகிறது. சோடியம் சல்பேட்டானது, நிலைமின்னியல் கவர்ச்சியை அடிப்படையாகக் கொண்ட, சோடியம் Na+ அயனியையும், சல்பேட் SO42− அயனியையும் கொண்ட அயனிப்பிணைப்பு சேர்மமாகும். சல்பேட் அயனிகளின் இருப்பினை பேரியம் Ba2+ மற்றும் காரீய அயனிகளின் Pb2+ உப்புக்களோடு வினைபுரியும் போது கரையாத சல்பேட்டுகள் உருவாவதிலிருந்து உறுதிப்படுத்தப்படலாம்.
- Na2SO4 + BaCl2 → 2 NaCl + BaSO4

சோடியம் சல்பேட்டானது இரட்டை உப்புக்களை உருவாக்குவதற்கான போக்கினை மிதமாகவே காட்டுகிறது. பல நிலையான படிகார இரட்டை உப்புக்களை உருவாக்கக்கூடிய பொட்டாசியம் சல்பேட் மற்றும் அம்மோனியம் சல்பேட் போல இல்லாமல் சோடியம் சல்பேட்டானது, NaAl(SO4)2 ( 39 °C வெப்பநிலைக்கு மேல் நிலையற்றது) மற்றும் NaCr(SO4)2 ஆகிய படிகார உப்புக்களை மட்டுமே பொதுவான மும்மை இணைதிறன் கொண்ட உலோகங்களுடன் உருவாக்குகின்றது. [10]
References
- ↑ . American Chemical Society http://pubs.acs.org/doi/pdf/10.1021/je980243v.
{{cite web}}: Missing or empty|title=(help) - ↑ Helmold Plessen "Sodium Sulfates" in Ullmann's Encyclopedia Of Industrial Chemistry Wiley-VCH, 2000, Weinheim. எஆசு:10.1002/14356007.a24_355
- ↑ Szydlo, Zbigniew (1994). Water which does not wet hands: The Alchemy of Michael Sendivogius. London–Warsaw: Polish Academy of Sciences.
- ↑ Westfall, Richard S. (1995). "Glauber, Johann Rudolf". The Galileo Project.
- ↑ Aftalion, Fred (1991). A History of the International Chemical Industry. Philadelphia: University of Pennsylvania Press. pp. 11–16. பன்னாட்டுத் தரப்புத்தக எண் 0-8122-1297-5.
- ↑ Handbook of Chemistry and Physics (71st ed.). ஏன் ஆர்பர் (மிச்சிகன்), மிச்சிகன்: CRC Press. 1990.
- ↑ The Merck Index (7th ed.). Rahway, New Jersey, US: Merck & Co. 1960.
- ↑ Nechamkin, Howard (1968). The Chemistry of the Elements. New York: McGraw-Hill.
- ↑ Linke, W.F.; A. Seidell (1965). Solubilities of Inorganic and Metal Organic Compounds (4th ed.). Van Nostrand. பன்னாட்டுத் தரப்புத்தக எண் 0-8412-0097-1.
- ↑ Henry Lipson; C. Arnold Beevers (1935). "The Crystal Structure of the Alums". Proceedings of the Royal Society A 148 (865): 664–80. doi:10.1098/rspa.1935.0040.