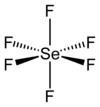
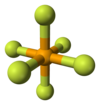
செலீனியம் அறுபுளோரைடு
| |||
| பெயர்கள் | |||
|---|---|---|---|
| ஐயூபிஏசி பெயர்
Selenium hexafluoride
| |||
| வேறு பெயர்கள்
செலீனியம்(VI) புளோரைடு, செலீனியம் புளோரைடு
| |||
| இனங்காட்டிகள் | |||
| 7783-79-1 | |||
| ChemSpider | 22964 | ||
InChI
| |||
| யேமல் -3D படிமங்கள் | Image | ||
| பப்கெம் | 24558 | ||
| வே.ந.வி.ப எண் | VS9450000 | ||
| |||
| UNII | H91D37I668 | ||
| பண்புகள் | |||
| SeF6 | |||
| வாய்ப்பாட்டு எடை | 192.9534 கி/மோல் | ||
| தோற்றம் | நிறமற்ற வாயு | ||
| அடர்த்தி | 0.007887 கி/செ.மி3[1] | ||
| உருகுநிலை | −39 °C (−38 °F; 234 K) | ||
| கொதிநிலை | −34.5 °C (−30.1 °F; 238.7 K) பதங்கமாகும் | ||
| கரையாது | |||
| ஆவியமுக்கம் | >1 வளிமண்டல அழுத்தம் (20°செல்சியசு)[2] | ||
| −51.0·10−6 cm3/mol | |||
| ஒளிவிலகல் சுட்டெண் (nD) | 1.895 | ||
| கட்டமைப்பு | |||
| படிக அமைப்பு | செஞ்சாய்சதுரம், oP28 | ||
| புறவெளித் தொகுதி | Pnma, No. 62 | ||
| ஒருங்கிணைவு வடிவியல் |
எண்முகம் (Oh) | ||
| இருமுனைத் திருப்புமை (Dipole moment) | 0 | ||
| வெப்பவேதியியல் | |||
| Std enthalpy of formation ΔfH |
-1030 கியூல்/மோல்[3] | ||
| தீங்குகள் | |||
| முதன்மையான தீநிகழ்தகவுகள் | நச்சு,அரிக்கும் | ||
| Lethal dose or concentration (LD, LC): | |||
LCLo (Lowest published)
|
மில்லியனுக்கு 10 பகுதிகள் (எலி, 1 மணி) மில்லியனுக்கு 10 பகுதிகள் (சுண்டெலி, 1 மணி) மில்லியனுக்கு 10 பகுதிகள் (கினியா பன்றி, 1 மணி)[4] | ||
| அமெரிக்க சுகாதார ஏற்பு வரம்புகள்: | |||
அனுமதிக்கத்தக்க வரம்பு
|
தாங்கும் அளவு மில்லியனுக்கு 0.05 பகுதிகள் (0.4 மி.கி/மீ3)[2] | ||
பரிந்துரைக்கப்பட்ட வரம்பு
|
தாங்கும் அளவு மில்லியனுக்கு 0.05 பகுதிகள்[2] | ||
உடனடி அபாயம்
|
2 ppm[2] | ||
மாறுதலாக ஏதும் சொல்லவில்லை என்றால் கொடுக்கப்பட்ட தரவுகள் யாவும் பொருள்கள் அவைகளின் இயல்பான வெப்ப அழுத்த நிலையில் (25°C, 100kPa) இருக்கும். | |||
செலீனியம் அறுபுளோரைடு (Selenium hexafluoride) என்பது SeF6 என்ற மூலக்கூற்று வாய்ப்பாட்டால் அடையாளப்படுத்தப்படும் ஒரு கனிம வேதியியல் சேர்மமாகும். மிகவும் நச்சுத்தன்மை கொண்ட இச்சேர்மம் நிறமற்ற வாயுநிலையில் காணப்படுகிறது. விரும்பத்தகாத நாற்றம் கொண்டதாகவும் பரவலான பயன்பாடுகளும் வணிகப் பயன்பாடுகளும் அற்றதாகவும் உள்ளது.[5] It is not widely encountered and has no commercial applications.[6]
கட்டமைப்பு
[தொகு]Se−F பிணைப்புகளின் பிணைப்பு நீளம் 168.8 பைக்கோமீட்டர் ஆக உள்ள எண்முக மூலக்கூற்று வடிவத்தில் SeF6 சேர்மம் படிகமாகிறது. பிணைப்பைப் பொறுத்தவரை, இதன் பிணைப்பு மியிணைதிற பிணைப்பு என கருதப்படுகிறது.
தயாரிப்பு
[தொகு]தனிமங்களில் இருந்து இதை தயாரிக்கலாம். [7] செலீனியம் டை ஆக்சைடுடன் புரோமின் முப்புளோரைடு (BrF3) சேர்த்து வினைபுரியச் செய்தால் செலீனியம் அறுபுளோரைடு உருவாகிறது. வினையில் உருவாகும் சேர்மம் பதங்கமாதல் மூலம் சுத்திகரிக்கப்படுகிறது.
வேதிப்பண்புகள்
[தொகு]S, Se மற்றும் Te தனிமங்களின் அறுபுளோரைடுகளின் ஒப்பீட்டு வினைத்திறன் TeF6 > SeF6 > SF6 என்ற வரிசையைப் பின்பற்றுகிறது. பிந்தையதாக உள்ள SF6 அதிக வெப்பநிலை வரை நீராற்பகுப்பு வினையில் முற்றிலும் செயலற்றதாகும். செலீனியம் அறுபுளோரைடும் நீராற்பகுப்பை எதிர்க்கிறது. இவ்வாயுவை எந்தவிதமான மாற்றமுமின்றி 10% NaOH அல்லது KOH வழியாக அனுப்ப முடியும், ஆனால் 200 ° செல்சியசு வெப்பநிலையில் இவ்வாயு அம்மோனியாவுடன் வினைபுரிகிறது.[8]
பாதுகாப்பு
[தொகு]செலீனியம் அறுபுளோரைடு மிகவும் செயலற்றது என்றாலும் நீராற்பகுப்பு வினையில் மெதுவாக இருந்தாலும், குறைந்த செறிவுகளில் கூட நச்சுத்தன்மை வாய்ந்ததாக உள்ளது. குறிப்பாக, நீண்ட நேரம் வெளிப்பட்டாலும் இந்நச்சு பாதிப்பு இருக்கும்.[9] அமெரிக்காவில் செலீனியம் அறுபுளோரைடு வெளிப்பாட்டிற்கான தரநிலைகள் எட்டு மணி நேர வேலை மாற்றத்தில் சராசரியாக காற்றில் மில்லியனுக்கு 0.05 பகுதிகள் என்ற உச்ச வரம்பு நிர்ணயிக்கப்பட்டுள்ளது. கூடுதலாக, செலினியம் அறுபுளோரைடின் உயிருக்கும் ஆரோக்கியத்துக்குமான உடனடி ஆபத்து மதிப்பளவு மில்லியனுக்கு அதிகபட்சம் 2 பகுதிகள் வரை அனுமதிக்கப்படுகிறது..[10]
மேற்கோள்கள்
[தொகு]- ↑ Lide, D. R., ed. (2005). CRC Handbook of Chemistry and Physics (86th ed.). Boca Raton (FL): CRC Press. பன்னாட்டுத் தரப்புத்தக எண் 0-8493-0486-5.
- ↑ 2.0 2.1 2.2 2.3 "NIOSH Pocket Guide to Chemical Hazards #0551". National Institute for Occupational Safety and Health (NIOSH).
- ↑ Wiberg, E.; Holleman, A. F. (2001). Inorganic Chemistry. Elsevier. பன்னாட்டுத் தரப்புத்தக எண் 0-12-352651-5.
- ↑ "Selenium hexafluoride". Immediately Dangerous to Life and Health. National Institute for Occupational Safety and Health (NIOSH).
- ↑ "Material Safety" (PDF). பார்க்கப்பட்ட நாள் 2010-07-24.
- ↑ Langner, B. E. (2005), "Selenium and Selenium Compounds", Ullmann's Encyclopedia of Industrial Chemistry, Weinheim: Wiley-VCH, எண்ணிம ஆவணச் சுட்டி:10.1002/14356007.a23_525
- ↑ Yost, D. M.; Simons, J. H. (1939). "Sulfur, Selenium, and Tellurium Hexafluorides". Inorganic Syntheses. Vol. 1. pp. 121–122. எண்ணிம ஆவணச் சுட்டி:10.1002/9780470132326.ch44. பன்னாட்டுத் தரப்புத்தக எண் 9780470132326.
- ↑ "Selenium-Inorganic Chemistry". Encyclopedia of Inorganic Chemistry. (1994). Ed. King, R. B.. John Wiley & Sons. பன்னாட்டுத் தரப்புத்தக எண் 0-471-93620-0.
- ↑ "Medical Management Guidelines for Selenium Hexafluoride (SeF6)". CDC ATSDR. Archived from the original on May 28, 2010. பார்க்கப்பட்ட நாள் 2010-07-24.
- ↑ Documentation for Immediately Dangerous To Life or Health Concentrations (IDLHs)