மரபணுச் சிகிச்சை
இக்கட்டுரை கூகுள் மொழிபெயர்ப்புக் கருவி மூலம் உருவாக்கப்பட்டது. இதனை உரை திருத்த உதவுங்கள். இக்கருவி மூலம்
கட்டுரை உருவாக்கும் திட்டம் தற்போது நிறுத்தப்பட்டுவிட்டது. இதனைப் பயன்படுத்தி இனி உருவாக்கப்படும் புதுக்கட்டுரைகளும் உள்ளடக்கங்களும் உடனடியாக நீக்கப்படும் |
மரபணுச் சிகிச்சை என்பது, குறிப்பிட்ட சில நோய்களுக்கான சிகிச்சையாக ஒரு மரபணுவின் வெளிப்பாட்டை மாற்றியமைத்தல் அல்லது சிகிச்சைப் பயன்பாட்டிற்காக உயிரணுக்களின் உயிரியல் பண்புகளை மாற்றியமைத்தல் என்பவற்றை உள்ளடக்கிய ஒரு மருத்துவத் துறையாகும்.[1] மனித டி. என். ஏ.யை மாற்றியமைக்கும் முதலாவது முயற்சி 1980 இல் மார்ட்டின் கிளைன் என்பவரால் மேற்கொள்ளப்பட்டாலும், மனிதரில் தேசிய நல கழகம், ஐக்கிய அமெரிக்காவினால் அங்கீகரிக்கப்பட்ட முதல் வெற்றிகரமான மனித மரபணுப் பரிமாற்றம் 1989 மே மாதத்திலேயே மேற்கொள்ளப்பட்டது. [2]
இவ்வகை மரபணுச் சிகிச்சை முறைகள் பல மரபணுப் பிறழ்ச்சிக் குறைபாடுகளைத் தீர்க்க உதவும் என்று நம்பப்பட்டது. 1989 இற்கும், டிசம்பர் 2018 இற்குமிடையில், 2900 இற்கும் மேலான மருந்தியக்கச் சோதனை செய்யப்பட்டதுடன், அவற்றில் அரைவாசிக்கும் மேலானவை நிலை 1 (Phase 1) நிலையில் இருந்தது.[3]
மரபணு சிகிச்சை என்பதன் கருத்தாக்கம், ஒரு மரபணுச் சிக்கலை அதன் மூலத்தில் வைத்தே சரிசெய்வதாகும். எடுத்துக்காட்டாக, ஒரு மரபியல் நோயில் அல்லது பரம்பரை நோயில் (பொதுவாகப் பின்னடைவான, ஒரு குறிப்பிட்ட மரபணுவில் ஏற்படும் சடுதியான மாற்றமான மரபணுத் திடீர் மாற்றமானது, ஒரு செயலற்ற புரதத்தின் உற்பத்தியில் முடிகிறது. அப்போது மரபணுச் சிகிச்சை மூலம், குறிப்பிட்ட அந்தத் தீங்கு விளைவிக்கும் மரபணுத் திடீர்மாற்றம் தவிர்க்கப்பட்ட, மரபணுவின் அசலை ஒத்த, ஒரு சரியான நகலை வழங்குவதன் மூலம், அந்த மரபணுவிற்கான, உடலிற்குத் தேவையான செயல்படு புரதத்தை உருவாக்க முடியும். இந்த முறையிலான மரபணுச் சிகிச்சை, மரபணு பிரதியிடும் சிகிச்சை (gene replacement theory) எனப்படுவதுடன், பரம்பரை விழித்திரை நோய்களுக்கு சிகிச்சையளிக்கவும் பயன்படுத்தப்படுகிறது.[4][5]
மனித மரபணு சிகிச்சையின் உயிரியல் மிகவும் சிக்கலானது, அத்துடன் மேம்படுத்தப்பட வேண்டிய உத்திகளும், மரபணு சிகிச்சையை முறையாகப் பயன்படுத்தப்படுவதற்கு முன்பாக முழுதாக புரிந்துகொள்ளவேண்டிய நோய்களும் அதிகம் இருக்கின்றன. மனித ஆய்வுக்குட்படுநர் மீது மரபணுரீதியாக கட்டமைக்கப்பட்ட மூலப்பொருளை பயன்படுத்துவதற்குள்ள சாத்தியத்தைச் சூழ்ந்துள்ள பொதுமக்கள் கொள்கை விவாதம் நிறைந்ததாக உள்ளது. இந்த விவாதத்தில் அரசியல் தொடக்கம் அறிவியல் வரை பல்வேறு துறைகளில் இருப்பவர்களும் வெவ்வேறு கண்ணோட்டங்களைக் கொண்டுள்ளனர்.[6]
மனித உயிரணுக்களுக்கு உள்ளாக நேரடியாக மரபணுக்களைச் செலுத்த முயற்சிப்பது, Cystic fibrosis, ஈமோஃபீலியா, தசை மற்றும் அரிவாள்செல் சோகை போன்ற ஒற்றை மரபணு பழுதுபடுதலின் காரணமாக ஏற்படும் நோய்களில் கவனம் செலுத்துவது ஆகியவற்றில் தர்க்கரீதியான நடவடிக்கைகளை அறிவியலாளர்கள் மேற்கொண்டு வருகின்றனர். இது எளிய பாக்டீரியாவை மேம்படுத்துவதைவிடக் கடினமானது, பிரதான காரணம் என்னவெனில் பெரும் பிரிவுகளிலான டி.என்.ஏக்களைச் சுமந்து செல்வதோடும் அவற்றைப் பொருத்தமான பெரிய மனித மரபணுவின் சரியான தளத்திற்குக் கொண்டு செல்வதோடும் சம்பந்தப்பட்டுள்ள பிரச்சினைகளாகும். இன்று, பெரும்பாலான மரபணுச் சிகிச்சைகளும் பரம்பரை நோய்கள் அல்லது மரபணு நோய்களை உள்ளடக்கிய மரபணுப் பிறழ்ச்சிகள் மற்றும் புற்றுநோய்களை இலக்காகக் கொண்டே செய்யப்படுகின்றன.[7] [8]
மரபணு சிகிச்சைகளின் வகைகள்[தொகு]
மரபணு சிகிச்சைகளை பின்வரும் பிரிவுகளாகப் பிரிக்கலாம்:
மூலவுயிர்வழி மரபணுச் சிகிச்சை[தொகு]
மூலவுயிர்வழி (en:Germline) மரபணுச் சிகிச்சையின்போது, பாலணுக்கள், அதாவது விந்து அல்லது முட்டை சாதாரணமாக தங்களது மரபணுத் தொகுதிக்குள் செயற்படு மரபணுக்கள் செலுத்தப்படுவதன் மூலம் மேம்படுத்தப்படுகின்றன. ஆகவே, சிகிச்சையின் காரணமாக ஏற்படும் மாற்றமானது பரம்பரையாக பெறப்படக்கூடியது என்பதனால், தொடர்ந்து வரும் தலைமுறையினரிடமும் குறிப்பிட்ட இயல்பு கடத்தப்படும். கோட்பாட்டு ரீதியாக இந்தப் புதிய அணுகுமுறையானது, எதிர்வினை புரியும் மரபணுக் குலைவுகள் மற்றும் பரம்பரை நோய்களில் அதிகபட்ச அளவில் பயன்தரக்கூடியதாகும். இருப்பினும் இதனை மனிதரில் பயன்படுத்துவதில் நெறிமுறை சார்ந்த அல்லது அறம் சார்ந்த காரணங்களுக்காக பல முரண்பட்ட கருத்துகள் இருக்கின்றன. வெவ்வேறு நாடுகளில் இந்தச் சிகிச்சையைப் பயன்பாட்டுக்குக் கொண்டு வருவது தொடர்பாக, வேறுபட்ட விதிகள், ஒழுங்கு முறைகள் பேணப்படுகின்றன.[9][10]
உடல் உயிரணு மரபணுச் சிகிச்சை[தொகு]
உடல் உயிரணு மரபணுச் சிகிச்சையின்போது, சிகிச்சையளிக்கப்படும் மரபணுக்கள் நோயாளியின் உடல் உயிரணுவிற்கு (en:Somatic cell) உள்ளே செலுத்தப்படுகின்றன. எந்த விதமான மேம்பாடுகளும் விளைவுகளும் தனிப்பட்ட நோயாளியிடம் மட்டுமே ஏற்படும் என்பதுடன் நோயாளியின் வம்சாவளியினரிடம் தொடர்ந்து செல்லாது.
பரந்துபட்ட முறைகள்[தொகு]
மரபணு சிகிச்சையில் மரபணுக்களை மாற்றவும் சரிசெய்வதற்குமான வெவ்வேறு வகைப்பட்ட முறைகள் இருக்கின்றன.[11]
- செயல்படாத மரபணுவை மாற்றியமைப்பதற்காக அந்த மரபணுத்தொகைக்குள்ளாக, தி்ட்டமிடப்படாத இடத்தில் ஒரு சாதாரணமான மரபணு சேர்க்கப்படலாம். இந்த அணுகுமுறை மிகவும் பொதுவானதாகும்.
- ஒரு வழக்கத்திற்கு மாறான மரபணு, வழக்கமான மரபணுவிற்குப் பதிலாக ஒத்த மீள்சேர்க்கை (en:Homologous recombination) வழியாக மாற்றியமைக்கப்படலாம்.
- மரபணுச் சடுதிமாற்றம் மூலம் தோன்றிய வழக்கத்திற்கு மாறான ஒரு மரபணுவானது, தேர்வு மீள் மரபணுச் சடுதிமாற்றம் (selective reverse mutation) ஒன்றின் வழியாக சரிசெய்யப்படலாம். இதனால் குறிப்பிட்ட மரபணு தனது வழமையான செயற்பாட்டை மீளப் பெறலாம்.
- குறிப்பிட்ட ஒரு மரபணுவின் ஒழுங்குமுறையை (மரபணு இயக்கப்படும் அல்லது நிறுத்தப்படும் அக்ளவை) மாற்றியமைக்கலாம்.
- சுழல்முனை மாற்றம் (en:Spindle transfer) மூலம், குறைபாடுள்ள டி. என். ஏ ஐக் கொண்டிருக்கும் இழைமணியை முழுமையாக மாற்றியமைக்கலாம்
மரபணு சிகிச்சை முறைகள்கள்[தொகு]
பல்வேறு முறைகளில் டி.என்.ஏயானது ஓர் உயிரணுவிற்குள் வழங்கப்படலாம். அவற்றில் முக்கியமான இரு முறைகள் மீள்சேர்க்கைத் தீநுண்மிகள் (en:Recombinant virus) அல்லது புரதங்கள், கொழுமியங்கள் போன்ற வேறு மூலக்கூறுகளுடன் தொடர்பு கொண்டிராத வெறுமையான டி.என்.ஏ.க்களை (Naked DNA) காவிகளாகப் பயன்படுத்துதல். மீள்சேர்க்கைத் தீநுண்மிகள் பயன்படுத்தப்படும்போது அவை உயிரியல் நானோ துகள்கள் அல்லது தீநுண்மி காவிகள் அல்லது வைரசு காவிகள் முறை என்றும், வெறுமையான டீ.என்.ஏ. பயன்படுத்தப்படும்போது அவை தீநுண்மியற்ற முறை எனவும் அழைக்கப்படும்.
தீநுண்மிகள்[தொகு]
எல்லா வைரஸ்களும் தங்களுடைய வாழ்விடத்தை அமைத்துக்கொள்கின்றன என்பதோடு தங்களுடைய பதிலிறுத்தல் சுழற்சியின் ஒரு பகுதியாக வாழ்விட உயிரணுவிற்குள்ளாக அவற்றின் மரபணு மூலப்பொருளை சேர்த்துவிடுகின்றன. இந்த மரபணு மூலப்பொருள் இத்தகைய வைரஸ்களின் பிரதிகளை அதிகப்படியாக உருவாக்குவதற்கான அடிப்படை 'அறிவுறுத்தல்களை' பெற்றிருக்கின்றன, அத்துடன் அந்த வைரஸிற்குத் தேவையானவற்றை அளிப்பதற்கான உடலின் வழக்கமான உற்பத்தி இயந்திரத்தையும் கடத்திச் சென்றுவிடுகின்றன.குடியேற்ற உயிரணு இந்த அறிவுறுத்தல்களை எடுத்துச் செல்கிறது என்பதுடன் இந்த வைரஸ்களை மேற்கொண்டு பிரதிசெய்கிறது, இது மேலும் மேலும் அதிக செல்கள் பாதிக்கப்படுவதற்கு வழியமைக்கிறது.சிலவகையான வைரஸ்கள் குடியேற்ற மரபணுத் தொகுதிக்குள்ளாக தங்களை பௌதீகரீதியாக பொருத்திக் கொள்கின்றன (ரெட்ரோவைரஸ்களின் வரையறு அம்சம், ஹெச்ஐவியை உள்ளிட்டிருக்கும் வைரஸ் குடும்பங்கள் என்பவை குடியேறிவைகளுக்குள்ளாக என்சைம் பின்திரும்பல் மறுபடிவமாக்கம் செய்து தனது ஆர்என்ஏக்களை "அறிவுறுத்தல்களாக" பயன்படுத்துபவையாகும்).குடியேற்ற செல்களின் ஆயுள்காலத்திற்காக இது அந்த செல்களின் மரபணுக்களுக்கிடையே அத்தகைய வைரஸ்களின் மரபணுக்களை சேர்த்துக்கொள்கின்றன.
மருத்துவர்களும் மூலக்கூறு உயிரியலாளர்களும் இதுபோன்ற வைரஸ்களை மனித உயிரணுக்குள்ளாக 'நல்ல' மரபணுக்களை கொண்டுசெல்வதற்கான வாகனங்களாக பயன்படுத்திக்கொள்ளலாம் என்று உணர்ந்திருக்கின்றனர். முதலில், அறிவியலாளர் நோய்க்கு காரணமாகும் வைரஸிலுள்ள மரபணுக்களை நீக்குவார்.பின்னர் அவர்கள் அந்த மரபணுக்களை விரும்பிய விளைவைத் தருவதற்கேற்ப குறியிடப்பட்ட மரபணுக்களைக் கொண்டு மாற்றியமைப்பார்கள் (உதாரணத்திற்கு, நீரிழிவு நோயில் இன்சுலின் உற்பத்தி செய்வது போன்று). தனது குடியேற்ற மரபணுத் தொகுதிக்குள்ளாக தனது மரபணுத் தொகுதியை சேர்த்துக்கொள்ள வைரஸை அனுமதிக்கும் மரபணுக்கள் முழுமை பெறாமல் விட்டுவிடும் வகையில் இந்த நடைமுறை செய்யப்பட வேண்டும்.இது குழப்பமானதாக இருக்கலாம் என்பதோடு, ஒவ்வொன்றினுடைய செயல்பாட்டையும் அறிந்துகொள்ளும் விதமாக வைரஸ் மரபணுக்களைப் பற்றிய குறிப்பிடத்தகுந்த ஆராய்ச்சி மற்றும் புரிதல் தேவைப்படலாம்.ஒரு உதாரணம்:
தனது மரபணுக்களை குடியேற்ற உயிரணுக்களின் மரபணுத் தொகுதிகளாக சேர்த்துக்கொள்வதன் மூலம் பதிலுறுத்தல் செய்யப்படும் ஒரு வைரஸ் கண்டுபிடிக்கப்பட்டது. இந்த வைரஸ் இரண்டு மரபணுக்களைக் கொண்டிருந்தது - ஏ மற்றும் பி. மரபணு ஏ குடியேற்ற மரபணுத் தொகுதிக்குள்ளாக தானாகவே சேர்ந்துகொள்வதற்கான அனுமதியை இந்த வைரஸிற்கு வழங்கும் வகையில் ஒரு புரோட்டீன் மீது குறிட்டிருந்தது. இந்த வைரஸ் சம்பந்தப்பட்ட நோய்க்கு மரபணு பி காரணமாகியது. மரபணு சி என்பது மரபணு பிஇன் இடத்திற்கு நாம் வேண்டுகின்ற "சாதாரணமான" அல்லது "விரும்பந்தகுந்த" மரபணுவாகும். இவ்வாறு, மறுகட்டமைப்பு செய்வதன் மூலம் மரபணு பி மரபணு சிஆல் இடமாற்றம் செய்யப்படுகிறது, அதேசமயம் மரபணு ஏவை முறையாகச் செயல்படச் செய்கிறது, இந்த வைரஸ் தேவையான மரபணுவை சேர்க்கலாம் - எந்த ஒரு நோய்க்கும் காரணமாகாமல் குடியேற்ற உயிரணுவின் மரபணுவிற்குள்ளாக மரபணு சி சேர்க்கப்படுதல்.
இவையனைத்தும் தெளிவான முறையில் மிகையாக எளிமைப்படுத்தப்பட்ட விஷயங்கள், வைரஸ் பரவல்களைப் பயன்படுத்தி மரபணு சிகிச்சையைத் தடுத்து நிறுத்துகின்ற வேறு நிறைய பிரச்சினைகளும் இருக்கவே செய்கின்றன, அதாவது:விரும்பத்தகாத விளைவுகளை தடுத்து நிறுத்துவதில் உள்ள பிரச்சினை, உடலில் சரியாக இலக்கு வைக்கப்பட்ட உயிரணுவை இந்த வைரஸ் சரியாக தொற்றிக்கொள்வதை உறுதிப்படுத்துதல், சேர்க்கப்பட்ட மரபணுவானது மரபணுத் தொகுதியிலுள்ள மிக முக்கியமான மரபணுக்கள் எதையும் தொந்திரவு செய்யாமல் இருப்பது.இருப்பினும், மரபணுவை சேர்த்தலின் இந்த அடிப்படை முறைமை தற்போது நிறைய உறுதிப்பாடுகளை வழங்குகிறது என்பதுடன் மருத்துவர்களும் அறிவியலாளர்களும் அதில் இருக்கக்கூடிய சாத்தியமுள்ள பிரச்சினைகள் எதையும் சரிசெய்வதற்கு கடுமையாக உழைத்து வருகின்றனர்.
ரெட்ரோவைரஸ்கள்[தொகு]
ரெட்ரோவைரஸ்களில் உள்ள மரபணு மூலப்பொருள்கள் ஆர்என்ஏ மூலக்கூறுகள் வடிவத்தில் உள்ளன, அதேசமயம் அவற்றின் குடியேற்றங்களில் உள்ள மரபணு மூலப்பொருள்கள் டிஎன்ஏ வடிவத்தில் உள்ளன. ரெட்ரோவைரஸ் குடியேற்ற வைரஸில் தொற்றும்போது சில என்சைம்களுடன் இணைந்து உயிரணுக்குள்ளாக அதனுடைய ஆர்என்ஏவையும் சேர்த்துவிடுகின்ற, அதாவது பின்திரும்பல் மறுவடிவமாக்கம் மற்றும் ஒருங்கிணைப்பாக்கம் போன்றவை. ரெட்ரோவைரஸிலிருந்து வந்த ஆர்என்ஏ மூலக்கூறு குடியேற்ற உயிரணுவின் மரபணு மூலப்பொருளுக்குள்ளாக ஒருங்கிணைவதற்கு முன்னதாக அதனுடைய ஆர்என்ஏ மூலக்கூறிலிருந்து டிஎன்ஏ பிரதியை உற்பத்தி செய்தாக வேண்டியிருக்கிறது.ஒரு ஆர்என்ஏ மூலக்கூறிலிருந்து டிஎன்ஏ மூலக்கூறை உற்பத்தி செய்யும் நிகழ்முறை பின்திரும்பல் மறுவடிவமாக்கம் என்று குறிப்பிடப்படுகிறது. இது பின்திரும்பல் மறுவடிவமாக்கம் எனப்படும் வைரஸில் சுமக்கப்பட்டிருக்கும் என்சைம்களுள் ஒன்றினால் எடுத்துச் செல்லப்படுகிறது. இந்த டிஎன்ஏவின் பிரதி உற்பத்தி செய்யப்பட்டு, குடியேற்ற உயிரணுவின் நியூக்லியஸிலிருந்து சுதந்திரமாக விடப்பட்ட பின்னர் இது குடியேற்ற உயிரணுவின் மரபணுத் தொகுதிக்குள்ளாக சேர்த்துக்கொள்ளப்பட வேண்டும். அதாவது, இது உயிரணுவில் (குரோமோசோம்கள்) உள்ள பெரிய டிஎன்ஏக்களுக்குள்ளாக சேர்த்துக்கொள்ளப்பட வேண்டும். இந்த நிகழ்முறையானது ஒருங்கிணைப்பாக்கம் எனப்படும் வைரஸ் சுமந்திருக்கும் மற்றொரு என்சைமால் செய்யப்படுகிறது.
இப்போது வைரஸின் மரபார்ந்த மூலப்பொருளை குடியேற்ற உயிரணு புதிய மரபணுவை கொண்டிருப்பதற்கென்று மேம்படுத்தப்பட்டிருக்கிறது என்று கூறலாம். இந்த குடியேற்ற உயிரணு பின்னர் பிரிந்துவிட்டதென்றால், அதனுடைய வம்சாவளி அனைத்தும் புதிய மரபணுக்களைக் கொண்டிருக்கும்.சிலநேரங்களில் இந்த ரெட்ரோவைரஸின் மரபணுக்கள் தங்களுடைய தகவலை உடனடியாக வெளிப்படுத்தாமல் போகலாம்.
ரெட்ரோவைரஸ்களைப் பயன்படுத்தி செய்யப்படும் மரபணு சிகிச்சைகளில் உள்ள பிரச்சினைகளுள் ஒன்று என்னவெனில் குடியேற்ற உயிரணுவின் மரபணுத் தொகுதியில் உள்ள எந்த ஒரு கட்டுப்படாத நிலையிலும் வைரஸின் மரபார்ந்த மூலப்பொருளை ஒருங்கிணைப்பாக்க என்சைம் சேர்த்துவிடும் என்பதுதான் - இது குரோமோசோம்களுக்குள்ளாக மரபார்ந்த மூலப்பொருளை கட்டாயப்படுத்தி சேர்த்துவிடுகிறது. குடியேற்ற உயிரணுவின் அசலான மரபணுக்கள் ஒன்றின் மத்தியில் மரபார்ந்த மூலப்பொருள் சேர்க்கப்பட்டதென்றால், அந்த மரபணு தொந்திரவுக்கு ஆளாகும் (மறுவடிவமாக்க மரபணுக்கள் சேர்க்கப்படுதல்).இந்த மரபணுவிற்கு நெறிப்படுத்தப்பட்ட உயிரணு பிரிதல், கட்டுப்படுத்தப்படாத உயிரணு பிரிதல் (அதாவது., புற்றுநோய்) ஏற்படும். இந்தப் பிரச்சினை, குறிப்பிட்ட குரோமோசோம் தளத்தை நோக்கி ஒருங்கிணைப்புத் தளத்தை இயக்குவதற்கு சின்க் ஃபிங்கர் நியூக்ளியஸைப்[12] பயன்படுத்துவதன் மூலமும் அல்லது பீட்டா-குளோபின் லோகஸ் கட்டுப்பாட்டுப் பகுதி போன்ற குறிப்பிட்ட தொடர்வரிசையை சேர்த்துக்கொள்வதன் மூலமும் சமீப காலங்களில் வெளிப்படுத்தப்பட தொடங்கியுள்ளன.
எக்ஸ்-லின்க்டு சிவியர் கம்பைண்டு இம்முனோடிஃபிஷியன்சிக்கு (X-SCID) சிகிச்சையளிக்க ரெட்ரோவைரஸ் பரவலாக்கங்களைப் பயன்படுத்தும் மரபணு சிகிச்சை பரிசோதனைகள் இன்றைய நாளில் மிக வெற்றிகரமான மரபணு சிகிச்சை பயன்பாட்டைக் காட்டுகிறது. ஃபிரான்ஸ் மற்றும் பிரிட்டனில் இருபதுக்கும் மேற்பட்ட நோயாளிகள் உயர் அளவிலான நோயெதிர்ப்புத் திறன் அமைப்பு மறுகட்டமைப்பு செய்யப்பட்டதுடன் சேர்த்து சிகிச்சையளிக்கப்பட்டிருக்கின்றனர். இதுபோன்ற பரிசோதனைகள், இந்த ஃபிரென்ச் X-SCID மரபணு சிகிச்சை பரிசோதனையில் சிகிச்சையளிக்கப்பட்ட நோயாளிகளிடத்தில் இரத்தப்புற்றுநோய் இருப்பதாக தெரிவிக்கப்பட்டபோது அமெரிக்காவில் நிறுத்திவைக்கப்பட்டுள்ளது அல்லது தடைசெய்யப்பட்டுள்ளது. இதுநாள்வரை, ஃபிரென்ச் பரிசோதனையில் நான்கு குழந்தைகளுக்கும் பிரித்தானிய பரிசோதனையில் ஒருவருக்கும் ரெட்ரோவைரல் பரவவாக்கல் மூலமான மறுவடிவமாக்க மரபணுக்கள் சேர்க்கப்படுதல் விளைவாக உருவாகியுள்ளது.எல்லோருக்கும் இல்லாவிட்டாலும் ஒரு குழந்தைக்கு வழக்கமான எதிர்-இரத்தப் புற்றுநோய் சிகிச்சைக்கு சாதகமான பலனளித்துள்ளது. அடேனசின் டீமைனேஸ் (ADA) என்சைம் குறைபாடு காரணமாக SCIDக்கு சிகிச்சையளிப்பதற்கான மரபணு சிகிச்சை பரிசோதனைகள் அமெரிக்கா, பிரிட்டன், இத்தாலி மற்றும் ஜப்பானில் பெற்ற வெற்றிகளின் காரணமாக தொடர்ந்து மேற்கொள்ளப்படுகின்றன.
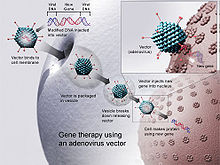
ஆடனாவைரஸ்[தொகு]
ஆடனாவைரஸ்கள் என்பவை இரட்டை-தனித்திருக்கும் டிஎன்ஏவின் வடிவில் தங்களது மரபார்ந்த மூலக்கூறுகளை சுமந்துசெல்கின்ற வைரஸ்களாகும். அவை மனிதர்களிடத்தில் (குறிப்பாக பொதுவான ஜலதோஷம்) சுவாசம், குடல் மற்றும் கண்சார்ந்த தொற்றுக்களுக்கு காரணமாகின்றன.இந்த வைரஸ்கள் குடியேற்ற உயிரணுக்களை பாதிக்கும்போது அவை அவற்றின் டிஎன்ஏ மூலக்கூறுகளை குடியேற்ற செல்களுக்குள் அனுப்புகின்றன. ஆடனாவைரஸ்களின் மரபார்ந்த மூலப்பொருள்கள் குடியேற்ற உயிரணுக்களின் மரபார்ந்த மூலப்பொருள்களுக்குள்ளாக சேர்த்துக்கொள்ளப்படுவதில்லை (தற்காலிகமாக).டிஎன்ஏ மூலக்கூறு குடியேற்ற உயிரணுவின் நியூக்ளியஸிற்குள்ளாக சுதந்திரமாக விடப்படுகிறது, அத்துடன் இந்த கூடுதல் டிஎன்ஏ மூலக்கூறி்ல் உள்ள அறிவுறுத்தல்கள் மற்ற எந்த மரபணுவையும் போன்று மாற்றியமைக்கப்படுகின்றன.இத்தகைய கூடுதல் மரபணுக்கள் உயிரணுவான உயிரணு பிரிதலுக்கலுக்கு ஆளாகும்போது பதிலிறுத்தப்படுவதில்லை என்பதால் அந்த உயிரணுவின் வம்சாவளிகள் கூடுதல் மரபணுவைப் பெற்றிருப்பதில்லை என்பது மட்டுமே ஒரே வித்தியாசமாகும்.இதன் விளைவாக, ஆடனோவைரஸைக் கொண்டு சிகிச்சையளிப்பது வளர்ந்துவரும் உயிரணுவிற்கு மீண்டும் சிகிச்சையளிக்க வேண்டியிருக்கும் என்றாலும் குடியேற்ற உயிரணுக்களின் மரபணுவிற்குள்ளான ஒருங்கிணைப்பின்மையால் SCID பரிசோதனையில் காணப்பட்டதுபோன்ற வகையிலான புற்றுநோய் வகை தடுக்கப்படுகிறது.இந்த பரவலாக்க அமைப்பு புற்றுநோய்க்கு சிகிச்சையளிப்பதற்கென்று மேம்படுத்தப்பட்டிருக்கிறது என்பதுடன் உண்மையிலேயே புற்றுநோய்க்கு சிகிச்சையளிப்பதற்கென்று உரிமமளிக்கப்பட்ட முதல் மரபணு சிகிச்சை ஜென்டிசைன் என்ற ஆடனோவைரஸ்தான். p53-அடிப்படையிலான ஆடனோவைரஸான ஜென்டிசைன் தலை மற்றும் கழுத்துப் புற்றுநோய்க்கான சிகிச்சைக்காக 2003ஆம் ஆண்டில் சீன எஃப்டிஏவால் அங்கீகரிக்கப்பட்டிருக்கிறது. இன்ட்ரோஜெனிலிருந்து வந்துள்ள அதேவகைப்பட்ட மரபணு சிகிச்சை அணுகுமுறையான ஆட்வெக்ஸின் 2008ஆம் ஆண்டில் அமெரிக்க எஃப்டிஏவால் நிராகரிக்கப்பட்டது.
ஆடனோவைரஸ் பரவலாக்கங்களின் பாதுகாப்பு குறித்த பரிசீலனைகள், மரபணு சிகிச்சை பரிசோதனையில் பங்கேற்ற ஜெஸ்ஸி கெல்சிங்கர் உயிரிழந்த 1999ஆம் ஆண்டிற்கு பின்னரே எழுந்துள்ளன.அதன் பின்னாலிருந்து, ஆடனோவைரஸைப் பயன்படுத்தி மேற்கொள்ளப்படும் பணிகள் இந்த வைரஸின் மரபணுரீதியில் முடமான வடிவங்களில் கவனம் செலுத்துவதாக ஆனது.
ஆடனோ-சார்ந்த வைரஸ்கள்[தொகு]
பர்வாவைரஸ் குடும்பத்திலிருந்து வந்துள்ள ஆடனோ-சார்ந்த வைரஸ்கள் என்பவை ஒற்றை தனித்திருக்கும் டிஎன்ஏவின் மரபணுவுடன் கூடிய சிறிய வைரஸ்களாகும். இந்த முரட்டுத்தனமான ஏஏவி குரோமோசோம் 19இல் உள்ள குறிப்பிட்ட தளத்தில் மரபார்ந்த மூலப்பொருளை 100 சதவிகித நிச்சயத்தன்மையுடன் சேர்த்துவிடக்கூடியவையாகும். ஆனால், வைரஸ் மரபணுக்களை கொண்டிருக்காமல் சிகிச்சைப்பூர்வமான மரபணுவை மட்டும் கொண்டிருக்கும் இந்த மறுஒருங்கிணைப்பு ஏஏவி மரபணுவிற்குள்ளாக ஒருங்கிணைப்பு செய்துகொள்வதில்லை.இதற்குப் பதிலாக மறுஒருங்கிணைப்பு வைரஸ் மரபணுவானது, நீண்டகால மரபணு வெளிப்பாட்டிற்கு பிரதான காரணமாவதாக முன்னூகிக்கப்பட்டுள்ள வட்ட வடிவ, எபிசோமல் வடிவத்திற்கு மறுஒருங்கிணைப்பு செய்ய ஐடிஆர் (தலைகீழ்வடிவ இறுதி திருப்பங்கள்) வழியாக அதன் முடிவில் உருகிப்போகிறது.ஏஏவியைப் பயன்படுத்துவதில், சுந்துசெல்லக்கூடிய சிறிய அளவிலான டிஎன்ஏ (குறைவான திறன்) மற்றும் அதை உற்பத்தி செய்வதில் உள்ள சிக்கல் உள்ளிட்ட சில தீமைகளும் உள்ளன. இருப்பினும் இந்த வகையான வைரஸ்களும் பயன்படுத்தப்படுகின்றன, ஏனென்றால் இது நோய் தோற்றுவிக்கும் வகைசாராததாகும் (பெரும்பாலானவர்களிடத்தில் இந்த அபாயமற்ற வைரஸ் காணப்படுகிறது).ஆடனோவைரஸ்களுக்கு மாற்றாக பெரும்பாலான மக்களிடத்தில் செய்யப்படும் ஏஏவி சிகிச்சையால் வெற்றிகரமாக செய்யப்பட்ட இந்த வைரஸ்கள் மற்றும் உயிரணுக்களை நீக்குவதற்கான நோயெதிர்ப்புத் திறனை வளர்ப்பதில்லை.ஏஏவி கொண்டு செய்யப்படும் சில பரிசோதனைகள் நடந்துகொண்டிருக்கின்றன அல்லது தயாரிப்பு நிலையில் இருக்கின்றன, முக்கியமாக தசை மற்றும் கண் நோய்களுக்கு சிகிச்சையளிப்பதற்கான முயற்சி; இந்த இரண்டு திசுக்களிடத்திலும் இந்த வைரஸ் பயன்மிக்கதாக காணப்படுகிறது.இருப்பினும், மூளைக்குள் மரபணுக்களை அனுப்புவதற்கு பயன்படுத்துவதற்கு ஏஏவி பரவலாக்கங்களைத் தொடங்குவதற்கான மருத்துவப் பரிசோதனைகளும் தொடங்கியுள்ளன. மரபணுக்கள் நீண்ட காலத்திற்கு வெளிப்படுத்தப்படுகின்ற நியூரான்கள் போன்ற பிரிவுபடுத்தாத (அசைவின்மை) உயிரணுக்களை ஏஏவி வைரஸ்கள் தொற்றுகின்றன என்பதால் இது சாத்தியமே.
வைரஸ் பரவலாக்கங்களின் புரோட்டீன் சூடோடைப்பிங்கை உறையிடுதல்[தொகு]
மேலே விவரிக்கப்பட்டுள்ள வைரஸ் பரவலாக்கங்கள் மிக வலுவான முறையில் தொற்றக்கூடிய இயல்பான குடியேற்ற உயிரணு பெருக்கங்களைக் கொண்டிருக்கின்றன.ரெட்ரோவைரஸ்கள் வரம்பிற்குட்பட்ட இயல்பான குடியேற்ற உயிரணு எல்லைகளைக் கொண்டிருக்கின்றன, ஆடனோவைரஸ்கள் மற்றும் ஆடனோ சார்ந்த வைரஸ்கள் பரந்த அளவிலான உயிரணுக்களை வலுவாக தொற்றமுடியும் என்றாலும் சில உயிரணு வகைகள் இந்த வைரஸ்களாலும் ஏற்படும் தொற்றுக்களுக்கு அடங்காமல் பிடிவாதமாக இருப்பவையாகும்.சந்தேகத்திற்குரிய உயிரணுவிற்குள்ளான இணைப்பு மற்றும் நுழைவு வைரஸின் மேற்புறமுள்ள புரோட்டீன் உறையினால் மத்தியஸ்தம் செய்யப்படுகிறது.ரெட்ரோவைரஸ்கள் மற்றும் ஆடனோ-சார்ந்த வைரஸ்கள் அவற்றின் சவ்வில் ஒற்றொ புரோட்டீன் மேற்பூச்சைக் கொண்டிருக்கின்றன, அதேசமயம் ஆடனோவைரஸ்கள் வைரஸின் மேற்புறத்திற்கு அப்பாலும் நீட்டிக்கச் செய்கின்ற மேலுறை புரோட்டீன் மற்றும் இழைமங்கள் ஆகிய இரண்டினாலும் மேற்பூச்சு இடப்பட்டிருக்கின்றன.இந்த வைரஸ்கள் ஒவ்வொன்றிலும் இருக்கும் மேலுறை புரோட்டீன்கள் ஹெபாரின் சல்பேட் போன்ற உயிரணு-மேற்பரப்பு மூலக்கூறுகளுக்கென்று பிணைந்துள்ளன, இது அவற்றை சாத்தியமுள்ள மேற்பரப்பின் மீது அடைத்துக்கொள்கிறது, அத்துடன் குறிப்பிட்ட புரோட்டீன் பெற்றுக்கொள்வது வைரஸ் புரோட்டீனில் அமைப்புரீதியான மாற்றங்களை மேம்படுத்துகின்ற நுழைவைத் தூண்டலாம், அல்லது உட்குழிவின் அமிலமாக்கம் இந்த வைரஸ் மேற்பூச்சின் மறுமடிப்பை தூண்டுகின்றவிடத்தில் உள்ள எண்டோசோம்களில் அடைத்துக்கொள்ளலாம். இந்த இரண்டில் ஒன்றில் குடியேற்ற உயிரணுக்குள்ளான சாத்தியமுள்ள நுழைவிற்கு வைரஸின் மேற்பரப்பில் உள்ள புரோட்டீனுக்கும் உயிரணுவின் மேற்பரப்பில் உள்ள புரோட்டீனுக்கும் இடையே சாதகமான ஒருங்கிணைப்பு தேவைப்படுகிறது. மரபணு சிகிச்சையின் நோக்கத்திற்காக, மரபணு சிகிச்சை பரவலாக்கலின் மூலம் மரபணு மாற்றத்திற்கு சந்தேகத்திற்கிடமாக உள்ள உயிரணுக்களின் அளவை ஒருவர் வரம்பிற்குட்படுத்திக்கொள்ளவோ அல்லது நீட்டித்துக்கொள்ளவோ செய்யலாம்.இதன் முடிவில், வைரஸ் மேலுறை புரோட்டீன்கள் மற்ற வைரஸ்களிலிருந்து வந்துள்ள மேலுறை புரோட்டீன்களாலோ அல்லது கைமேரிக் புரோட்டீன்களாலோ உள்ளிருந்து உருவாகும் வகையில் பல பரவலாக்கங்களும் மேம்படுத்தப்பட்டுள்ளன.இதுபோன்ற கைமேரா, வெளிப்புற தொற்று வைரஸிற்கும் அதேபோன்று குறிப்பிட்ட குடியேற்ற உயிரணு புரோட்டீன்களோடு ஒருங்கிணைவதற்கென்று உள்ள தொடர் வரிசையோடும் சேர்த்துக்கொள்வதற்கு அவசியமான வைரஸ் புரோட்டீன்களின் பாகங்களை கொண்டிருக்கிறது. மேலுறை புரோட்டீன்கள் மாற்றியமைக்கப்படுகின்ற வைரஸ்கள் சூடோடைப்டு வைரஸ்கள் என்று விவரிக்கப்பட்டு குறிப்பிடப்படுகின்றன. உதாரணத்திற்கு, மரபணு சிகிச்சை பரிசோதனைகளில் பயன்படுத்துவதற்கான மிகவும் பிரபலமான ரெட்ரோவைரஸ் பரவலாக்கமானது வெஸிகுலர் ஸ்டோமாடிடிஸ் வைரஸிலிருந்து மேலுறை புரோட்டீன்கள், ஜி-புரோட்டீன்கள் ஆகியவற்றைக் கொண்டு மேற்பூச்சிடப்பெற்ற லென்டிவைரஸ் சிமியன் இம்முனோடிஃபிஷியன்ஸி வைரஸாக உள்ளது. இந்த பரவலாக்கம் விஎஸ்வி ஜி-சூடோடைப்டு லென்டிவைரஸ் என்று குறிப்பிடப்படுவதோடு கிட்டத்தட்ட ஒட்டுமொத்த உயிரணுத்தொகுதிகளிலும் தொற்றுக்களை ஏற்படுத்துவதாக உள்ளது. இந்த உயிர்ப்பொருள் அசைவு இந்த பரவலாக்கம் மேற்பூச்சிடப்பட்டுள்ள விஎஸ்வி ஜி-புரோட்டீனின் தன்மையாகும்.ஒன்று அல்லது ஒருசில குடியேற்ற உயிரணு பெருக்கங்களுக்கான வைரஸ் பரவலாக்கங்களின் உயிர்ப்பொருள் அசைவை வரம்பிற்குட்படுத்த பல முயற்சிகள் மேற்கொள்ளப்பட்டிருக்கின்றன. இந்த முன்னேற்றம் சிறிய அளவிலான பரவலாக்கத்தைக் கொண்டு முறைப்படியான சிகிச்சையளிப்பதற்கு உதவுகிறது. இலக்கில் இல்லாத உயிரணு மேம்படுத்தலுக்கு உள்ள சாத்தியம் வரம்பிற்குட்படுத்தப்படும் என்பதோடு மருத்துவ சமூகத்திடமிருந்து வரும் பல கவலைக்குரிய அம்சங்களும் நீக்கப்படும்.உயிர்ப்பொருள் அசைவை வரம்பிற்குட்படுத்துவதற்கான பல முயற்சிகளும் எதிர்உயிரி கூறுகளை சுமந்திருக்கும் கைமேரிக் மேலுறையிட்ட புரோட்டீன்களைப் பயன்படுத்துகின்றன. இந்த பரவலாக்கங்கள் "மேஜிக் புல்லட்" மரபணு சிகிச்சைகளின் மேம்பாட்டிற்கான பெருமளவிலான உறுதிப்பாட்டை வழங்குகின்றன.
வைரஸ்-அல்லாத முறைகள்[தொகு]
வைரஸ் அல்லாத முறைகள் எளிய பெரிய அளவிலான உற்பத்திகளுடன் வைரஸ் முறைகள் மீதான சில குறிப்பிட்ட அனுகூலங்களை வழங்குகின்றன, குறைவான குடியேற்ற இம்முனோஜெனிசி்ட்டி இரண்டு மட்டுமே ஆகும்.முன்னதாக, குறைந்த அளவிலான டிரான்ஸ்ஃபெக்ஸன் மற்றும் மரபணுவின் வெளிப்பாடு ஒரு அனுகூலமற்ற வைரஸ்-அல்லாத முறைகளாக பார்க்கப்பட்டது; இருப்பினும், பரவலாக்க தொழில்நுட்பத்திலான சமீபத்திய முன்னேற்றங்கள் வைரஸ்களைப் போன்ற டிரான்ஸ்ஃபெக்ஸன் திறன்களோடு மூலக்கூறுகளையும் உத்திகளையும் வழங்கியுள்ளன.
வெற்று டிஎன்ஏ[தொகு]
இது வைரஸ் அல்லாத டிரான்ஸ்ஃபெக்ஸனின் எளிய முறையாகும்.வெற்று டிஎன்ஏ பிளாஸ்மிட்டின் இன்ட்ராமஸ்குலர் இன்ஜென்க்ஸனால் நடத்தப்படும் மருத்துவப் பரிசோதனைகள் சில வெற்றிகளைத் தந்துள்ளன; இரு்பபினும், இந்த வெளிப்பாடு மற்ற டிரான்ஸ்ஃபெக்ஸன் முறைகளோடு ஒப்பிடுகையில் மிகவும் குறைவானதாகவே இருக்கிறது.பிளாஸ்மிடுகளைக் கொண்டு செய்யப்பட்ட பரிசோதனைகளுக்கும் மேலாக, இதேபோன்ற அல்லது இதைவிட பெரிய வெற்றிபெற்ற வெற்று பிசிஆர் தயாரிப்பைக் கொண்டு செய்யப்பட்ட பரிசோதனைகளும் உள்ளன. இருப்பினும் இந்த வெற்றி மற்ற முறைகளோடு ஒப்பிடப்படவில்லை என்பதுடன், எலக்ட்ரோபோரேஷன், சோனோபோரேஷன் போன்ற வெற்று டிஎன்ஏவை வழங்குவதற்கான மிகவும் பயன்மிக்க முறைகளிலான ஆராய்ச்சிக்கும், உயர் அழுத்த வாயுவைப் பயன்படுத்தி உயிரணுவிற்குள்ளாக டிஎன்ஏ மேற்பூச்சுள்ள தங்க உட்பொருட்களை செலுத்துகின்ற "மரபணு துப்பாக்கியின்" பயன்பாட்டிற்கும் வழிவகுத்துள்ளது.
ஒலிகோநியூக்ளியோடைட்[தொகு]
நோய் ஏற்படுத்தும் நிகழ்முறையோடு சம்பந்தப்பட்ட மரபணுக்களை செயல்படவிடாமல் தடுப்பதற்காக மரபணு சிகிச்சையில் ஒலிகோநியூக்ளியோடைட் பயன்படுத்தப்படுகிறது.இதை அடைவதற்கு பல முறைகள் உள்ளன. பழுதான மரபணு மாற்றமடைவதைத் தடுப்பதற்கு இலக்கிடப்பட்ட மரபணுவில் குறிப்பிட்ட இடத்தில் ஆன்டிசென்ஸை பயன்படுத்துவது ஒரு வியூகமாகும்.மற்றொன்று, பழுதான மரபணுவின் மறுவடிவமாக்கல் mRNAஇல் உள்ள குறிப்பிட்ட பிரத்யேகமான தொடர்வரிசையோடு இணைப்பதற்கு உயிரணுவிற்கான சமிக்ஞை அளிப்பதற்கு siRNA எனப்படும் சிறிய மூலக்கூறுகளைப் பயன்படுத்தி பழுதடைந்த mRNAஇன் மாற்றுதலை தடுப்பதாகும், இதனால் மரபணு வெளிப்படுத்தப்படுகிறது.இலக்கிடப்பட்ட மரபணுவின் மறுவடிவமாக்கலை செயல்படுத்துவதற்கு தேவைப்படும் மறுவடிவமாக்கல் காரணிகளுக்கான சிதைவாக இரட்டை தனித்திருக்கும் ஒலிகோடியோக்சைநியூக்ளியோடைடுகளைப் பயன்படுத்துவது மேற்கொண்டு செய்யப்படும் மற்றொரு உத்தியாகும்.மறுவடிவமாக்கல் காரணிகள் பழுதான மரபணுவை மேம்படுத்துவதற்குப் பதிலாக சிதைவடைந்தவற்றோடு சேர்க்கப்படுகின்றன, இது இலக்கிடப்பட்ட மரபணுவின் மறுவடிவமாக்கலை குறைக்கிறது என்பதுடன் வெளிப்பாடுகளையும் குறைக்கிறது. மேலும், ஒற்றை தனித்திருக்கும் டிஎன்ஏ ஒலிகோநியூக்ளியோடைட்டுகள் மாற்றுருகொள்ளும் மரபணுவிற்குள்ளாக ஒற்றைத்தள மாற்றத்தை இயக்குவதற்கென்று பயன்படுத்தப்படுகின்றன.சரிசெய்வதற்கு மாதிரித் தளமாக உள்ள மத்திய தளம் மற்றும் இலக்குத் தளம் தவிர்த்து இலக்கு மரபணுவை நோக்கிய நியூக்ளியல் அமில மூலக்கூறுகளுடன் கூடிய கெட்டிப்படுத்தலுக்கென்று ஒலிகோநியூக்ளியோடைட் வடிவமைக்கப்பட்டுள்ளது.இந்த உத்தி ஒலிகோநியூக்ளியோடைட் மத்தியஸ்தம் செய்யும் மரபணு சரிசெய்தல், இலக்கு வைக்கப்பட்ட மரபணு சரிசெய்தல் அல்லது இலக்குவைக்கப்பட்ட நியூக்ளியோடைட் மாற்றுதல் எனப்படுகிறது.
லிபோலெக்ஸஸ் மற்றும் பாலிபிளக்ஸஸ்[தொகு]
உயிரணுவிற்குள்ளாக புதிய டிஎன்ஏ அனுப்புவதை மேம்படுத்துவதற்கு அந்க டிஎன்ஏ சேதப்படுத்தப்படுவதிலிருந்து பாதுகாக்கப்பட வேண்டும் என்பதுடன் உயிரணுக்குள்ளான அதனுடைய நுழைவு சௌகரியமானதாகவும் இருக்க வேண்டும்.இதன் முடிவில் புதிய மூலக்கூறுகளான லிபோலெக்ஸஸ் மற்றும் பாலிபிளக்ஸஸ் ஆகியவை டிரான்ஸ்ஃபெக்ஸன் நிகழ்முறையின்போது விரும்பத்தகாத வகையில் தரம்குறைவதிலிருந்து டிஎன்ஏவைப் பாதுகாப்பதற்கான திறனோடு உருவாக்கப்பட்டுள்ளன.
பிளாஸ்மிக் டிஎன்ஏவானது மைசில் அல்லது லிபோசோம் போன்ற முறைப்படியான கட்டமைப்பில் கொழுப்பு அமிலங்களைக் கொண்டு மூடப்பட்டிருக்கலாம்.முறைப்படியான கட்டமைப்பு டிஎன்ஏவுடன் சிக்கலாகும்போது அது லிபோபிளக்ஸ் எனப்படுகிறது.மூன்றுவகையான கொழுப்பு அமிலங்கள் உள்ளன, அனியோனிக் (நெகட்டிவாக சார்ஜ் செய்யப்பட்டது), நியூட்ரல், அல்லது காடியோனிக் (பாஸிட்டிவ்வாக சார்ஜ் செய்யப்பட்டது).துவக்க நிலையில் அனியோனிக் மற்றும் நியூட்ரல் கொழுப்பு அமிலங்கள் கலப்பு பரவலாக்கங்களுக்கென்று லிபோபிளக்ஸ் கட்டுமானங்களுக்காக பயன்படுத்தப்படுகின்றன.இருப்பினும், இவற்றுடன் சிறிய அளவிலான விஷத்தன்மை கலந்திருக்கிறது என்ற உண்மை இருந்தபோதிலும், அவை உடல் நீர்மங்களுடன் பொருந்திப் போகக்கூடியவை என்பதுடன் திட்டவட்டவட்டமான திசுவிற்கென்று ஏற்றுக்கொள்வதற்கான வாய்ப்புக்களும் இருக்கின்றன; அவை உற்பத்தி செய்யப்படுவதற்கு மிகவும் சிக்கலான மற்றும் நேரத்தை அதிகம் எடுத்துக்கொள்ளக்கூடியவை என்பதால் காடியோனிக் வடிவங்களுக்களுக்கான கவனம் செலுத்தப்பட வேண்டும்.
காடியோனிக் கொழுப்பு அமிலங்கள் அவற்றின் பாஸிட்டிவ் சார்ஜ் காரணமாக, லிபோசோம்களுக்குள்ளான டிஎன்ஏவின் மூடப்படுதலுக்கு ஏற்பாடு செய்யும் விதமாக முதலில் நெகட்டிவ்வாக சார்ஜ் செய்யப்பட்ட டிஎன்ஏ மூலக்கூறுகளை செறிவூட்டுவதற்கென்று பயன்படுத்தப்பட்டன.பின்னர் காடியோனிக் கொழுப்பு அமிலங்களைப் பயன்படுத்துவது குறிப்பிடத்தக்க அளவில் லிபோலெக்ஸ்ஸ்களின் நிலைப்புத்தன்மையை வலுப்படுத்துவதாக கண்டுபிடிக்கப்பட்டது.அவற்றின் சார்ஜ் செய்யப்படும் விளைவின் காரணமாக காடியோனிக் லிபோசோம்கள் உயிரணு மேற்சவ்வுடன் ஒருங்கிணைந்து செயல்படுகிறது, என்டோசைட்டோஸிஸ் உயிரணுக்கள் லிப்போலெக்ஸஸ்களை ஏற்றுக்கொள்வதன் மூலமாக பிரதான வழியாக இருப்பதாக பரவலாக நம்பப்படுகிறது.என்டோசைட்டோஸிஸின் விளைவாக எண்டோசோம்கள் உருவாகின்றன, இருப்பினும், மரபணுக்களால் என்டோசோமின் மேற்புறச்சவ்வை உடைத்துக்கொண்டு சைட்டோபிளாஸத்திற்குள்ளாக வெளியிடப்பட முடியவில்லை என்றால் தங்களது செயல்பாடுகளை அடைவதற்கு முன்பாக எல்லா டிஎன்ஏக்களும் அழிக்கப்படுமிடத்தில் அவை லைசோசோம்களுக்கு அனுப்பப்படும்.காடியோனிக் கொழுப்பு அமிலங்கள் தாங்களாகவே செறிவுபட்டு லிபோசோம்களுக்குள்ளாக டிஎன்ஏவை அடைத்துவைக்கின்றன என்று கண்டுபிடிக்கப்பட்டிருந்தாலும், "என்டோசோமால் தப்பித்தல்" என்ற வகையில் திறனற்றிருப்பதன் காரணமாக டிரான்ஸ்ஃபெக்ஸன் திறன் மிகவும் குறைவாக இருக்கிறது.இருப்பினும், உதவிக்கு வரும் கொழுப்பு அமிலங்கள் (டோப் போன்ற, வழக்கமாக எலக்ட்ரோநியூட்ரல் கொழுப்பு அமிலங்கள்)லிபோபிளஸஸ்களை உருவாக்க சேர்க்கப்பட்டபோது மிக அதிகமான டிரான்ஸ்ஃபெக்ஸன் செயல்திறன் உணரப்பட்டிருக்கிறது.பின்னாட்களில், என்டோசோமிலிருந்து டிஎன்ஏ தப்பிப்பதற்கான வழியமைத்துத் தரும் விதமாக என்சோமால் மேற்சவ்வுகளை நிலைமாறச் செய்வதற்கான திறனை குறிப்பிட்ட கொழுப்பு அமிலங்கள் பெற்றிருப்பது கண்டுபிடிக்கப்பட்டது, ஆகவே இத்தகைய கொழுப்பு அமிலங்கள் ஃப்யூஸோஜெனிக் லிபிட்கள் என்று அழைக்கப்பட்டன. இருப்பினும் காடியோனிக் லிபிசோம்கள் மரபணு வழங்கல் பரவலாக்கங்களுக்கான மாற்றாக பரவலாக பயன்படுத்தப்படுகின்றன, காடியோனிக் கொழுப்பு அமிலங்களின் டோஸ் அடிப்படையிலான விஷத்தன்மை அவற்றின் சிகிச்சைப் பயன்பாடுகளை வரம்பிற்குட்படுத்துவதாகவும் கண்டுபிடிக்கப்பட்டுள்ளது.
உயிரணுவில் கட்டியை கட்டுப்படுத்தி வைக்கும் மரபணுக்களை செயல்படுத்துகின்ற மற்றும் ஆன்கோஜீன்களின் செயல்பாட்டை குறைக்கின்ற அளிக்கப்பட்ட மரபணுக்கள் இருக்குமிடத்தில் உள்ள புற்றுநோய் செல்களுக்குள்ளான மரபணு மாற்றத்தில் லிபோலெக்ஸஸ்கள் பொதுவாக பயன்படுத்தப்படுகின்றன. சுவாசம் சார்ந்த எபிதெலேலியல் உயிரணுக்களை டிரான்ஸ்ஃபெக்டிங் செய்வதில் லிபோபிளக்ஸஸ்கள் பயன்மிக்கவையாக உள்ளன என்று சமீபத்திய ஆய்வுகள் காட்டியுள்ளன, இதனால் சிஸ்டிக் ஃபைப்ரோஸிஸ் போன்ற மரபார்ந்த சுவாசம் சம்பந்தப்பட்ட நோய்களுக்கு சிகிச்சையளிக்க அவை பயன்படுத்தப்படலாம்.
டிஎன்ஏ உடனான பாலிமர்களின் கலப்புகள் பாலிபிளக்ஸெஸ்கள் என்று அழைக்கப்படுகின்றன.பெரும்பாலான பாலிபிளக்ஸஸ்களும் காடியோனிக் பாலிமர்களைக் கொண்டிருக்கின்றன என்பதோடு அவற்றின் உற்பத்தி ஐயோனிக் ஒருங்கிணைந்த செயல்பாடுகளால் முறைப்படுத்தப்படுகின்றன. பாலிபிளக்ஸெஸ்கள் மற்றும் லிபோபிளெக்ஸஸ்களின் செயல்பாட்டு முறைகளுக்கு இடையே உள்ள ஒரு பெரிய வித்தியாசம் என்னவெனில், பாலிபிளெக்ஸ்களால் தங்களது டிஎன்ஏவை சைட்டோபிளாஸத்தில் ஏற்றப்படும் வகையில் வெளியிட முடியாது என்பதாகும், இதனால் அதன் முடிவில் என்டோசோம்-லிட்டிக் துணைப்பொருட்களுடனான (என்டோசைடோடிஸின்போது செய்யப்பட்ட என்டோசைமை செறிவு குறைக்க பாலிபிளக்ஸ் மூலமான நிகழ்முறை உயிரணுக்குள் நுழைகிறது)இணை-டிரான்ஸ்ஃபெக்ஸன் அதாவது செயல்படாத ஆடனோவைரஸ் போன்றவை தோன்ற வேண்டும்.இருந்தபோதிலும், இது மட்டுமே விஷயமல்ல, பாலிஎதிலினமைன் போன்ற பாலிமர்கள் சிட்டோசன் மற்றும் டிரைமெதைல்சிட்டோசன் செய்வதுபோன்று தங்களுக்கென்று சொந்த என்டோசோ்ம் முறைகளையும் கொண்டிருக்கின்றன.
வீரிய முறைகள்[தொகு]
மரபணு மாற்றத்தின் ஒவ்வொரு முறைகளும் பற்றாக்குறையைக் கொண்டிருப்பதன் காரணமாக, இரண்டு அல்லது அதற்கு மேற்பட்ட உத்திகள் ஒன்றிணைந்த சில வீரிய முறைகளும் உருவாக்கப்பட்டிருக்கின்றன. வைரோசோம்கள் ஒரு உதாரணமாகும்; அவை செயல்படாத ஹெச்ஐவி அல்லது இன்ஃப்ளூயன்ஸா வைரஸ் உடன் லிபோசோம்களை ஒன்றிணைக்கின்றன.வைரஸ் அல்லது லிபிசோமல் முறைகளைக் காட்டிலும் சுவாசம் சார்ந்த எபிதீலியல் உயிரணுக்களில் மிகவும் பயன்மிக்க முறையில் மரபணு மாற்றம் நடைபெறும் என்பதை இது காட்டுகிறது.காடியோனிக் கொழுப்பு அமிலங்கள் மற்றும் வீரியமாக்கல் வைரஸ்களுடன் மற்ற வைரஸ் பரவலாக்கங்களை கலப்பதோடு மற்ற முறைகள் சம்பந்தப்பட்டிருக்கின்றன.
டென்ட்ரிமர்ஸ்[தொகு]
டென்ட்ரிமர் என்பது உயர்மட்ட அளவில் கிளைகொண்ட கோளவடிவத்துடன் கூடிய பேரளவு மூலக்கூறாகும்.இந்த அணுத்துகளின் மேற்பரப்பு பல வழிகளிலும் செயல்படுத்தப்படலாம் என்பதோடு, இதன் விளைவான கட்டுமானத்தின் பல துணைப்பொருள்களும் அதன் மேற்புறத்தின் அடிப்படையில் தீர்மானிக்கப்படுகிறது.
குறிப்பிட்டு சொல்லவேண்டுமெனில், காடியோனிக் டென்ட்ரிமரை கட்டமைப்பதென்பது சாத்தியமே, அதாவது பாஸிட்டிவான மேற்புற சார்ஜ் கொண்டு.டிஎன்ஏ அல்லது ஆர்என்ஏ போன்ற மரபார்ந்த மூலப்பொருளின் இருப்பின்போது சார்ஜ் செய்யப்படுதலானது காடியோனிக் டென்ட்ரிமருடனான நியூக்ளிக் அமிலத்தின் தற்காலிக இணைப்பாக்கத்திற்கு வழிவகுக்கிறது.தனது சேரவேண்டிய இடத்தை அடைவதில் டென்ட்ரிமர்-நியூக்ளிக் அமில கரைசல் என்டோசைடோஸிஸ் வழியாக உயிரணுவிற்குள்ளாக பின்னர் எடுத்துச்செல்லப்படுகிறது.
சமீபத்தி ஆண்டுகளில் டிரான்ஸ்ஃபெக்ஸன் அளவீட்டிற்கான துணைப்பொருட்கள் காடியோனிக் கொழுப்பு அமிலங்களாக இருந்திருக்கின்றன.இத்தகைய போட்டித்திறனுள்ள மறுதுணைப்பொருட்களின் வரம்புகள் பின்வருவனவற்றை உள்ளிட்டிருப்பதாக தெரிவிக்கப்பட்டிருக்கின்றன: உயிரணு வகைகளின் எண்ணிக்கையை டிரான்ஸ்ஃபெக்ட் செய்யும் திறனின்மை, செயல்பாட்டு இலக்கிடப்பட்ட திறன்களை வலுவுள்ளதாக வைத்திருக்கும் திறனின்மை, விலங்கு மாதிரிகளுடனான பொருத்தமின்மை மற்றும் விஷத்தன்மை.டென்ட்ரிமர்கள் கோவேலன்ட் கட்டுமானத்திற்கான வலுவை வழங்குகின்றன என்பதோடு மூலக்கூறின் கட்டமைப்பிலும் அளவிலும் உச்சபட்ச கட்டுப்பாட்டைக் கொண்டிருக்கின்றன.இவற்றுடன் சேர்த்து இவை இருக்கின்ற அணுகுமுறைகளுடன் ஒப்பிடுகையில் நிர்ப்பந்திக்கும் அனுகூலங்களை வழங்குகின்றன எனலாம்.
டென்ட்ரிமர்களை உற்பத்தி செய்வது என்பது வரலாற்றுரீதியாக மெதுவான மற்றும் செலவுபிடிக்கும் நிகழ்முறை என்பதோடு பல்வேறுவிதமான மெதுவான எதிர்வினைகளையும் கொண்டிருக்கின்றன, இது அவற்றின் வணிகரீதியான வளர்ச்சியை தீவிரமாக குறைத்துவிடுகின்ற தடைக்கல்லாகும்.மிச்சிகனை சேர்ந்த நிறுவனமான டென்ட்ரிடிக் நேனோடெக்னாலஜிஸ் இயக்கவிளைவான ரசாயன முறையைப் பயன்படுத்தி டென்ட்ரிமர்களை உற்பத்தி செய்யும் முறையைக் கண்டுபிடித்துள்ளது, இந்த நிகழ்முறை மூன்று மடங்கு செலவைக் குறைப்பதோடு மட்டுமல்லாமல் ஒரு மாதத்திற்கும் மேல் நீடிக்கும் எதிர்வினை நேரத்தை சில நாட்களாக குறைத்துள்ளது. இந்த புதிய "பிரையோஸ்டார்" டென்ட்ரிமர்கள், விஷத்தன்மை குறைவான அல்லது விஷத்தன்மை அற்ற உயர் திறனோடு உயிரணுக்களை டிரான்ஸ்ஃபெக்ட் செய்யும் டிஎன்ஏ அல்லது ஆர்என்ஏவை சுமந்துசெல்வதற்கென்றே பிரத்யேகமாக கட்டமைக்க முடியும்.
மரபணு சிகிச்சையில் ஏற்பட்டுள்ள பெரும் முன்னேற்றங்கள்[தொகு]
This section is in a list format that may be better presented using prose. (September 2009) |
2002 மற்றும் அதற்கு முன்பாக[தொகு]
புதிய மரபணு சிகிச்சை அணுகுமுறை பழுதான மரபணுக்களிலிருந்து பெற்ற மெஸஞ்சர் ஆர்என்ஏக்களில் உள்ள தவறுகளை சரிசெய்கிறது.இந்த உத்தியானது இரத்தக் குலைவான தாலசீமியா, சிஸ்டிக் ஃபைப்ரோஸிஸ் மற்றும் சில புற்றுநோய்களை குணப்படுத்துவதற்கு திறன் வாய்ந்ததாக இருக்கிறது.பார்க்கவும் NewScientist.comஇல் நுட்பமான மரபணு சிகிச்சை இரத்தக் குலைவை கையாளுகிறது (அக்டோபர் 11, 2002).
கேஸ் வெஸ்டர்ன் பல்கலைக்கழகம் மற்றும் கோபர்நிக்கஸ் தெராபடிக்ஸ் ஆகியவற்றைச் சேர்ந்த ஆராய்ச்சியாளர்களால், நியூக்ளியர் சவ்விற்குள்ளாக சிகி்ச்சையளிக்கும் டிஎன்ஏவை துளையிட்டு கொண்டுசெல்லக்கூடிய சிறிய 25 நானோமீட்டர்கள் நீளமுள்ள லிபோசோம்களை உருவாக்க முடிந்துள்ளது.பார்க்கவும் NewScientist.comஇல் டிஎன்ஏ நானோபால்கள் மரபணு சிகிச்சைக்கு வலுவூட்டியுள்ளன (மே 12, 2002).
சிக்கிள் உயிரணு நோய் உள்ள எலிகளிடத்தில் வெற்றிகரமாக சிகிச்சையளிக்கப்பட்டுள்ளது.பார்க்கவும் மூரின் மரபணு சிகிச்சை சிக்கிள் உயிரணு நோயின் அறிகுறிகளை சரிசெய்கிறது மார்ச் 18, 2002இல் இருந்து தி சயிண்டிஸ்ட் இதழில்.
2000 மற்றும் 2002ஆம் ஆண்டுகளில் நடத்தப்பட்ட SCID (சிவியர் கம்பைண்டு இம்மூன் டிஃபிஷியன்ஸி அல்லது "பபிள் பாய்" நோய்) உள்ள குழந்தைகளுக்கு சிகிச்சையளிப்பதற்கென்று செய்யப்பட்ட பல-மைய பரிசோதனையின் வெற்றியானது பாரீஸ் மையத்தில் நடத்தப்பட்ட பரிசோதனையில் பத்து குழந்தைகளில் இருவருக்கு இரத்தப் புற்றுநோய் போன்ற நிலை இருந்தது கண்டுபிடிக்கப்பட்டபோது அது குறித்த கேள்வி எழுப்பப்பட்டது. மருத்துவப் பரிசோதனைகள் 2002இல் தற்காலிகமாக நிறுத்திவைக்கப்பட்டன, ஆனால் அமெரிக்கா, யுனைட்டட் கிங்டம், பிரான்ஸ், இத்தாலி மற்றும் ஜெர்மனியில் செய்யப்பட்ட புரோட்டோகால் நெறிமுறை மறுஆய்விற்குப் பின்னர் தொடங்கப்பட்டன.[13]
1993இல் ஆண்ட்ரூ கோபியா சிவியர் கம்பைண்டு இம்முனோ டிஃபிஷியன்ஷியுடன் (SCID) பிறந்தார். பிறப்பிற்கு முந்தைய மரபணு பரிசோதனை அவருக்கு SCID இருப்பதாக காட்டியது. பிறந்தவுடனே ஆண்ட்ரூவிடமிருந்து தண்டு உயிரணுக்களைக் கொண்டிருந்த தொப்பூழ் கொடியும் தொப்பூழ் கொடி இணைப்பும் உடனடியாக அகற்றப்பட்டது. ஏடிஏவிற்கான குறியீடுகளை அளிக்கும் மரபார்ந்த உயிரணுக்கள் பெறப்பட்டதோடு அவை ரெட்ரோவைரஸூடன் சேர்க்கப்பட்டன. அவை தண்டு உயிரணுக்களின் குரோமோசோம்களுக்குள்ளாக சென்று சேர்ந்த பின்னர் ரெட்ரோவைரஸ்களும் தண்டு உயிரணுக்களும் ஒன்றுகலக்கப்பட்டன.செயல்படும் ஏடிஏவைக் கொண்டிருக்கும் தண்டு உயிரணுக்கள் இரத்த நாளத்தின் வழியாக ஆண்ட்ரூவின் இரத்த அமைப்பிற்குள்ளாக செலுத்தப்பட்டன. ஏடிஏ என்சைம் உட்செலுத்தல் வாராந்திர அடிப்படையில் வழங்கப்பட்டது.நான்கு வருடங்களுக்கு தண்டு உயிரணுக்களால் உருவாக்கப்பட்ட டி-உயிரணுக்கள் (வெள்ளை இரத்த உயிரணுக்கள்) ஏடிஏ மரபணு பயன்படுத்தும் ஏடிஏ என்சைம்களாக செய்தது. நான்கு வருடங்களுக்குப் பின்னர் அதிகப்படியான சிகிச்சை தேவைப்பட்டது.
2003[தொகு]
2003இல் கலிபோர்னியா பல்கலைக்கழக, லாஸ் ஏஞ்சல்ஸ் ஆராய்ச்சிக் குழு, பாலிஎதிலீன் கிளைகோல் (PEG) எனப்படும் பாலிமர் மேற்பூச்சிடப்பட்ட லிபோசோம்களைப் பயன்படுத்தி மூளைக்குள்ளாக மரபணுக்களை செலுத்தியது. மூளைக்குள்ளாக மரபணுக்களை மாற்றுவது ஒரு குறிப்பிடத்தகுந்த சாதனைதான், ஏனென்றால் வைரஸ் பரவலாக்கங்கள் மூளை முழுவதிலும் இருக்கும் "இரத்த-மூளை தடையைத்" தாண்டிப் பெறுவதற்கு மிகப்பெரியதாக இருக்கிறது. இந்த முறை பார்க்கின்ஸன் நோய்க்கு சிகிச்சையளிப்பதற்கு திறன்மிக்கதாக இருக்கிறது. பார்க்கவும் NewScientist.comஇல் உளவுபார்க்கும் மரபணுக்கள் மூளைக்குள் செலுத்தப்பட்டன (மார்ச் 20, 2003).
ஆர்என்ஏ இடையீடு அல்லது மரபணு அமைதியாக்கம் என்பது ஹன்டிங்டனுக்கு சிகிச்சையளிப்பதற்கான புதிய வழிமுறையாக இருக்கலாம். இரட்டை தனித்திருக்கும் ஆர்என்ஏவின் சிறிய துண்டுகள் (சிறிய, இடையீடு செய்யும் ஆர்என்ஏக்கள் அல்லது siRNAக்கள்) ஆகியவை ஒரு குறிப்பிட்ட தொடர்வரிசையிலான ஆர்என்ஏவை தரமிழக்கச் செய்ய உயிரணுக்களால் பயன்படுத்தப்படுகிறது. ஒரு siRNA பழுதான மரபணுவிலிருந்து பிரதியெடுக்கப்பட்ட ஆர்என்ஏவோடு பொருந்தும் வகையில் வடிவமைக்கப்பட்டதென்றால், பின்னர் அந்த வழக்கத்திற்கு மாறான அந்த மரபணுவின் புரோட்டீன் உற்பத்தியானது நிகழாமலே போய்விடும். பார்க்கவும் NewScientist.comஇல் மரபணு சிகிச்சையானது ஹன்டிங்களை நிறுத்திவைக்கக்கூடும் (மார்ச் 13, 2003).
2006[தொகு]
தேசிய சுகாதார மையங்களின் (பதேஸ்டா, மேரிலேண்ட்) அறிவியலாளர்கள், மரபார்ந்தரீதியில் புற்றுநோய் உயிரணுக்களை மறுகுறிவைத்து தாக்குகின்ற கில்லர் டி உயிரணுக்களை இரண்டு நோயாளிகளிடத்தில் மெட்டாஸ்டேடிக் மெலானோமா சிகிச்சையை வெற்றிகரமாக செய்து முடித்துள்ளனர். மரபணு சிகிச்சை புற்றுநோய்க்கு சிகிச்சையளிப்பதிலும் திறன்மிக்கதாக செயல்படுகிறது என்பதற்கு இந்த ஆய்வு முதலாவது நிரூபணமாகும்.[14]
மார்ச் 2006இல் சர்வதேச அறிவியலாளர்கள் குழு மைலாய்ட் உயிரணுக்களை பாதித்த நோய்க்கான சிகிச்சைக்காக இரண்டு வயது முதிர்ந்த நோயாளிகளுக்கு மரபணு சிகிச்சையைப் பயன்படுத்தி வெற்றிகரமாக சிகிச்சையளித்தாக அறிவித்தது. நேச்சர் மெடிசினில் பதிப்பிக்கப்பட்ட இந்த ஆய்வு, மைலாய்ட் அமைப்பிலுள்ள நோய்களையும் மரபணு சிகிச்சை கொண்டு குணப்படுத்த முடியும் என்று நிரூபித்த முதலாவது ஆய்வாக கருதப்படுகிறது.[15]
மே 2006இல் இத்தாலி மிலனில் உள்ள மரபணு சிகிச்சைக்கான சான் ரஃபேல் டெலதான் நிறுவனத்தைச் (HSR-TIGET) சேர்ந்த டாக்டர்.லூய்ஜி நால்டின் மற்றும் டாக்டர்.பிரைன் பிரவுன் ஆகியோரால் வழிநடத்தப்பட்ட ஒரு அறிவியலாளர்கள் குழு, புதிதாக செலுத்தப்பட்ட மரபணுவை திருப்பியனுப்புவதிலிருந்து இம்மூன் அமைப்பை தடுக்கின்ற புதிய வழியை தாங்கள் உருவாக்கியுள்ளதாக அறிவித்து இது மரபணு சிகிச்சையில் பெரும் முன்னேற்றம் என்று தெரிவித்துள்ளனர்.[16] உடல் உறுப்பு மாற்றத்தைப் போன்று, மரபணு சிகிச்சையும் நோயெதிர்ப்பு அமைப்பின் மறுப்பினால் பாதிக்கப்படுகிறது. இதுவரையில், சாதாரண மரபணுவின் செலுத்துதலானது, நோயெதிர்ப்பு அமைப்பு அதனை ஒரு அந்நியப் பொருளாக கருதி அதை சுமந்திருக்கும் உயிரணுக்களை திருப்பி அனுப்பிவிடுவதால் அது சிக்கலானதாக இருந்தது. இந்தப் பிரச்சினையைத் தீர்ப்பதற்கு, HSR-TIGET குழுவானது மைக்ரோஆர்என்ஏ எனப்படும் மூலக்கூறுகள் மூலமாக நெறிப்படுத்தப்பட்ட மரபணுக்களின் புதிதாக வெளிப்படுத்தப்பட்ட நெட்வொர்க்கைப் பயன்படுத்தியது. நோயெதிர்ப்பு அமைப்பிலுள்ள உயிரணுக்களில் உள்ள மைக்ரோஆர்என்ஏவின் சிகிச்சையளிக்கும் மரபணுவின் தேர்ந்தெடுக்கப்பட்ட அடையாளங்களை நிறுத்தி அதன் இயல்பான செயல்பாட்டை பயன்படுத்துவதென்றும், அந்த மரபணு கண்டுபிடிக்கப்பட்டு அழிக்கப்படுவதை தடுத்து நிறுத்துவது என்றும் டாக்டர்.நால்டினியின் குழுவினர் விளக்கமளித்தனர். ஆராய்ச்சியாளர்கள் மைக்ரோஆர்என்ஏ இலக்குவைக்கப்பட்ட தொடர்வரிசையை உள்ளிட்ட மரபணுவை ஒரு எலியின் உடலில் செலுத்தினர், ஆச்சர்யப்படும்விதமாக முன்பு மைக்ரோஆர்என்ஏ இலக்குவைக்கப்பட்ட தொடர்வரிசை இல்லாமல் பயன்படுத்தப்பட்டபோது நடந்தது போல் அல்லாமல் அந்த எலி அந்த மரபணுவை வெளியேற்றிவிடவில்லை. இந்தச் செயல்பாடு மரபணு சிகிச்சையின் மூலம் ஹூமோஃபிளியா மற்றும் பிற மரபார்ந்த நோய்களுக்கான சிகிச்சையில் ஒரு முக்கியமான தாக்கத்தை ஏற்படுத்தும்.
2007[தொகு]
மே 1 2007இல் மூர்ஃபீல்ட்ஸ் கண் மருத்துவமனை மற்றும் லண்டன் பல்கலைக்கழக கல்லூரியின் கண் மருத்துவ நிறுவனம் ஆகியவை பரம்பரையாக பெற்ற விழித்திரை நோய்க்கான உலகின் முதலாவது மரபணு சிகிச்சை பரிசோதனையை அறிவித்தது. முதல் அறுவை சிகிச்சை 23 வயதான ராபர்ட் ஜான்சன் என்ற பிரித்தானிய ஆணிடம் 2007ஆம் முற்பகுதியில் செய்யப்பட்டது.[17] லெபர்ஸ் கோன்ஜெனிடல் அமரோஸிஸ் என்பது RPE65 மரபணுவில் ஏற்படும் மாற்றுரு செயல்பாட்டினால் பரம்பரையாக பெறப்படும் கண்குருடு நோயாகும். மூர்ஃபீல்ட்ஸ்/யுசிஎல் பரிசோதனையின் முடிவுகள் ஏப்ரல் 2008இல் நியூ இங்கிலாந்து ஜர்னல் ஆஃப் மெடிசினில் பதிப்பிக்கப்பட்டன. அவர்கள் RPE65 மரபணுவை சுமக்கின்ற ஆடனோ அசோசியேட்டட் வைரஸின் (ஏஏவி) மறுகலவையாக்கத்தின் துணை விழித்திரை வழங்கலின் பாதுகாப்பை பற்றி ஆராய்ச்சி செய்திருக்கின்றனர், அத்துடன் இது நோயாளிகளிடத்தில் பார்வையில் மிதமான அதிகரிப்பை வழங்குகின்ற வகையில் சாதகமான முடிவுகளை அளித்திருக்கிறது என்பதுடன் தெளிவான பக்க விளைவுகள் எதுவுமில்லை என்றும் கண்டுபிடித்திருக்கின்றனர்.[18]
2009[தொகு]
செப்டம்பர் 2009இல், நேச்சர் இதழானது, வாஷிங்டன் பல்கலைக்கழகம் மற்றும் கலிபோர்னியா பல்கலைக்கழகம் ஆகியவை மரபணு சிகிச்சையைப் பயன்படுத்தி சிறு குரங்குகளுக்கான டிரைகுரோமேட்டிக் பார்வைக் குறைபாட்டிற்கான சிகிச்சை அளித்துள்ளனர், இது நிறக்குருடு உள்ள மனிதர்களிடத்தில் சிகிச்சையளிப்பதற்கு நம்பிக்கைதரும் முன்னோடி என்று தெரிவித்துள்ளது.[19]
பிரச்சினைகளும் அறம்சார் நிலைப்பாடுகளும்[தொகு]
மரபணு சிகிச்சையின் பாதுகாப்பிற்கான நடப்பு சிந்தனையில் வைஸ்மன் தடையே அடிப்படையாக உள்ளது.சோமா-டு-ஜெர்ம்லைன் பின்னூட்டமும் சாத்தியமற்றிருக்கிறது. இருப்பினும், வைஸ்மன் தடையை உடைப்பதற்கான சில அறிகுறிகளும்[20] காணப்படுகின்றன.இதைத் தகர்ப்தற்குள்ள சாத்தியமுள்ள வழிகளுள் ஒன்று இந்த சிகிச்சை எப்படியோ ஒருவகையில் தவறாகப் பயன்படுத்தப்பட்டு சோதனைகளுக்கும் பரவி அதனால் சிகிச்சையின் நோக்கங்களுக்கு மாறாக ஜெர்ம்லைனை தொற்றுவதால் ஆகும்.
மரபணு சிகிச்சையில் உள்ள சில பிரச்சினைகளாவன:
- குறுகிய கால ஆயுள் கொண்ட மரபணு சிகிச்சை - எந்த ஒரு நிலைக்கும் மரபணு சிகிச்சை ஒரு நிலையான குணப்படுத்தியாக மாறும் முன்னர், இலக்கு வைக்கப்பட்ட உயிரணுக்குள்ளாக செலுத்தப்படும் சிகிச்சை டிஎன்ஏ செயல்படும் நிலையிலேயே இருக்க வேண்டும் என்பதுடன் இந்த சிகிச்சை டிஎன்ஏவைக் கொண்டிருக்கும் உயிரணுக்கள் நீண்ட காலம் வாழ்பவையாகவும் நிலையானவையாகவும் இருக்க வேண்டும். சிகிச்சை டிஎன்ஏ மரபணுவிற்குள்ளாக ஒருங்கிணைவதிலுள்ள பிரச்சினைகள் மற்றும் விரைவாக பிரிந்துவிடும் இயல்புள்ள பல உயிரணுக்கள் ஆகியவை மரபணு சிகிச்சை நீண்ட கால பலன் தருவதிலிருந்து தடுத்துவிடுகின்றன. நோயாளிகள் பல சுற்று மரபணு சிகிச்சைகளுக்கு உட்பட வேண்டியிருக்கும்.
- நோயெதிர்ப்பு அமைப்பு எதிர்வினை - மனித திசுவிற்குள்ளாக எந்த நேரத்தில் வேண்டுமானாலும் ஒரு அந்நியப் பொருள் சேர்ந்துவிடலாம், இந்த நோயெதிர்ப்பு அமைப்பான அந்த ஊடுருவும் பொருளை தாக்கத் தொடங்கிவிடுகிறது.இம்முறையில் நோயெதிர்ப்பு அமைப்பைத் தூண்டுவதில் உள்ள அபாயத்தினால் மரபணு சிகிச்சையின் பலனளிப்புத் திறன் குறைவதற்கு எப்போதுமே சாத்தியமுளளதாக இருக்கிறது.
இதற்கும் மேலாக, முன்னர் பார்த்ததுபோல் நோயெதிர்ப்பு அமைப்பின் ஊடுருவல்களுக்கான வலுவான எதிர்ப்பினால் மரபணு சிகிச்சையை நோயாளிகளிடத்தில் மீண்டும் மீண்டும் அளிப்பது சிக்கலானதாகிறது.
- வைரஸ் பரவலாக்கங்களுடனான பிரச்சினைகள் - பெரும்பாலான ஆய்வுகளிலும் மரபணு சிகிச்சையை சுமந்துசெல்பவையாக கருதப்படும் வைரஸ்கள் நோயாளிகளிடத்தில் பல்வேறுவிதமான வீரியமுள்ள பிரச்சினைகளை ஏற்படுத்துபவையாக இருக்கின்றன - விஷத்தன்மை, நோயெதிர்ப்பு மற்றும் எரிச்சலான எதிர்வினைகள் மற்றும் மரபணு கட்டுப்பாடு மற்றும் இலக்குவைக்கப்பட்ட திசுக்கள்.மேலும், வைரஸ் பரவலாக்கமானது நோயாளிகளின் உடலில் ஒருமுறை செலுத்தப்பட்டுவிட்டால் நோயை ஏற்படுத்தும் திறனை திரும்பப் பெற்றுவிடுவதற்கான வாய்ப்பிருப்பதற்கான அச்சமும் எப்போதுமே இருந்துகொண்டிருக்கிறது.
- பல மரபணு குலைவுகள் - ஒற்றை மரபணுவில் மறுவடிவமாக்கங்களால் ஏற்படும் நிலைகள் மற்றும் குலைவுகள் மரபணு சிக்ச்சைக்கான சிறந்த பிரதிநிதிகள் ஆகும்.
துரதிஷ்டவசமாக, இதய நோய், உயர் இரத்த அழுத்தம், அல்சைமர் நோய்கள், மூட்டுவலிகள் மற்றும் நீரிழிவு நோய்கள் போன்ற மிகப் பொதுவாக ஏற்படும் சில குலைவுகள் பல மரபணுக்களிலும் ஏற்படும் மாறுபாடுகளின் ஒருங்கிணைந்த விளைவுகளினால் ஏற்படுகின்றன. இவைபோன்ற பல மரபணு அல்லது பல காரணிகள் கொண்ட குலைவுகள் மரபணு சிகிச்சையைப் பயன்படுத்தி திறன்மிக்க வகையில் சிகிச்சையளிப்பதற்கு மிகவும் சிக்கலானவையாகும்.
- டியூமர் தூண்டப்படுவதற்கான வாய்ப்பு (உட்செலுத்தல் மரபணு மறுவடிவமாக்கம்) - டிஎன்ஏவானது மரபணுவின் தவறான இடத்தில் ஒருங்கிணைந்தது என்றால், உதாரணத்திற்கு டியூமரை கட்டுப்படுத்தும் மரபணுவில், அது டியூமர் உருவாக்கத்தைத் தூண்டலாம்.
இது எக்ஸ்-லின்க்டு சிவியர் கம்பைண்டு இம்முனோடிஃபிஷியன்சி (X-SCID)[21] உள்ள நோயாளிகளிடத்தில், ரெட்ரோவைரஸைப் பயன்படுத்தி சரிசெய்யும் மாற்றுமரபணுவுடன் ஹீமோடோபெடிக் தண்டு உயிரணுக்கள் தூண்டப்படும் வகையில் தோன்றியுள்ளது, இது 20 நோயாளிகளிடத்தில் 3 பேர்களிடம் டி உயிரணு இரத்தப்புற்றுநோய் உருவாவதற்கு வழிவகுத்தது.
மரபணு சிகிச்சையின்போது ஜெஸ்ஸி கெல்சிங்கரின் மரணம் உள்ளிட்ட சில மரணங்கள் ஏற்பட்டுள்ளன.[22]
பிரபல கலாச்சாரத்தில்[தொகு]
- டார்க் ஏஞ்சல்ஸ் என்ற தொலைக்காட்சித் தொடரில் டிரான்ஸ்ஜெனிக்ஸ் மீதும் மாண்டிகோரில் உள்ள பதிலாள் தாயார்கள் மீதும் செய்யப்படும் விஷயங்களும் ஒன்றாக மரபணு சிகிச்சை குறிப்பிடப்பிடப்பட்டுள்ளது, பிராடிகி அத்தியாயத்தில், வயது முதிராத, பித்துபிடித்த/கோகெய்ன் அடிமையானவரின் சைவ உணவுப்பழக்கமுள்ள குழந்தையான ஜூடை டாக்டர்.டனேகா பெரு முன்னேற்றமடைந்த புதிய வகைப்பட்ட மரபணு சிகிச்சையைப் பயன்படுத்தி இளம் மேதையாக மாற்றுகிறார்.
- மெடல் கியர் சாலிட் என்ற வீடியோ கேமில் அதிமுக்கிய கதைக்கருவாக மரபணு சிகிச்சை உள்ளது, அங்கே இது எதிரி வீரர்களின் போரிடும் திறன்களை வலுப்படுத்துவதற்கென்று பயன்படுத்தப்படுகிறது.
- ஸ்டார்கேட் அட்லாண்டிஸ் என்ற அறிவியல் புனைகதைத் தொடரில் மரபணு சிகிச்சை முக்கியப் பாத்திரம் வகிக்கிறது, அந்தத் தொடரில் மரபணு சிகிச்சையின் வழியாக குழு உறுப்பினர்களுக்கு குறிப்பிட்ட மரபணுவை வழங்க முடிந்தால் மட்டுமே ஒரு குறிப்பிட்ட வேற்றுகிரக தொழில்நுட்பத்தை பயன்படுத்த முடியும் என்பதாக இருக்கும்.
- டை அனதர் டே என்ற ஜேம்ஸ் பாண்ட் படத்தில் மரபணு சிகிச்சையும் ஒரு முக்கியப் பங்கு வகித்தது.
- ஃபிராங்க் மில்லரின் சின் சிட்டி யில் வரும் தி யெல்லோ பாஸ்டர்ட் மரபணு சிகிச்சை பெற்றவராவார்.
- தி டார்க் நைட் ஸ்ட்ரைக்ஸ் அகெய்ன்இல், முதல் ராபினான டிக் கிரேசன், தி ஜோக்கராக மாற்றப்படுவதற்கு லெக்ஸ் லூதரின் பல வருட விரிவான மரபணு சிகிச்சைக்கு பலியாகும் நபராவார்.
- தற்போது ஒளிபரப்பப்பட்டுவரும் அறிவியல் புனைகதை தொலைக்காட்சி நிகழ்சசியான ரீஜெனிஸிஸில் மரபணு சிகிச்சை தொடர்ந்து வரும் ஒரு கதாபாத்திராமாகவே இருக்கிறது, அதில் பல்வேறு நோய்களை குணப்படுத்தவும், விளையாட்டுத் திறனை வலுப்படுத்தவும் மற்றும் உயிர்-தொழில்நுட்ப நிறுவனங்களுக்கு அதிக லாபம் ஈட்டித்தருவதற்கென்றும் பயன்படுத்தப்படுகிறது. (உதாரணத்திற்கு. கண்டுபிடிக்க முடியாத செயல்திறன்-வலுப்படுத்தும் மரபணு சிகிச்சையை அதில் வரும் ஒரு கதாபாத்திரம் தாமாக பயன்படுத்திக்கொள்கிறது, ஆனால் காப்புரிமை ஒப்புதலை தவிர்த்துவிடுகிறது, இந்த மரபணு சிகிச்சை அபாயகரமான கார்டியோவாஸ்குலர் பிரச்சினையை ஏற்படுத்தும் அபாயமின்மைக்கென்று பரிசோதிக்கப்பட்டதிலிருந்து அசலான ஒன்றிற்கு மேம்படுத்தப்படுகிறது).
- ஐ ஆம் லெஜண்ட் என்ற திரைப்படத்தின் முக்கிய கதைக்கரு மரபணு சிகிச்சையே ஆகும்.
- விளையாட்டின் உள்ளடக்கம் பிளாஸ்மிடுகள் மற்றும் [மரபணு] ஸ்லைசர்கள் என்று குறிப்பிடப்படுகின்ற பயோஷாக் என்ற விளையாட்டில் மரபணு சிகிச்சை முக்கியமான கருவாக இருக்கிறது.
- மைக்கேல் கிரிச்டன் எழுதிய நெக்ஸ்ட் என்ற புத்தகம் மரபணு சிகிச்சை பரிசோதனைகளில் ஈடுபட்டிருக்கும் புனைவான உயிர்தொழில்நுட்ப நிறுவனங்களின் கதையை திருப்பங்களோடு விவரிக்கிறது.
- அலைஸ் என்ற தொலைக்காட்சி தொடரில் மூலக்கூறு மரபணு சிகிச்சையிலான பெரு முன்னேறமடைந்த ஒரு மூலக்கூறு கண்டுபிடிக்கப்படுகிறது, அதில் ஒரு நோயாளில் உடல் வேறு ஒருவரைப் போன்ற உடல் வடிவத்திற்கு மறுவடிவமாக்கம் செய்யப்படுகிறது. கதாநாயகனான சிட்னி பிரிஸ்டோவின் உற்ற நன்பண் அவனை ரகசியமாக கொலைசெய்து அவனுடைய "இரட்டையாக" அவனித்தை எடுத்துக்கொள்கிறான்.
கூடுதல் பார்வைக்கு[தொகு]
- ஆன்டிசென்ஸ் சிகிச்சை
- டிஎன்ஏ
- மரபணுவியல் கட்டுமானம்
- முன்னூகிப்பு மருந்து
- முழு மரபணு தொடர்வரிசையாக்கம்
- ஆயுள் நீட்டிப்பு
- ஆயுள் நீட்டிப்பு சார்ந்த விஷயங்களின் பட்டியல்
- தொழில்நுட்ப மதிப்பீடு
- சிகிச்சை மரபணு மேம்படுத்தல்
- மருந்தாக்கியல் மரபணு சிகிச்சை
குறிப்புகள்[தொகு]
- ↑ U.S. Food & Drug Administration. "What is Gene Therapy?". fda.gov. FDA. பார்க்கப்பட்ட நாள் 21 February 2021.
- ↑ .
- ↑ Gene Therapy Clinical Trials Worldwide Database பரணிடப்பட்டது 2020-07-31 at the வந்தவழி இயந்திரம். The Journal of Gene Medicine. Wiley (June 2016)
- ↑ "Safety and efficacy of gene transfer for Leber's congenital amaurosis". The New England Journal of Medicine 358 (21): 2240–2248. May 2008. doi:10.1056/NEJMoa0802315. பப்மெட்:18441370.
- ↑ "Retinal gene therapy in patients with choroideremia: initial findings from a phase 1/2 clinical trial". Lancet 383 (9923): 1129–1137. March 2014. doi:10.1016/S0140-6736(13)62117-0. பப்மெட்:24439297.
- ↑ Gotweis, H (22 May 2002). "Gene therapy and the public: a matter of trust". Gene Therapy 9: 667-669. https://www.nature.com/articles/3301752.
- ↑ Coutelle C. (1996) Gene Therapy for Inherited Genetic Disease: Possibilities and Problems. In: Gregoriadis G., McCormack B. (eds) Targeting of Drugs 5. NATO ASI Series (Series A:Life Sciences), vol 290. Springer, Boston, MA. https://doi.org/10.1007/978-1-4615-6405-8_1
- ↑ McIvor, RS. "Gene therapy of genetic diseases and cancer". Pediatr Transplant 3 (Suppl 1): NIH, National Library of Medicine, NCBI. doi:10.1034/j.1399-3046.1999.00050.x. பப்மெட்:10587981. https://pubmed.ncbi.nlm.nih.gov/10587981/. பார்த்த நாள்: 5 March 2021.
- ↑ Greely, H.T. (2001). International Encyclopedia of the Social & Behavioral Sciences. Ethical Issues in the ‘New’ Genetics: Science Direct, Elsvier Ltd. பக். 4762-4770. https://www.sciencedirect.com/science/article/pii/B0080430767033647. பார்த்த நாள்: 5 March 2021.
- ↑ Christopher Gyngell, Marie Sklodowska‐Curie Fellow, Thomas Douglas, Senior Research Fellow, and Julian Savulescu, Professor, Director (2017 Aug). "The Ethics of Germline Gene Editing". J Appl Philos 34 (4): 498-513. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5573992/.
- ↑ மனித மரபணுத் திட்டத் தகவல்: மரபணு சிகிச்சை
- ↑ Durai S, Mani M, Kandavelou K, Wu J, Porteus MH, Chandrasegaran S (2005). "Zinc finger nucleases: custom-designed molecular scissors for genome engineering of plant and mammalian cells". Nucleic Acids Res. 33 (18): 5978–90. doi:10.1093/nar/gki912. பப்மெட்:16251401.
- ↑ Cavazzana-Calvo M, Thrasher A, Mavilio F (Feb 2004). "The future of gene therapy". Nature 427 (6977): 779–81. doi:10.1038/427779a. பப்மெட்:14985734.
- ↑ Morgan RA, Dudley ME, Wunderlich JR, et al. (Oct 2006). "Cancer regression in patients after transfer of genetically engineered lymphocytes". Science 314 (5796): 126–9. doi:10.1126/science.1129003. பப்மெட்:16946036.
- ↑ Ott MG, Schmidt M, Schwarzwaelder K, et al. (Apr 2006). "Correction of X-linked chronic granulomatous disease by gene therapy, augmented by insertional activation of MDS1-EVI1, PRDM16 or SETBP1". Nat Med. 12 (4): 401–9. doi:10.1038/nm1393. பப்மெட்:16582916.
- ↑ Brown BD, Venneri MA, Zingale A, Sergi Sergi L, Naldini L (May 2006). "Endogenous microRNA regulation suppresses transgene expression in hematopoietic lineages and enables stable gene transfer". Nat Med. 12 (5): 585–91. doi:10.1038/nm1398. பப்மெட்:16633348.
- ↑ பிபிசி செய்திகள் | சுகாதாரம் | பழுதான கண் பார்வைக்கு முதலாவதான மரபணு சிகிச்சை
- ↑ Maguire AM, Simonelli F, Pierce EA, et al. (May 2008). "Safety and efficacy of gene transfer for Leber's congenital amaurosis". N Engl J Med. 358 (21): 2240–8. doi:10.1056/NEJMoa0802315. பப்மெட்:18441370. http://content.nejm.org/cgi/content/full/NEJMoa0802315.
- ↑ http://www.nature.com/news/2009/090916/full/news.2009.921.html
- ↑ Korthof G. "The implications of Steele's soma-to-germline feedback for human gene therapy".
- ↑ Woods NB, Bottero V, Schmidt M, von Kalle C, Verma IM (Apr 2006). "Gene therapy: therapeutic gene causing lymphoma". Nature 440 (7088): 1123. doi:10.1038/4401123a. பப்மெட்:16641981.
Thrasher AJ, Gaspar HB, Baum C, et al. (Sep 2006). "Gene therapy: X-SCID transgene leukaemogenicity". Nature 443 (7109): E5–6; discussion E6–7. doi:10.1038/nature05219. பப்மெட்:16988659. - ↑ http://www.ornl.gov/sci/techresources/Human_Genome/medicine/genetherapy.shtml#status
- டின்கோவ், எஸ், பெக்கர்ரெடியன், ஆர்., வின்ட்டர், ஜி., கோஸ்டர், சி., நீட்டிக்கப்பட்ட அல்ட்ராசவுண்ட் இலக்கிடப்பட்ட மரபணு சிகிச்சைக்கான பாலிபிளக்ஸ்-இணைக்கப்பட்ட மைக்ரோபபிள்ஸ், 2008 ஏஏபிஎஸ் வருடாந்திர கூட்டம் மற்றும் காட்சிப்படுத்தல், 16-20 நவம்பர், ஜியார்ஜியா உலக காங்கிரஸ் மையம், அட்லாண்டா, ஜிஏ, யுஎஸ்ஏ, (http://www.aapsj.org/abstracts/AM_2008/AAPS2008-000838.PDF பரணிடப்பட்டது 2012-07-07 at the வந்தவழி இயந்திரம்)
- Gardlík R, Pálffy R, Hodosy J, Lukács J, Turna J, Celec P (Apr 2005). "Vectors and delivery systems in gene therapy". Med Sci Monit. 11 (4): RA110–21. பப்மெட்:15795707. http://www.medscimonit.com/fulltxt.php?ICID=15907.
- Staff (November 18, 2005). "Gene Therapy" (FAQ). Human Genome Project Information. Oak Ridge National Laboratory. பார்க்கப்பட்ட நாள் 2006-05-28.
- Salmons B, Günzburg WH (Apr 1993). "Targeting of retroviral vectors for gene therapy". Hum Gene Ther. 4 (2): 129–41. doi:10.1089/hum.1993.4.2-129. பப்மெட்:8494923.
- Baum C, Düllmann J, Li Z, et al. (Mar 2003). "Side effects of retroviral gene transfer into hematopoietic stem cells". Blood 101 (6): 2099–114. doi:10.1182/blood-2002-07-2314. பப்மெட்:12511419.
- Horn PA, Morris JC, Neff T, Kiem HP (Sep 2004). "Stem cell gene transfer—efficacy and safety in large animal studies". Mol. Ther. 10 (3): 417–31. doi:10.1016/j.ymthe.2004.05.017. பப்மெட்:15336643.
- Wang, Hongjie; Dmitry M. Shayakhmetov, Tobias Leege, Michael Harkey, Qiliang Li, Thalia Papayannopoulou, George Stamatoyannopolous, and André Lieber (September 2005). "A capsid-modified helper-dependent adenovirus vector containing the beta-globin locus control region displays a nonrandom integration pattern and allows stable, erythroid-specific gene expression". Journal of Virology 79 (17): 10999–1013. doi:10.1128/JVI.79.17.10999-11013.2005. பப்மெட்:16103151. https://archive.org/details/sim_journal-of-virology_2005-09_79_17/page/10999.
புற இணைப்புகள்[தொகு]
- மரபணு சிகிச்சை: ஒரு புதிய பாதுகாப்பான உத்தி
- மரபணு சிகிச்சை: மூலக்கூறு பேண்டேஜ்? பரணிடப்பட்டது 2006-04-27 at the வந்தவழி இயந்திரம் உடா பல்கலைக்கழக மரபணு அறிவியல் கற்றல் மையம்
- மரபணு மற்றும் உயிரணு சிகிச்சைக்கான அமெரிக்க சமூகம் பரணிடப்பட்டது 2009-11-29 at the வந்தவழி இயந்திரம்
- மரபணு சிகிச்சைக்கான ஐரோப்பிய சமூகம் பரணிடப்பட்டது 2009-10-26 at the வந்தவழி இயந்திரம்
- 2003 மரபணு சிகிச்சை சம்பந்தப்பட்ட செய்திகள்
- பிரிட்டன், கேம்ப்ரிட்ஜில் உள்ள ஆராய்ச்சிக் குழு வெற்றிகரமான மரபணு சிகிச்சையில் உள்ள தடைகளை மீறி வருவதற்கு பணிபரிகின்றனர் பரணிடப்பட்டது 2006-09-23 at the வந்தவழி இயந்திரம்
- பொறுப்புணர்வுள்ள மரபணு சிகிச்சைக்கான பேரவை
- லூண்ட் பல்கலைக்கழகத்தில் மூலக்கூறு மருத்துவம் மற்றும் மரபணு சிகிச்சை
- மரபணு சிகிச்சை மற்றும் மருத்துவப் பரிசோதனைகளில் டோஸிர் பரணிடப்பட்டது 2010-07-29 at the வந்தவழி இயந்திரம்
- ஜீன் தெரபி நெட், மரபணு சிகிச்சை குறித்த எல்லா தகவலுக்குமான துவக்கப்புள்ளி
- Cancer-genetherapy.com புற்றுநோய் மரபணு சிகிச்சையில் கவனம் செலுத்தும் வலைத்தளம்
- மரபணு சிகிச்சை மறுமதிப்பீடு.
- மரபணுச் சிகிச்சை தொடர்பான வெவ்வேறு தலைப்புகள்

