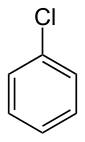
அரைல் ஆலைடு
கரிம வேதியியலில், அரைல் ஆலைடு (aryl halide) எனப்படுவது ஒரு ஐதரசன் அணுவுக்குப் பதிலாக உப்பீனி என்றழைக்கப்படும் ஆலசன் அணு பதிலீடு செய்யப்பட்ட ஓர் அரோமேட்டிக் சேர்மம் ஆகும். இவை ஆலோஅரீன் (haloarene) அல்லது ஆலசனோஅரீன் (halogenoarene) என்றும் அழைக்கப்படுகின்றன. ஆலோ அரீன்கள் ஆலோஆல்கேன்களில் இருந்து வேறுபட்டவை, ஏனெனில் இவை தயாரிப்பு முறைகள் மற்றும் பண்புகளில் வேறுபாடுகளைக் கொண்டுள்ளன. ஆலோ அரீன் தொகுதியில் பரந்துபட்ட ஏராளமான சேர்மங்கள் காணப்பட்டாலும் முக்கியமானதாக கருதப்படுபவை அரைல் குளோரைடுகள் ஆகும்.
தயாரிப்பு முறைகள்[தொகு]
அரைல் ஆலைடுகள் பொதுவாக இரண்டு முறைகளில் தயாரிக்கப்படுகின்றன[1]. அவை,
- நேரடி ஆலசன் ஏற்றமுறை
- டையசோனியம் உப்பைச் சிதைக்கும் முறை.
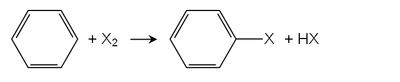
நேரடி ஆலசன் ஏற்றமுறை[தொகு]
| |||
மாறுதலாக ஏதும் சொல்லவில்லை என்றால் கொடுக்கப்பட்ட தரவுகள் யாவும் பொருள்கள் அவைகளின் இயல்பான வெப்ப அழுத்த நிலையில் (25°C, 100kPa) இருக்கும். | |||
| Infobox references | |||
பிரெய்டெல் கிராப்ட் ஆலசனேற்றத்தில் ஒரு லூயி அமிலம்[2] வினையூக்கியாகப் பயன்படுகிறது. பெரிக்கு குளோரைடு அல்லது அலுமினியம் குளோரைடு போன்ற பல உலோகக் குளோரைடுகள் பயன்படுத்தப்படுகின்றன. மிக முக்கியமான அரைல் ஆலைடான குளோரோ பென்சீன் இம்முறையில் தயாரிக்கப்படுகிறது. பென்சீனின் ஒற்றை குளோரினேற்றம் எப்போதும் டை குளோரோ பென்சீன் வகை சேர்மங்களின் உற்பத்தியைத் துணைக்கொண்டே நிகழ்கின்றன.[3]
இலத்திரனை வழங்கும் அரீன் வகைகள் லூயி அமிலங்கள் இல்லாமலும் ஆலசன்களுடன் வினைபுரிகின்றன. உதாரணமாக, ஃபினால்கள் மற்றும் அனிலின்கள் குளோரின் மற்றும் புரோமின்களுடன் விரைவாக வினைபுரிந்து பல ஆலசன்கள் ஏற்ற விளைபொருட்களைத் தருகின்றன. இலத்திரன்கள் நிறைந்த அரீன்கள் மூலம் புரோமின் நீரை நிறமிழக்கச் செய்யும் புரோமின் சோதனை பயன்படுத்தப்படுகிறது.
ஒளி முன்னிலையில் அல்லது அதிக வெப்பநிலையில் அரீன்களின் நேரடி ஆலசனேற்றம் சாத்தியமாகிறது. ஆல்கைல் பென்சீன் சார்பு வழிப்பொருட்களில், ஆல்கைல் தொகுதிகள் முதலில் ஆலசனேற்றமடைகின்றன. வளையத்தில் ஆலசனேற்றம் நிகழ் ஒளி இல்லா நிலையில் லூயி அமிலம் தேவையாகிறது[1].
- C6H6 + Cl2 → C6H5Cl + HCl
டையசோனியம் உப்பைச் சிதைக்கும் முறை[தொகு]
அரைல் ஆலைடு தயாரிக்கும் இரண்டாவது முக்கிய முறை சாண்ட்மேயர் வினையாகும். அரைல் அமைன்கள் எனப்படும் அனிலீன்கள் நைட்ரஸ் அமிலத்தின் உதவியால் டையசோனியம் உப்புகளாக மாற்றப்படுகின்றன. உதாரணமாக, தாமிர(I)குளோரைடு டையசோனியம் உப்புகளை அரைல் குளோரைடாக மாற்றுகிறது.. நைட்ரசன் வாயு வினையிலிருந்து வெளியேறி அரைல் குளோரைடு உருவாக்கத்திற்கான சாதகமான சூழலை ஏற்படுத்துகிறது. இதே போன்று சைமாண் வினை, டெட்ரா புளுரோ போரேட் அயனியை புளுரைடு வழங்கியாகப் பயன்படுத்துகிறது. காட்டர்மேன் வினையிலும் அரைல் டையசோனியம் உப்புகளைத் தக்க உலோக ஆலைடுகளின் முன்னிலையில் சிதைத்து அரைல் ஆலைடுகளைத் தயாரிக்கலாம். இவ்வினையில் தாமிர குளோரைடு அல்லது தாமிர புரோமைடிற்குப் பதிலாக தாமிரத்தூள் முறையாக ஐதரசன் குளோரைடு மற்றும் ஐதரசன் புரோமைடு முன்னிலையில் பயன்படுத்துவது கட்டாயமாகும்.
C6H5N2 + Cl- → C6H5Cl + N2
C6H5N2 + Br- → C6H5Br + N2
இயற்கையில் ஆலசனேற்றம்[தொகு]
அரைல் ஆலைடுகள் இயற்கையில் பரவலாக காணப்படுகின்றன. பொதுவாக கடல் உயிரினங்கள், கடல் நீரில் உள்ள குளோரைடு மற்றும் புரோமைடு உப்புகளைப் பயன்படுத்தி இவற்றை உற்பத்தி செய்கின்றன. குளோரினேற்றம் மற்றும் புரோமினேற்றம்செய்யப்பட்ட நறுமண சேர்மங்கள் பல இயற்கையில் உள்ளன. டைரோசின், டிரிப்தோபன், மற்றும் பல்வேறு பிரோல் வழிவகை சேர்மங்கள் இவற்றிற்கு எடுத்துக்காட்டுகளாகும். இவற்றில் சில இயற்கை அரைல் ஆலைடுகள் சில பயனுள்ள மருத்துவ குணங்களை வெளிப்படுத்துகின்றன[4][5]


கட்டமைப்பு போக்குகள்[தொகு]
அரைல் ஆலைடுகளில் உள்ள CX பிணைப்பு தூரங்கள் எதிர்பார்க்கும் போக்குகளையே பின்பற்றுகின்றன. புளோரோ பென்சீன், குளோரோ பென்சீன், புரோமோ பென்சீன் மற்றும் மெத்தில் 4 அயோடோ பென்சீன் ஆகியவை முறையே 135.6 (4), 173.90 (23), 189.8 (1), மற்றும் 209,9 தூரங்களில்[6] உள்ளன.
வேதி வினைகள்[தொகு]
ஓர் அரைல் ஆலைடின் மூலக்கூறு இரண்டு பகுதிகளைக் கொண்டது:
- ஓர் அரோமேட்டிக் வளையம்
- வளையத்துடன் நேரடியாக இணைக்கப்பட்ட ஆலசன் அணு
இக்காரணத்தால் அரைல் ஆலைடுகளுடன் வினைபுரியும் தன்மை வளையத்தைப் பொருத்தும் ஆலசன் அணுக்களைப் பொருத்தும் அமைகின்றன.
ஆலசன் அணு தொடர்பான வினைகள்[தொகு]
இவ்வினைகள் கருகவர் அரோமேட்டிக் பதிலீட்டு வினைகள் என்றும் அழைக்கப்படுகின்றன. ஆல்கைல் ஆலைடுகளைப் போல அரோமேட்டிக் ஆலைடுகள் கருக்கவர் பதிலீட்டு வினைக்கு எளிதாக உட்படுவதில்லை. இத்தகைய குறைந்த வினைத்திறனுக்கான காரணம் என்னவென்றால் ஆல்கைல் ஆலைடுகளுடன் ஒப்பிடும்போது அரைல் ஆலைடுகளிலுள்ள C - X பிணைப்பு குட்டையானது மற்றும் வலுவானது.மேலும் அரோமேட்டிக் வளையமானது உயர்ந்த எலக்ட்ரான் அடர்த்தியின் மையமாக π எலக்ட்ரான் விரவிய பண்பினால் அமைகிறது. எனினும் கடுமையான நிபந்தனைகளின் போது அரைல் ஆலைடுகளிலுள்ள ஆலசன் கருக்கவர் பதிலீட்டு வினைக்கு உட்படுகிறது.
C6H5Cl + NaOH → C6H5OH + NaCl
C6H5Cl + 2NH3 → C6H5NH2 + NH4Cl
C6H5Cl + CUCN → C6H5CN + CUCl
உர்ட்ஸ் பிட்டிக் வினை[தொகு]
அரைல் ஆலைடுகளை ஈதரிலுள்ள சோடியத்துடனும் ஆல்கைல் அலைடுகளுடனும் சேர்த்து வெப்பப்படுத்தும்போது ஆல்கைல் பென்சீன் உண்டாகிறது [7].
C6H5Br + 2Na + C6H5Br → C6H5 - C2H5 + 2NaBr
ஆல்கைல் ஆலைடுகள் இல்லாத நிலையில் அரைல் ஆலைடுகள் ஈதர் கரைசலில் சோடியத்துடன் செயல்பட்டு இரு பென்சீன் வளையங்கள் பிணைக்கப்பட்ட இரட்டை அரைல் (biaryl) சேர்மங்களைத் தருகின்றன.இவ்வினை பிட்டிக் வினை என்றழைக்கப்படுகிறது.
C6H5Br + 2Na + C6H5Br → C6H5 - C6H5 + 2NaBr
ஒடுக்க வினை[தொகு]
சோடியம் ஐதராக்சைடிலுள்ள நிக்கல்-அலுமினியம் கலவையால் ஒடுக்கப்படும் போது அரைல் ஆலைடுகள் அதனுடன் தொடர்புடைய அரீன்களைத் தருகின்றன.
C6H5Cl + 2[H] → C6H6 + HCl
கிரின்யார் வினைப்பொருள் உருவாதல்[தொகு]
உலர் ஈதரில் மக்னீசியம் தூளுடன் சேர்த்து கொதிக்க வைக்கும் போது அரைல் புரோமைடுகளும் அரைல் அயோடைடுகளும் கிரின்யார் கரணிகளைத்[8][9][10] தருகின்றன. ஈதருக்குப் பதிலாக டெட்ரா ஐதரோ ஃபியூரானைப் பயன்படுத்தினாலும் இவ்வினை நிகழ்கிறது.
- C6H5Cl + Mg → C6H5MgCl
அரோமேட்டிக் வளையம் உட்படும் வினைகள்[தொகு]
இவ்வினைகள் எலக்ட்ரான் கவர் அரோமேட்டிக் பதிலீட்டு வினைகள் என்றழைக்கப்படுகின்றன. அரைல் ஆலைடுகள், ஆலசன் ஏற்றம், நைட்ரோ ஏற்றம், சல்போனிக் ஏற்றம், ஆல்கைல் ஏற்றம் போன்ற எலக்ட்ரான் கவர் அரோமேட்டிக் பதிலீட்டு வினைகளுக்கு உட்படுகின்றன. அரைல் ஆலைடில் உள்ள ஆலசன் எலக்ட்ரான் கவர் காரணிகளை ஆர்த்தோ அல்லது பாரா இடங்களுக்கு வழிப்படுத்துகின்றன.
குளோரின் ஏற்றம்[தொகு]
நைட்ரோ ஏற்றம்[தொகு]
சல்போனிக் ஏற்றம்[தொகு]
ஆல்கைல் ஏற்றம்[தொகு]
டி.டி.டீ உருவாதல்[தொகு]
அடர் கந்தக அமிலத்தின் முன்னிலையில் குளோரோ பென்சீன் டிரை குளோரோ அசிட்டால்டிகைடுடன் குளோரால் வினைபுரிந்து டைகுளோரோ டைஃபினைல் டிரைகுளோரோ ஈத்தேன்[11] என்ற பூச்சிக்கொல்லியைக் கொடுக்கிறது.
- Cl3CCHO + 2 C6H5Cl → Cl3CCH(C6H4Cl)2 + H2O
உயிரினச் சிதைவு[தொகு]
ரோடோகோக்கஸ் பினோலிகஸ் என்ற பாக்டீரிய இனம் டைகுளோரோ பென்சீனை ஆதார கரிமமாக சிதைவுறச் செய்கிறது[12]
பயன்கள்[தொகு]
குளோரோ பென்சீன், ஃபீனால் மற்றும் நைட்ரோ குளோரோ பென்சீன் ஆகியவற்றைத் தயாரிக்கப் பயன்படுகிறது.ஃபீனால் மற்றும் நைட்ரோ பென்சீன்கள் அசோ மற்றும் சல்ஃபர் சாயங்கள் தயாரிக்கப் பயன்படுகின்றன. டி.டி.டீ(DDT), பி.எச்.சி (BHC)போன்ற பூச்சிக் கொல்லிகள் தயாரிக்கவும் பயன்படுகின்றன.
மேற்கோள்கள்[தொகு]
- ↑ 1.0 1.1 Boyd, Robert W.; Morrison, Robert (1992). Organic chemistry. Englewood Cliffs, N.J: Prentice Hall. p. 947. பன்னாட்டுத் தரப்புத்தக எண் 0-13-643669-2.
{{cite book}}: CS1 maint: multiple names: authors list (link) - ↑ Lewis, G.N., Valence and the Structure of Atoms and Molecules (1923) p. 142.
- ↑ Beck, U.; Löser, E. (2011). "Chlorinated Benzenes and Other Nucleus-Chlorinated Aromatic Hydrocarbons". Ullmann's Encyclopedia of Industrial Chemistry. doi:10.1002/14356007.o06_o03. பன்னாட்டுத் தரப்புத்தக எண்:3527306730.
- ↑ Fujimori, Danica Galonić; Walsh, Christopher T. (2007). "What's new in enzymatic halogenations". Current Opinion in Chemical Biology 11 (5): 553–60. doi:10.1016/j.cbpa.2007.08.002. பப்மெட்:17881282.
- ↑ Gribble, Gordon W. (2004). "Natural Organohalogens: A New Frontier for Medicinal Agents?". Journal of Chemical Education 81 (10): 1441. doi:10.1021/ed081p1441. Bibcode: 2004JChEd..81.1441G. https://archive.org/details/sim_journal-of-chemical-education_2004-10_81_10/page/1441.
- ↑ Oberhammer, Heinz (2009). "The Structural Chemistry of Carbon-Halogen Bonds". PATai's Chemistry of Functional Groups. doi:10.1002/9780470682531.pat0002. பன்னாட்டுத் தரப்புத்தக எண்:978-0-470-68253-1.
- ↑ Desai, K.R. (2008). Organic Name Reactions. Jaipur I India: Oxford Book Company. p. 259. பன்னாட்டுத் தரப்புத்தக எண் 9788189473327.
- ↑ Garst, J. F.; Ungvary, F. "Mechanism of Grignard reagent formation". In Grignard Reagents; Richey, R. S., Ed.; John Wiley & Sons: New York, 2000; pp 185–275. பன்னாட்டுத் தரப்புத்தக எண் 0-471-99908-3.
- ↑ Advanced Organic chemistry Part B: Reactions and Synthesis F.A. Carey, R.J. Sundberg 2nd Ed. 1983
- ↑ எஆசு:10.1021/ja00521a034
This citation will be automatically completed in the next few minutes. You can jump the queue or expand by hand - ↑ Othmar Zeidler (1874). "Verbindungen von Chloral mit Brom- und Chlorbenzol". Berichte der deutschen chemischen Gesellschaft 7 (2): 1180–1181. doi:10.1002/cber.18740070278.
- ↑ Rehfuss, Marc; Urban, James (2005). "Rhodococcus phenolicus sp. nov., a novel bioprocessor isolated actinomycete with the ability to degrade chlorobenzene, dichlorobenzene and phenol as sole carbon sources". Systematic and Applied Microbiology 28 (8): 695–701. doi:10.1016/j.syapm.2005.05.011. பப்மெட்:16261859.