கியூரியம்(IV) ஆக்சைடு
| |
| பெயர்கள் | |
|---|---|
| வேறு பெயர்கள்
கியூரியம் ஈராக்சைடு
| |
| இனங்காட்டிகள் | |
| 12016-67-0 | |
| ChemSpider | 34998496 |
| EC number | 234-612-6 |
InChI
| |
| யேமல் -3D படிமங்கள் | Image |
| பப்கெம் | 118856359 (charge error) |
SMILES
| |
| பண்புகள் | |
| CmO2 | |
| வாய்ப்பாட்டு எடை | 279.00 g·mol−1 |
| தோற்றம் | கருப்பு படிகங்கள் |
| கரையாது | |
| தொடர்புடைய சேர்மங்கள் | |
| ஏனைய நேர் மின்அயனிகள் | அமெரிசியம் டையாக்சைடு பெர்க்கிலியம்(IV) ஆக்சைடு |
மாறுதலாக ஏதும் சொல்லவில்லை என்றால் கொடுக்கப்பட்ட தரவுகள் யாவும் பொருள்கள் அவைகளின் இயல்பான வெப்ப அழுத்த நிலையில் (25°C, 100kPa) இருக்கும். | |
| Infobox references | |
கியூரியம்(IV) ஆக்சைடு (Curium(IV) oxide) CmO2 என்ற மூலக்கூற்று வாய்ப்பாட்டால் குறிக்கப்படும் கனிம வேதியியல் சேர்மமாகும். கியூரியம் மற்றும் ஆக்சிசன் தனிமங்கள் சேர்ந்து இச்சேர்மம் உருவாகிறது. கியூரியத்தின் அனைத்து ஓரிடத்தான்களும் மனிதனால் உருவாக்கப்பட்டவை என்பதால் இயற்கையில் கியூரியம்(IV) ஆக்சைடு தோன்றுவதில்லை.
தயாரிப்பு[தொகு]
- நேரடியாக பகுதிக்கூறுகள் இணைந்து வினைபுரிவதால் கியூரியம்(IV) ஆக்சைடு உருவாகிறது. இதற்காக உலோக கியூரியம் ஆக்சிசன் சூழலில் காய்ச்சிப் பதனிட்டு வினைக்கு உட்படுத்தப்படுகிறது. :[1]
- Cm + O2 → CmO2
- கியூரியம்(III) ஐதராக்சைடு மற்றும் கியூரியம்(III) ஆக்சலேட்டு ஆகியவையும் கியூரியம்(IV) ஆக்சைடு தயாரிப்புக்குப் பயன்படுத்தப்படுகின்றன:
- Cm(OH)4 → CmO2 + 2H2O
- Cm(C2O4)2 → CmO2 + 2CO2 + 2CO
- கியூரியம்(III) ஆக்சைடை ஆக்சிசன் சூழலில் 650 பாகை செல்சியசு வெப்பநிலைக்கு சூடுபடுத்தி தயாரிப்பது மற்றொரு முறையாகும்:[2]
- 2Cm2O3 + O2 → 4CmO2
இயற்பியல் பண்புகள்[தொகு]
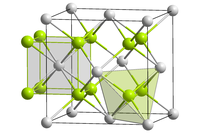
கியூரியம்(IV) ஆக்சைடு கருப்பு நிறப் படிகங்களாக உருவாகிறது.[3] இது நீரில் கரையாது. சேர்மத்தின் படிகங்கள் கனசதுரப் படிக அமைப்பில் Fm3m இடக்குழுவில் புளோரைட்டு அமைப்பில் உள்ளன.
வேதியியல் பண்புகள்[தொகு]
கனிம அமிலங்களுடன் கியூரியம்(IV) ஆக்சைடு வினைபுரிந்து கியூரியம்(III) உப்புகளை உருவாக்குகிறது.[4]
பயன்கள்[தொகு]
இச்சேர்மம் ஐசோடோபிக் மின்னோட்ட மூலங்களின் உற்பத்திக்காகவும், தாண்டல்கியூரியம் தனிமங்களின் தயாரிப்பிற்கான இலக்காகவும் பயன்படுத்தப்படுகிறது.
மேற்கோள்கள்[தொகு]
- ↑ Asprey, L. B.; Ellinger, F. H.; Fried, S.; Zachariasen, W. H. (March 1955). "EVIDENCE FOR QUADRIVALENT CURIUM: X-RAY DATA ON CURIUM OXIDES 1" (in en). Journal of the American Chemical Society 77 (6): 1707–1708. doi:10.1021/ja01611a108. பன்னாட்டுத் தர தொடர் எண்:0002-7863. https://pubs.acs.org/doi/abs/10.1021/ja01611a108. பார்த்த நாள்: 29 June 2023.
- ↑ Noé, M.; Fuger, J. (1 May 1971). "Self-radiation effects on the lattice parameter of 244CmO2" (in en). Inorganic and Nuclear Chemistry Letters 7 (5): 421–430. doi:10.1016/0020-1650(71)80177-0. பன்னாட்டுத் தர தொடர் எண்:0020-1650. https://www.sciencedirect.com/science/article/abs/pii/0020165071801770?via%3Dihub. பார்த்த நாள்: 29 June 2023.
- ↑ Konings, R. J. M. (1 October 2001). "Thermochemical and thermophysical properties of curium and its oxides" (in en). Journal of Nuclear Materials 298 (3): 255–268. doi:10.1016/S0022-3115(01)00652-3. பன்னாட்டுத் தர தொடர் எண்:0022-3115. https://www.sciencedirect.com/science/article/abs/pii/S0022311501006523?via%3Dihub. பார்த்த நாள்: 29 June 2023.
- ↑ Lumetta, Gregg J.; Thompson, Major C.; Penneman, Robert A.; Eller, P. Gary (2006). "Curium" (in en). The Chemistry of the Actinide and Transactinide Elements (Springer Netherlands): 1397–1443. doi:10.1007/1-4020-3598-5_9. https://link.springer.com/chapter/10.1007/1-4020-3598-5_9. பார்த்த நாள்: 29 June 2023.
