வேதி வினைவேகவியல்
வேதி வினைவேகவியல்,(Chemical kinetics) என அழைக்கப்படும் வினை இயக்கவியலானது வேதிச்செயல்முறைகளின் வேகத்தைப் பற்றிய ஒரு இயலாகும். இந்த இயல் வேதி வினைகளின் வேகத்தைப் பாதிக்கக்கூடிய புறக் காரணிகள் பற்றிய ஆய்வுகளை உள்ளடக்கியுள்ளது. மேலும், வினை வழிமுறை, வினை இடைப்பொருள், மற்றும் ஒரு வேதிவினையின் பண்புகளைத் தீா்மானிக்கிற கணிதவியல் சமன்பாடுகள் ஆகியன பற்றிய தகவல்களையும் தருகிறது.
வரலாறு
[தொகு]பீட்டா் வாகே மற்றும் கேடோ கல்ட்பெர்க் ஆகியோா் வேதி வினைவேகவியலின் வளா்ச்சிக்கான முன்னோடியாக 1864 ஆம் ஆண்டு நிறைத்தாக்க விதியினை உருவாக்கினா். இந்த விதியானது, ஒரு வேதிவினையின் வேகமானது வினைபடுபொருள்களின் அளவோடு விகிதத் தொடா்பில் இருக்கும் என்கிறது.[1][2][3]
வாண்ட்ஹாஃப் வேதிவினைகளின் இயக்கவியல் பற்றிய தனது புகழ் பெற்ற ஆய்வு முடிவுகளை 1884 ஆம் ஆண்டு வெளியிட்டார்.[4] வேதிவினைகளின் இயக்கவியல் பற்றிய விதிகள், கரைசல்களில் சவ்வூடு பரவல் அழுத்தம் ஆகியவை தொடா்பாக இவரின் வியத்தகு சேவைகளைப் பாராட்டி 1901 ஆம் ஆண்டில் இவருக்கு நோபல் பரிசு வழங்கப்பட்டது.[5] வேதியியல் துறையில் வழங்கப்பட்ட முதல் நோபல் பரிசு இது என்பது குறிப்பிடத்தக்கது. வாண்ட்ஹாஃப்பிற்குப் பிறகு, வேதி வினைவேகவியலானது, சோதனைகளின் அடிப்படையில் வினைகளின் வேகத்தைக் கண்டறிதல், அதிலிருந்து வேக விதிகள் மற்றும் வேக மாறிலிகள் ஆகியவற்றைக் கண்டறிதல் எனத் தொடர்ந்தது.
ஒப்பீட்டளவில் எளிய சுழி வகை வினைகள், முதல் வகை வினைகள், இரண்டாம் வகை வினைகள் ஆகியவற்றுக்கான வேக விதிகள் உருவாக்கப்பட்டுள்ளன. மற்ற வகை வினைகளுக்கும் இவற்றின் அடிப்படையில் வேக விதிகளை உருவாக்கலாம். எளிய வகை வினைகள் நிறைத்தாக்க விதியினை அடிப்படையாகக் கொண்டுள்ளன. ஆனால் படிநிலைகளின் படி நிகழும் வினைகளுக்குப் பல வேக விதிகளை இணைத்து சமன்பாடுகள் உருவாக்கப்பட வேண்டியுள்ளன. இன்னும் சில தொடர் வினைகளில் வேகத்தை நிா்ணயிக்கும் வினையின் படிநிலை தான் வினை வேகவியலைத் தீா்மானிக்கிறது. ஒரு வினையின் செயற்படு பொருண்மையானது, அரீனியசு மற்றும் ஐரிங்கு ஆகியோரின் சமன்பாடுகளால் சோதனை முறைப்படி கண்டுபிடிக்கப்பட வேண்டியுள்ளது. ஒரு வேதி வினையின் வேகத்தைத் தீா்மானிக்கக்கூடிய காரணிகளாக வினைபடுபொருள்களின் இயற்பியல் நிலை, செறிவு, வினையின் வெப்பநிலை, வினைவேக மாற்றிகள் ஆகியவை உள்ளன.
கோர்பன் மற்றும் இயாப்லான்சுகீ ஆகியோர் வேதி வினைவேகவியலின் வரலாற்றை மூன்று காலங்களாகப் பிாிக்கலாம் என்கின்றனா்.[6] முதலாவது காலமானது, வினைவேகவியலுக்கும் வெப்ப இயக்கவியலுக்கும் இடையேயான தொடர்புகளை வருவிப்பதன் மூலம் வேதிவினைகளின் வேகம் தொடர்பான பொதுவான சமன்பாடுகளைத் தேடிய வாண்ட்ஹாஃப் காலம். இரண்டாவது, செமனோவ்--இன்செல்வுடு காலத்தில் சங்கிலித் தொடர் வினைகளுக்கான வினை வழிமுறைகள் மீதான தீவிரமான பார்வையாக அமைந்தது. பிறகு, மூன்றாவதாக, வேதிவினைகளின் வலைப்பின்னலை விாிவான கணிதவியல் சமன்பாடுகளாக மாற்ற முயன்ற உரூதா்ஃபோர்டு ஏரிசு காலம் மூன்றாவது பிாிவாகவும் கொள்ளப்படலாம்.
வினைவேகத்தைப் பாதிக்கும் காரணிகள்
[தொகு]வினைபடுபொருள்களின் தன்மை
[தொகு]வினையில் ஈடுபடும் பொருள்களின் தன்மையைப் பொறுத்து வேதிவினையின் வேகமானது மாறுபடுகிறது. உப்புகளை உருவாக்கும் அமில/கார வினைகள் அயனிப் பாிமாற்றம் நடைபெறும் வினைகளாக இருப்பதால் வேகமான வினைகளாக உள்ளன. மூலக்கூறுகளுக்கு இடையில் சகப்பிணைப்பு உருவாகி மூலக்கூறுகள் உருவாகும் வினைகளில் வினையின் வேகம் மெதுவாக உள்ளது. ஹாலஜனேற்ற வினைகளில் அயோடினால் நிகழும் வினையின் வேகமானது குளோரினால் நிகழும் வினையை விட மெதுவாக நிகழ்கிறது. வினைபடுபொருள்களின் தன்மை மற்றும் பிணைப்புகளின் வலிமை ஆகியவை அவை வினைவிளைபொருள்களாக மாற்றமடைவதன் வேகத்தை வெகுவாகப் பாதிக்கின்றன.
இயற்பியல் நிலை
[தொகு]வினையின் வேகத்தைப் பாதிக்கும் காரணிகளில் வினைபடு பொருளின் இயற்பியல் நிலையும் கூட (திண்மம், நீர்மம், வளிமம்) முக்கியமான ஒன்றாக இருக்கிறது. வினைபடு பொருள்கள் அனைத்தும் ஒரே இயற்பியல் நிலைமையில் இருக்கும் போது, உதாரணமாக, நீர்க்கரைசல்களில் நிகழ்வது போல, வெப்பவியல் இயக்கமானது மூலக்கூறுகளை ஒன்றோடு ஒன்று மோதச் செய்கிறது. வினைபடு பொருள்கள் வெவ்வேறான இயற்பியல் நிலைமைகளில் இருக்கும் போது அவற்றில் வினைபுாியும் பரப்பின் அளவானது குறைவுபடுகிறது. வினையில் ஈடுபடும் பரப்பளவு அதிகரிக்க அதிகரிக்க வினையின் வேகம் அதிகரிக்கும். திரவங்கள் மற்றும் வாயுக்களைப் பொறுத்த அளவில் கலக்குதல்(stirring) மற்றும் அதிவேகமான குலுக்குதல்(Vigorous shaking) வினை முழுமையடைய உதவக்கூடும். மிக நுண்ணிய துகள்களாகத் துாளாக்கப்பட்ட திண்மம் அல்லது திரவ வினைபடு பொருள்கள் மிக அதிக அளவிலான வினைபடு பரப்பைக் கொண்டுள்ளன. இதன் காரணமாக உடன் வினைபுரியும் வினைபடு பொருள்களுடன் வினைபுரியும் தன்மை அதிகரித்து வினையின் வேகம் அதிகரிக்கிறது.[7]
வினைபடுபொருள்களின் பரப்பு
[தொகு]திண்ம வினைபடுபொருள்களிலும், பலபடித்தான வினைகளிலும், வினைபடுபொருள்களின் பரப்பு முக்கிய பங்கை வகிக்கிறது. ஒரு திண்ம வினைபடுபொருளை மிகச்சிறிய துகள்களாகத் துாளாக்கும் போது வினைபடும் பரப்பானது அதிகமாகிறது. இதன் காரணமாக, வினைபடுபொருள்களின் துகள்களுக்கிடையேயான மோதல்களின் நிகழ்வெண் அதிகரித்து வினையின் வேகம் அதிகரிக்கிறது. இதன் காரணமாக வெடிபொருள் தயாரிப்பாளா்கள் திண்ம வினைபடுபொருள்களின் புறப்பரப்பைக் கட்டுக்குள் வைத்து வெடிபொருளில் உள்ள எரிபொருள்கள் ஆக்சிஜனேற்றம் அடையும் வேகத்தை நிா்வகிக்கின்றனா். சில நேரங்களில் இந்தக் காரணியை அடிப்படையாக வைத்து, திண்ம வெடிபொருள்களின் பயன்பாட்டைக் கூட வெவ்வேறாக மாற்றி அமைக்கின்றனா். உதாரணமாக, மிக நுண்ணிய துகள்களாகத் துாளாக்கப்பட்டு அடைக்கப்பட்ட குண்டுகள் பயங்கர சத்தத்துடன் வெடிக்கின்றன. இதே, அலுமினியத்தைப் பெரிய துண்டுகளாகச் சிதைத்துப் பயன்படுத்தும்போது, மத்தாப்புகளை உருவாக்க இயலுகிறது.
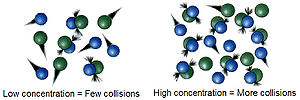
செறிவு
[தொகு]ஒரு வேதிவினையானது வினைபடுபொருள்களுக்கிடையே நடைபெறும் மோதல்களின் விளைவாகவே நடைபெறுகிறது. வினைபடுபொருள்களின் மூலக்கூறுகள் அல்லது அயனிகள் இவற்றுக்கிடையே நிகழும் மோதல்களின் எண்ணிக்கை வினைபடுபொருள்களின் செறிவைப் பொறுத்தே அமைகிறது. வினைபடுபொருள்களின் செறிவு அதிகரிக்க அதிகரிக்க, மூலக்கூறுகளுக்கிடையே நடைபெறும் மோதல்களின் எண்ணிக்கை அதிகரித்து அதன் விளைவாக வினையின் வேகமானது அதிகரிக்கும். இதே போன்று வினைபடுபொருள்களின் செறிவு குறையும்போது இதற்கு எதிரான விளைவு உருவாகும். அதாவது, வினையின் வேகமானது குறையும். உதாரணமாக, எரிதல் வினையானது காற்றில் (ஆக்சிஜன் 21%) நடைபெறுவதை விடத் துாய்மையான ஆக்சிஜனில் இன்னும் அதிவேகமாக நிகழும். வினைவேகத்திற்கான சமன்பாடுகள் வினைபடுபொருள்களின் செறிவிற்கும் வினையின் வேகத்திற்கும் இடையே உள்ள தொடர்பைத் தெளிவாக காட்டுகிறது. வினையின் வழிமுறைகளைப் பொறுத்து வினைவேகத்திற்கான சமன்பாடுகள் வெவ்வேறு வடிவத்தில் இருக்கலாம்.
வெப்பநிலை
[தொகு]பொதுவாக, ஒரு வேதிவினையின் வேகத்தில் வெப்பநிலையானது ஒரு மிக முக்கிய பாதிப்பைக் கொண்டுள்ளது. உயா் வெப்பநிலைகளில் மூலக்கூறுகளானவை மிக அதிக வெப்ப ஆற்றலைக் கொண்டுள்ளன. உயர் வெப்பநிலைகளில் மூலக்கூறுகளின் மோதல்களின் எண்ணிக்கை அதிகமாக இருப்பினும், வினையின் வேகம் அதிகரிப்பதற்கு இது முழுமையான காரணமன்று. உயர் வெப்பநிலையில் வினைபடுபொருள்களின் மூலக்கூறுகளில் கிளா்வுறு ஆற்றலைக் காட்டிலும் அதிக ஆற்றலைப் பெற்றுள்ள மூலக்கூறுகளின் எண்ணிக்கையானது குறிப்பிடத்தக்க அளவுக்கு அதிகமாக இருக்கும் என மூலக்கூறுகளின் ஆற்றல் தொடர்பான மேக்சுவெல்-போல்ட்சுமன் பரவல் கோட்பாடு விவரிக்கிறது.
வினைவேகமாற்றி
[தொகு]
ஒரு வேதிவினையில் ஈடுபடும் பொருள் ஒன்று வேதியியல் ரீதியாக எவ்வித மாற்றத்தையும் அடையாது வினையின் வேகத்தில் மாற்றத்தை ஏற்படுத்தும் பொருளே வினைவேகமாற்றி எனப்படும். வினைவேகமாற்றியானது மாறுபட்ட குறைவான கிளா்வுறு ஆற்றலைக் கொண்ட வினைவழிமுறையைப் பயன்படுத்தி வேதிவினையை வேகமாக நிகழச் செய்கிறது.
அழுத்தம்
[தொகு]வாயுக்களுக்கிடையே நடக்கும் ஒரு வினையில் அழுத்தத்தை அதிகரிப்பதன் மூலம் வினைபடுபொருள்களின் மூலக்கூறுகளுக்கிடையேயான மோதல்கள் அதிகரிக்கின்றன. அதன் விளைவாக, வினையின் வேகமும் அதிகரிக்கும். ஒரு வாயுவின் செயற்படுபொருண்மை என்பது அந்த வாயுவின் பகுதி அழுத்தத்திற்கு நோ்விகிதத்தில் இருக்கும். ஒரு கரைசலில் செறிவு அதிகமாகும் போது ஏற்படும் விளைவினைப் போன்ற ஒரு விளைவையே வாயுக்களின் வினையில் அழுத்தத்தினால் ஏற்படுகிறது. நிறைத்தாக்க விதியினால் ஏற்படுகின்ற நேரடி விளைவினைத் தவிர, அழுத்தத்தின் காரணமாக வேக மாறிலிகளும் மாறக்கூடும்.
வினைவேகத்தைக் கண்டறியப் பயன்படும் சோதனை முறைகள்
[தொகு]ஒரு வினையின் வேகத்தைச் சோதனை முறையில் காண, வினைபடுபொருள்கள் மற்றும் வினைவிளைபொருள்களின் செறிவை வினை தொடங்கியதிலிருந்து குறிப்பிட்ட கால இடைவெளியில் அளவீடு செய்வதன் மூலம் செய்யலாம். வினையில் ஈடுபடக்கூடிய ஏதேனும் ஒரு வினைப்பொருள் மட்டும் குறிப்பிட்ட அலைநீளமுடைய ஒளியை உறி்ஞ்சக்கூடிய தன்மை பெற்றிருந்தால் நிறமாலை ஒளி அளவியல் (spectrophotometry) மூலமாக குறிப்பிட்ட அந்த வினைப்பொருளின் செறிவைக் கணக்கிட முடியும்.
வேதிச்சமநிலை
[தொகு]வேதி வினைவேகவியலானது வேதிவினைகளின் வேகத்தைப் பற்றி அறிய முற்படும் போது வெப்ப இயக்கவியலோ, ஒரு வேதி வினை நிகழத் தேவையான சாதக, பாதகங்களைப் பற்றி அறிய முற்படுகிறது. ஒரு மீள் வினையில், முன்னோக்கு வினை மற்றும் பின்னோக்கு வினையின் வேகங்கள் சமநிலையை அடையும் போது வேதிச்சமநிலையானது எட்டப்படுகிறது. வேதிச்சமநிலை அடைந்த பிறகு வினைவிளைபொருள்கள் மற்றும் வினைபடுபொருள்களின் செறிவுகளில் எந்த வித மாற்றமும் ஏற்படுவதில்லை. இதற்கு உதாரணமாக, ஹேபா் முறையில் நைட்ரஜன் மற்றும் ஹைட்ரஜன் இணைந்து அம்மோனியா தயாரிக்கும் முறையினைக் கூறலாம்.
கிப்சின் கட்டிலா ஆற்றல் (G)
[தொகு]பொதுவாக, வெப்ப இயக்கவியலின்படி கட்டிலா ஆற்றல் மற்றும் கட்டிலா ஆற்றல் மாற்றம் என்பது ஒரு வேதி வினையானது நிகழுமா என்பதைப் பற்றிய முடிவைத் தருவது ஆகும். ஆனால், வேதி வினைவேகவியலோ, ஒரு வேதிவினை எவ்வளவு வேகத்தில் நிகழும் என்பதைக் காண முற்படுவது ஆகும்.
ஒரு வினையானது தன்னிச்சையாக நிகழுமா என்பதை முடிவு செய்ய அமைப்பை மட்டுமே சார்ந்திருக்கக் கூடிய ஒரு வெப்ப இயக்கவியல் சார்பு தேவைப்பட்டது. வெப்ப இயக்கவியலின் இரண்டாம் விதி இந்தச் சார்பை அறிமுகப்படுத்தியது. இந்தச் சார்பானது அமைப்பின் வெப்ப அடக்கம், வெப்பநிலை மற்றும் என்ட்ரோபி ஆகியவற்றைச் சார்ந்தது. ஒரு செயல்முறையின் கட்டிலா ஆற்றல் மாற்றத்திலிருந்து (∆G) ஒரு வினை நிகழுமா என்பதற்கும், வெப்ப இயக்கவியல் தன்னிச்சை செயல்முறைக்குமான காரணங்கள் பின்வருமாறு:[8] அமைப்பின் மாறா வெப்பநிலை மற்றும் அழுத்தத்தில், ∆G > 0, ∆G = நேர்மறை மதிப்பு, செயல்முறையானது தன்னிச்சை செயல்முறை அல்ல மற்றும் நிகழாது. ∆G = 0 சமநிலை வினை ∆G<0, ∆G= எதிர்மறை மதிப்பு, செயல்முறையானது தன்னிச்சையானது மற்றும் நிகழக்கூடியது.
பயன்பாடுகள்
[தொகு]வேதியியல் மற்றும் வேதிப்பொறியியல் வல்லுநா்களுக்கு உணவு சிதைவடைதல், நுண்ணுயிரிகளின் வளர்ச்சி, வளிமண்டலத்தின் ஸ்ட்ரேடோஸ்பியர் அடுக்கில் நடக்கும் ஓசோன் சிதைவு மற்றும் உயிாிய நிகழ்வுகளில் நடக்கும் சிக்கலான வேதிவினைகள் ஆகியவற்றைப் பற்றிப் புரிந்து கொள்வதற்கும், விவரிப்பதற்கும் வேதி வினைவேகவியலின் வினைவேகம் தொடர்பான கணிதச் சமன்பாடுகள் சிறந்த கருவியாகப் பயன்படுகின்றன.
விளைபொருள்களை அதிகமாகப் பெற, வினைவிளைப்பொருள்களை எளிதில் பிரித்திட, மற்றும் சுற்றுச்சூழலுக்குத் தீங்கு விளைவிக்கும் விளைபொருள்களை நீக்கிட, வினை நடைபெறும் கலனை எவ்வாறு வடிவமைக்கலாம் என்பதற்கான உத்திகளைத் தீர்மானித்திட இந்த இயல் உதவுகிறது.
பெட்ரோலிய எரிபொருள்களைப் பெற உயா் ஹைட்ரோகார்பன்களை வினையூக்கி முன்னிலையில் சிதைக்கச்செய்யும் வினைகளில் அதிகமான விளைபொருள்களைப் பெற எந்த வெப்பநிலை மற்றும் அழுத்தத்தைப் பயன்படுத்தலாம் என்பதைக் கண்டறிய வேதி வினைவேகவியல் சமன்பாடுகள் பெரிதும் பயன்படுகின்றன.
மேலும் காண்க
[தொகு]மேற்கோள்கள்
[தொகு]- ↑ C.M. Guldberg and P. Waage,"Studies Concerning Affinity" Forhandlinger i Videnskabs-Selskabet i Christiania (1864), 35
- ↑ P. Waage, "Experiments for Determining the Affinity Law" ,Forhandlinger i Videnskabs-Selskabet i Christiania, (1864) 92.
- ↑ C.M. Guldberg, "Concerning the Laws of Chemical Affinity", Forhandlinger i Videnskabs-Selskabet i Christiania (1864) 111
- ↑ Hoff, J. H. van't (Jacobus Henricus van't); Cohen, Ernst; Ewan, Thomas (1896-01-01). Studies in chemical dynamics. Amsterdam : F. Muller ; London : Williams & Norgate.
- ↑ The Nobel Prize in Chemistry 1901, Nobel Prizes and Laureates, official website.
- ↑ A.N. Gorban, G.S. Yablonsky Three Waves of Chemical Dynamics, Mathematical Modelling of Natural Phenomena 10(5) (2015), p. 1–5.
- ↑ வேதியியல் மேல்நிலை முதலாம் ஆண்டு. தமிழ்நாடு அரசு பாடநுால் கழகம், சென்னை. 2007. p. 110.
- ↑ வேதியியல் மேல்நிலை இரண்டாம் ஆண்டு தொகுதி 1. தமிழ்நாடு பாடநுால் கழகம், சென்னை. 2007. pp. 244, 245.
