வெள்ளீயம்(IV) புளோரைடு
| |
| பெயர்கள் | |
|---|---|
| ஐயூபிஏசி பெயர்
வெள்ளீயம்(IV) புளோரைடு
| |
| வேறு பெயர்கள்
இசுடானிக் புளோரைடு, டின் டெட்ராபுளோரைடு
| |
| இனங்காட்டிகள் | |
| 7783-62-2 | |
| EC number | 232-016-0 |
InChI
| |
| யேமல் -3D படிமங்கள் | Image |
| பப்கெம் | 134654 |
| |
| பண்புகள் | |
| SnF4 | |
| வாய்ப்பாட்டு எடை | 194.704 கி/மோல் |
| தோற்றம் | வெண்ணிறத் திண்மம் |
| உருகுநிலை | above 700 °செ (பதங்கமாகிறது) |
| கட்டமைப்பு | |
| படிக அமைப்பு | நான்முகி, tI10 |
| புறவெளித் தொகுதி | I4/mmm, No. 139 |
மாறுதலாக ஏதும் சொல்லவில்லை என்றால் கொடுக்கப்பட்ட தரவுகள் யாவும் பொருள்கள் அவைகளின் இயல்பான வெப்ப அழுத்த நிலையில் (25°C, 100kPa) இருக்கும். | |
வெள்ளீயம்(IV) புளோரைடு என்பது (Tin(IV) fluoride) வெள்ளீயம் மற்றும் புளோரின் தனிமங்கள் சேர்ந்து உருவாகும் ஒரு வேதிச் சேர்மம் ஆகும். SnF4 என்ற மூலக்கூற்று வாய்ப்பாட்டால் இது அடையாளப்படுத்தப்படுகிறது. வெள்ளை நிறத் திண்மமான இதன் உருகுநிலை 700° செல்சியசு வெப்பநிலையாகும்.[1]
தயாரிப்பு
[தொகு]வெள்ளீயம் உலோகம், புளோரின் வாயுவுடன்[2] வினைபுரிந்து SnF4 தயாரிக்கப்படுகிறது.
- Sn + 2F2 → SnF4
எனினும், ஒரு செயலற்ற உலோக புளோரைடு அடுக்கு உருவாக்கப்படுவதால் வெள்ளீயம்(IV) புளோரைடு சேர்மத்தின் மேற்பரப்பு இறுதியில் செயலற்றதாகிவிடும். எனவே வெள்ளீய(IV) குளோரைடுடன் நீரற்ற ஐதரசன் புளோரைடு சேர்த்து வெள்ளீயம்(IV) புளோரைடு தயாரிக்கும் மாற்று தொகுப்பு முறை பயன்படுத்தப்படுகிறது.
- SnCl4 + 4HF → SnF4 + 4HCl
பொட்டாசியம் புளோரைடு போன்ற கார உலோக புளோரைடுகளுடன் இது அறுபுளுரோசிடானேட்டுகளை உற்பத்தி (எ. கா K2SnF6) செய்கிறது. இது எண்முக SnF62− எதிர்மின் அயனியை கொண்டுள்ளது. SnF4 ஒரு லூயிசு அமிலமாக செயல்படுகிறது. L2·SnF4 மற்றும் L·SnF4 என்ற கூட்டுவிளைபொருளையும் உற்பத்தி செய்கிறது.
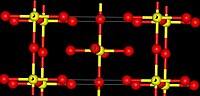
கட்டமைப்பு
[தொகு]மற்ற வெள்ளீய டெட்ரா ஆலைடுகளான வெள்ளீயம்(IV) குளோரைடு, வெள்ளீயம்(IV) குளோரைடு, வெள்ளீயம்(IV) புரோமைடு, மற்றும் வெள்ளீயம்(IV) அயோடைடு, போன்றவற்றைப் போலல்லாமல் வெள்ளீயம்(IV) புளோரைடு எண்முகமாக ஒருங்கிணைக்கப்பட்ட வெள்ளீய சமதள அடுக்குகளைக் கொண்டுள்ளது. இங்கு எண்கோணம் நான்கு மூலைகளைப் பகிர்ந்து கொள்கிறது மேலும் இரண்டு முனையங்கள், பகிரப்படாத, புளோரின் அணுக்கள் ஒன்றோடொன்று மாறுபடுகின்றன. [3] மற்ற வெள்ளீயம்(IV) ஆலைடுகளைக் காட்டிலும் வெள்ளீயம்(IV) புளோரைடின் உருகு நிலை 700 பாகை செல்சியசு என்ற உயர் வெப்பநிலையில் உள்ளது. ஒப்பீட்டளவில் அவை (SnCl4, -33.3 °செல்சியசு; SnBr4, 31 °செல்சியசு; SnI4, 144 செல்சியசு) குறைந்தளவு உருகுநிலையைக் கொண்டுள்ளன. தொகுதி 14 இல் உள்ள இலேசான உலோகங்களின் டெட்ராபுளோரைடுகள் வடிவங்களை விட இது மாறுபட்ட வடிவத்தைக் கொண்டுள்ளது. திண்ம நிலையில் வெள்ளீயம் டெட்ரா புளோரைடு மூலக்கூறு படிகங்களாக உள்ளது.
மேற்கோள்கள்
[தொகு]- ↑ Greenwood, N. N.; Earnshaw, A. (1997). Chemistry of the Elements (2nd ed.). Oxford:Butterworth-Heinemann. p. 381. பன்னாட்டுத் தரப்புத்தக எண் 0-7506-3365-4.
{{cite book}}: More than one of|ISBN=and|isbn=specified (help); More than one of|author2=and|last2=specified (help) - ↑ Holleman, A. F.; Wiberg, E.; Wiberg, N. (2001). Inorganic Chemistry, 1st Edition. Academic Press. p. 908. பன்னாட்டுத் தரப்புத்தக எண் 0-12-352651-5.
- ↑ Inorganic Chemistry [Paperback],2d Edition, Housecroft, Sharpe,2004, Pearson Education பன்னாட்டுத் தரப்புத்தக எண் 0130399132, பன்னாட்டுத் தரப்புத்தக எண் 978-0130399137
