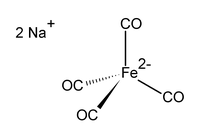
டைசோடியம் டெட்ராகார்பனைல்பெர்ரேட்டு
| |
| பெயர்கள் | |
|---|---|
| ஐயூபிஏசி பெயர்
டைசோடியம் டெட்ராகார்பனைல்பெர்ரேட்டு
| |
| முறையான ஐயூபிஏசி பெயர்
டைசோடியம் டெட்ராகார்பனைல் பெர்ரேட்டு | |
| வேறு பெயர்கள்
டைசோடியம் இரும்பு டெட்ராகார்பனைல், கோல்மேன் வினையாக்கி
| |
| இனங்காட்டிகள் | |
| 14878-31-0 | |
| EC number | 238-951-0 |
InChI
| |
| யேமல் -3D படிமங்கள் | Image |
| பப்கெம் | 73357794 |
SMILES
| |
| பண்புகள் | |
| C4FeNa2O4 | |
| வாய்ப்பாட்டு எடை | 213.87 |
| தோற்றம் | நிறமற்ற திண்மம் |
| அடர்த்தி | 2.16 கி/செ.மீ3, திண்மம் |
| சிதைவடையும் | |
| கரைதிறன் | டெட்ரா ஐதரோபியூரான், டைமெத்தில்பார்ம்மைடு, டையாக்சேன் |
| கட்டமைப்பு | |
| படிக அமைப்பு | சிதைந்த நான்முகி |
| ஒருங்கிணைவு வடிவியல் |
நான்முகி |
| தீங்குகள் | |
| முதன்மையான தீநிகழ்தகவுகள் | காற்றில் தானே தீப்பிடிக்கும் |
மாறுதலாக ஏதும் சொல்லவில்லை என்றால் கொடுக்கப்பட்ட தரவுகள் யாவும் பொருள்கள் அவைகளின் இயல்பான வெப்ப அழுத்த நிலையில் (25°C, 100kPa) இருக்கும். | |
| | |
| Infobox references | |
டைசோடியம் டெட்ராகார்பனைல்பெர்ரேட்டு (Disodium tetracarbonylferrate) என்பது Na2[Fe(CO)4] என்ற மூலக்கூற்று வாய்ப்பாட்டால் விவரிக்கப்படும் ஒரு கனிம வேதியியல் சேர்மமாகும். டைசோடியம் இரும்பு டெட்ராகார்பனைல், கோல்மேன் வினையாக்கி என்ற பெயர்களாலும் இச்சேர்மம் அழைக்கப்படுகிறது. எப்போதும் இச்சேர்மம் ஒரு கரைப்பானேற்றியாகவே பயன்படுத்தப்படுகிறது. சோடியம் நேர்மின் அயனியுடன் பிணையக்கூடிய டெட்ரா ஐதரோபியூரான் அல்லது டைமெத்தாக்சியீத்தேன் போன்ற சேர்மங்களுடன் சேர்த்து இச்சேர்மத்தைப் பயன்படுத்தப்படுவது இதற்கான ஓர் உதாரணமாகும் [1]. முக்கியமாக ஆல்டிகைடுகள் தயாரிப்பில் டைசோடியம் டெட்ராகார்பனைல்பெர்ரேட்டு பெரிதும் பயன்படுகிறது [2]. ஆக்சிசன் உணரியான நிறமற்ற இத்திண்மம் ஒரு வினைப்பொருளாக கரிம உலோக வேதியியல் மற்றும் கரிமவேதியியல் ஆய்வுகளில் பெரிதும் பயன்படுகிறது. ஆனால் வர்த்தக ரீதியாக இச்சேர்மம் அதிகப் பயன்பாட்டில் இல்லை. காற்றில் இச்சேர்மம் தானாகவே தீப்பற்றி எரியும் தன்மை கொண்டதாகும்.
கட்டமைப்பு[தொகு]
[Fe(CO)4]2− ஈரெதிர்மின் அயனி டெட்ரா கார்பனைல் நிக்கல் (Ni(CO)4) சேர்மத்துடன் ஒத்த எலக்ட்ரான் அமைப்பை கொண்டுள்ளது. நான்முகிக் கட்டமைப்பை இதன் உப்புகள் ஏற்பதில்லை.
டைசோடியம் டெட்ராகார்பனைல்பெர்ரேட்டு பொதுவாக சோடியம் நேர்மின் அயனியுடன் அணைவுச் சேர்மமாக்கப்பட்டு டையாக்சேனுடன் சேர்த்து பயன்படுத்தப்படுகிறது, இந்த டையாக்சேன் கரைபொருளானது கோல்மன் வினையாக்கியின் மறு உருவாக்கம் என அழைக்கப்படுகிறது.[3]. டெட்ராகார்பனைல்பெர்ரேட்டு ஈரெதிர்மின் அயனி நான்முகி வடிவத்தில் காணப்படுகிறது.[4][5].
தயாரிப்பு[தொகு]
இரும்பு பெண்டாகார்பனைலுடன் சோடியம் இரசக்கலவையைச் சேர்த்து முதலில் தேவையான வினையாக்கி தயாரித்துக் கொள்ளப்படுகிறது[6]. சோடியம் நாப்தீனைடை ஓர் ஒடுக்கும் பொருளாகப் பயன்படுத்தி நவீன தயாரிப்பு முறையில் டைசோடியம் டெட்ராகார்பனைல்பெர்ரேட்டு தயாரிக்கப்படுகிறது. வினையில் பயன்படுத்தும் இரும்பு பெண்டாகார்பனைல் சேர்மத்தின் தரத்தைப் பொறுத்து உற்பத்தியாகும் விளை பொருளின் உற்பத்தி திறன் அமைகிறது[1]
- Fe(CO)5 + 2 Na → Na2[Fe(CO)4] + CO
சோடியம் உலோகத்தை குறைவாகப் பயன்படுத்தப்படும்போது ஒடுக்க வினையில் ஆக்டாகார்பனைல் டைபெர்ரேட்டு கிடைக்கிறது.:[1]
- 2 Fe(CO)5 + 2 Na → Na2[Fe2(CO)8] + 2 CO
மற்ற ஒடுக்கும் முகவர்களும் இவ்வினையில் செயலாற்றுகின்றன. இரும்பு(III) குளோரைடு(FeCl3).சேர்மத்தைப் பயன்படுத்தி கோல்மன் வினையாக்கியை தயாரித்தல் மற்றொரு தயாரிப்பு முறையாகும்.[7]
- FeCl3 + Na(C10H8) + 4CO + THF → +Na → Na2[Fe(CO)4]
குறிப்பாக உரிய வினையாக்கிகள் இல்லாத நிலையில் கோல்மனின் வினையாக்கியை தயாரிப்பதற்கு இந்த தொகுப்பு வினை பாதைகள் மிகவும் பயனுள்ளதாக இருக்கும்[8].
வினைகள்[தொகு]
முதல்நிலை ஆல்கைல் புரோமைடுகளை அவற்றுடன் தொடர்புடைய ஆல்டிகைடுகளாக இரண்டு படிநிலை ஓரு குடுவை வினைக்கு பயன்படுத்துவதற்கே இவ்வினைக்காரணி முதலில் விவரிக்கப்பட்டது.:[6]
- Na2[Fe(CO)4] + RBr → Na[RFe(CO)4] + NaBr
வினையில் ஈடுபடும் கரைசல் பின்னர் வரிசை முறைப்படி சூடாக்கப்பட்டு வினைபடுத்தப்படுகிறது. முதலில் டிரைபீனைல்பாசுபீனுடனும் (PPh3) அதைத் தொடர்ந்து அசிட்டிக் அமிலத்துடனும் தொடர் வினையில் ஈடுபடுத்தப்பட்டு ஆல்டிகைடு உருவாக்கப்படுகிறது.(RCHO).
அமில குளோரைடுகளை ஆல்டிகைடுகளாக மாற்றவும் டைசோடியம் டெட்ராகார்பனைல்பெர்ரெட்டு பயன்படுத்தப்படுகிறது. இத்தயாரிப்பு வினை இரும்பு (அசைல்) அணைவுச் சேர்மம் வழியாக நிகழ்கிறது.
- Na2[Fe(CO)4] + RCOCl → Na[RC(O)Fe(CO)4] + NaCl
- Na[RC(O)Fe(CO)4] + HCl → RCHO + "Fe(CO)4" + NaCl
ஆல்கைல் ஆலைடுகளுடன் டைசோடியம் டெட்ராகார்பனைல்பெர்ரெட்டு வினைபுரிந்து ஆல்கைல் அணைவுச் சேர்மங்களை தருகிறது.
- Na2[Fe(CO)4] + RX → Na[RFe(CO)4] + NaX
இத்தகைய இரும்பு ஆல்கைல்களை அவற்றுடன் தொடர்பு கொண்ட கார்பாக்சிலிக் அமிலம் மற்றும் அமில ஆலைடுகள் உருவாக்கப்படுகின்றன:
- Na[RFe(CO)4] + O2, H+ →→ RCO2H + Fe...
- Na[RFe(CO)4] + 2 X2 → RC(O)X + FeX2 + 3 CO + NaX
இலித்தியம் அல்லது கோபால்ட்டு தனிமத்தை வினையில் சேர்த்தால் [LFe(CO)3(C(O)R)]Na என்ற அணைவுச் சேர்மம் கிடைக்கும். பின்னர் ஆல்க்கைல் ஆலைடு (R'X) சேர்க்கப்பட்டு RC(O)R' சேர்மத்தை தயாரிக்க முடியும்.[7]
- Na[RFe(CO)4] + L → [LFe(CO)3(C(O)R)]Na → RC(O)R' + [LFe(CO)3]Na-->
டெட்ராகார்பனைல் பெர்ரேட்டு ஈரெதிர்மின் அயனி ஒரு சக்தி வாய்ந்த மின்னணு மிகுபொருளாகும். இதன் முதன்மை பயன்பாடு ஆலைடு சேர்மங்களின் பண்புகளை செயல்படுத்துவதாகும்.
மேற்கோள்கள்[தொகு]
- ↑ 1.0 1.1 1.2 Strong, H.; Krusic, P. J.; San Filippo, J. (1990). R. J. Angelici. ed. "Sodium Carbonyl Ferrates, Na2[Fe(CO)4], Na2[Fe2(CO)8], and Na2[Fe3(CO)11]. Bis[μ-Nitrido-Bis(triphenylphosphorus)1+] Undeca-Carbonyltriferrate2−, [(Ph3P)2N]2[Fe3(CO)11]". Inorganic Syntheses (New York: J. Wiley & Sons) 28: 203–207. doi:10.1002/9780470132593.ch52. பன்னாட்டுத் தரப்புத்தக எண்:0-471-52619-3.
- ↑ Pike, R. D. (2001). "Disodium Tetracarbonylferrate(-II)". Encyclopedia of Reagents for Organic Synthesis. DOI:10.1002/047084289X.rd465.
- ↑ Miessler, G. L.; Tarr, D. A. (2004). Inorganic Chemistry. Upper Saddle River, NJ: Pearson. https://archive.org/details/inorganicchemist03edmies.
- ↑ Chin, H. B.; Bau, R. (1976). "The Crystal Structure of Disodium Tetracarbonylferrate. Distortion of the Tetracarbonylferrate2− Anion in the Solid State". Journal of the American Chemical Society 98 (9): 2434–2439. doi:10.1021/ja00425a009.
- ↑ Teller, R. G.; Finke, R. G.; Collman, J. P.; Chin, H. B.; Bau, R. (1977). "Dependence of the tetracarbonylferrate(2-) geometry on counterion: crystal structures of dipotassium tetracarbonylferrate and bis(sodium crypt) tetracarbonylferrate [crypt = N(CH2CH2OCH2CH2OCH2CH2)3N]". Journal of the American Chemical Society 99: 1104–1111. doi:10.1021/ja00446a022.
- ↑ 6.0 6.1 Cooke, M. P. (1970). "Facile Conversion of Alkyl Bromides into Aldehydes Using Sodium Tetracarbonylferrate(-II)". Journal of the American Chemical Society 92 (20): 6080–6082. doi:10.1021/ja00723a056.
- ↑ 7.0 7.1 Scholsser, M. (2013). Organometallics in Synthesis, Third Manual. Chicester, England: Wiley.
- ↑ Rameshkumar, C. (2011). New Reactive Iron Carbonyl Reagents for Applications in Organic Synthesis. Hyderabad, India: University of Hyderabad.
