கால்சியம் சயனைடு
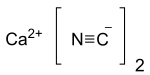
| |
| பெயர்கள் | |
|---|---|
| ஐயூபிஏசி பெயர்
கால்சியம் டைசயனைடு
| |
| முறையான ஐயூபிஏசி பெயர்
கால்சியம் டைசயனைடு | |
| இனங்காட்டிகள் | |
| 592-01-8 | |
| ChemSpider | 11102 |
| EC number | 209-740-0 |
InChI
| |
| யேமல் -3D படிமங்கள் | Image |
| பப்கெம் | 11590 |
SMILES
| |
| பண்புகள் | |
| Ca(CN)2 | |
| வாய்ப்பாட்டு எடை | 92.1128 கி/மோல் |
| தோற்றம் | வெண்மையான தூள் |
| மணம் | ஐதரசன் சயனைடு |
| அடர்த்தி | 1.853 (20 °செல்சியசு) |
| உருகுநிலை | 640 °C (1,184 °F; 913 K) (சிதைவடையும்) |
| கரையும் | |
| கரைதிறன் | எத்தனாலில் கரையும், அமிலங்களில் கரையும். |
| கட்டமைப்பு | |
| படிக அமைப்பு | சாய்சதுரம் |
| தீங்குகள் | |
Autoignition
temperature |
தீப்பற்றாது. |
மாறுதலாக ஏதும் சொல்லவில்லை என்றால் கொடுக்கப்பட்ட தரவுகள் யாவும் பொருள்கள் அவைகளின் இயல்பான வெப்ப அழுத்த நிலையில் (25°C, 100kPa) இருக்கும். | |
| Infobox references | |
கால்சியம் சயனைடு (Calcium cyanide) என்பது Ca(CN)2 என்ற மூலக்கூற்று வாய்ப்பாட்டால் விவரிக்கப்படும் ஒரு கனிம வேதியியல் சேர்மமாகும். கருப்பு சயனைடு என்ற பெயராலும் இது அழைக்கப்படுகிறது. கால்சியம் சயனைடு வெள்ளை நிறங்கொண்டது. திண்மமான இச்சேர்மம் தூய்மையான வடிவத்தில் அரிதாகவே காணப்படுகிறது. வணிக மாதிரிகள் கருப்பு கலந்த சாம்பல் நிறமாக இருக்கும் . இச்சேர்மத்தை சயனைடின் கால்சியம் உப்பு என்பார்கள். இது ஈரமான காற்றில் கூட உடனடியாக நீராற்பகுப்புக்கு உட்பட்டு ஐதரசன் சயனைடை கொடுக்கிறது. மற்ற சயனைடுகளைப் போலவே இது மிகவும் நச்சுத்தன்மை வாய்ந்தது ஆகும்.
தயாரிப்பு[தொகு]
தூளாக்கப்பட்ட கால்சியம் ஆக்சைடுடன் கொதிக்கும் நீரற்ற ஐதரோசயனிக் அமிலத்தை அமோனியா அல்லது நீர் போன்ற முடுக்கிகள் முன்னிலையில் சூடுபடுத்தினால் கால்சியம் சயனைடு தயாரிக்கப்படுகிறது. பலபடியாக்கல் வினை நிகழ்ந்து ஐதரோசயனிக் அமிலம் இழக்கப்படுவதை தவிர்க்கவே வினைபடு கலவையுடன் முடுக்கிகள் சேர்க்கப்படுகின்றன. நீர்ம ஐதரோசயனிக் அமிலத்துடன் கால்சியம் கார்பைடு சேர்த்து வினை புரியச் செய்வதன் மூலமும் கால்சியம் சயனைடு தயாரிக்க முடியும். மாற்றாக கால்சியம் சயனைடை 400 பாகை செல்சியசுக்கும் அதிகமான வெப்பநிலையில் ஐதரோசயனிக் அமில வாயுவை கால்சியம் ஆக்சைடுடன் (CaO) சேர்த்து வினைபுரியச் செய்வதன் மூலமும் இதை தயாரிக்கலாம். கிட்டத்தட்ட 600 பாகை செல்சியசு போன்ற உயர் வெப்பநிலையில் கால்சியம் சயனிமைடு அதற்கு பதிலாக உருவாகிறது. இவ்வாறு தயாரிக்கப்படும் கால்சியம் சயனைடு பெரும்பாலும் ஐதரசன் சயனைடின் பலபடியாக்கல் வழிப்பெறுதிகளால் தூய்மை கெட்டு மாசுநிறைந்த கால்சியம் சயனைடாகிறது. இம்மாசுக்கள் கலப்பினால் உது கருப்பு நிறத்துடன் காணப்படுகிறது.
வினைகள்[தொகு]
கால்சியம் சயனைடு உடனடியாக நீராற்பகுப்பு அடைந்து ஐதரசன் சயனைடு வாயுவை உருவாக்குகிறது. அமிலத்தின் இருப்பு ஐதரசன் சயனைடு வாயுவின் வெளியேற்றத்தை துரிதப்படுத்துகிறது. . ஆக்சிசனேற்ற முகவர்களுடன் கால்சியம் சயனைடு தீவிரமாக வினைபுரியும் . கால்சியம் சயனைடு சில சமயங்களில் அம்மோனியம் சயனைடை தயாரிக்கவும் பயன்படுகிறது. இதற்காக அம்மோனியம் கார்பனேட்டுடன் கால்சியம் சயனைடு சேர்க்கப்பட்டு வினைபுரியச் செய்யப்படுகிறது:
Ca(CN) 2 + (NH 4)2CO3 → 2 NH 4CN + CaCO3.
பயன்கள்[தொகு]
கால்சியம் சயனைடு சுரங்கத் தொழிலில் கிட்டத்தட்ட பிரத்தியேகமாகப் பயன்படுத்தப்படுகிறது. இது ஒரு மலிவான சயனைடு தயாரிப்புக்கான ஆதாரமாக விளங்குகிறது. தங்கம், வெள்ளி போன்ற விலைமதிப்பற்ற உலோகங்களை அவற்றின் தாதுக்களிலிருந்து தயாரிப்பதற்கு பயன்படும் கழுவிப்பகுத்தல் செயல்முறைக்கு கால்சியம் சயனைடு பயன்படுகிறது [2]. கால்சியம் சயனைடு பிரிக்கப்படும் விலையுயர்ந்த உலோகங்களுடன் சேர்ந்து அணைவுச் சேர்மங்களை உருவாக்கி தாதுக்களிலிருந்து அவற்றை பிரித்துக் கொடுக்கிறது.[3]. இச்சேர்மம் திண்ம நிலை செதில்களாக அல்லது திரவ வடிவில் விநியோகிக்கப்படுகிறது [2]. கால்சியம் சயனைடு சேர்மத்தின் உயர் நச்சுத்தன்மை காரணமாக தொடுதல் , உள்ளிழுத்தல் அல்லது உட்கொள்ளல் போன்ற செயல்களால் கொறிக்கும் பிராணிகளை கொல்லும் கொறினி கொல்லியாக இது பயனுள்ளதாக இருக்கும். எடுத்துக்காட்டாக, இந்திய முகடு முள்ளம்பன்றிகளின் ( இசுட்ரிக்சு இண்டிகா ) எண்ணிக்கை நிர்வாகத்தில் கால்சியம் சயனைடு பயன்படுத்தப்பட்டுள்ளது. இதன் நச்சுத்தன்மை காரணமாக இதேபோல் ஒரு பூச்சிக்கொல்லியாகவும் இது பயன்படுத்தப்படுகிறது <ref name="Flint, W. P., and W. V. Balduf">. இருப்பினும் இதன் உயர் நச்சுத்தன்மை பல சந்தர்ப்பங்களில் சாதகமற்ற விளைவுகளை உருவாக்குகிறது. எனவே பெரும்பாலும் குறைவான நச்சுத்தன்மை கொண்ட வேதிப்பொருட்கள் பயன்படுத்தப்படுகின்றன. ஐதரசன் சயனைடு, அமோனியம் சயனைடு, மற்றும் பெர்ரோசயனைடு போன்ற சயனைடு சேர்மங்களை தயாரிக்கவும் இது பயன்படுகிறது.
பாதுகாப்பு[தொகு]
மற்ற சயனைடுகள் போல இதுவும் ஒரு நச்சு என்பதால் எச்சரிக்கையுடன் இதைப் பயன்படுத்த வேண்டும்.
மேற்கோள்கள்[தொகு]
- ↑ http://cameochemicals.noaa.gov/chemical/2775
- ↑ 2.0 2.1 "Use of Cyanide for the Gold Industry" International Cyanide Management Code for the Use of Cyanide in the Gold . 2011. http://www.cyanidecode.org/cyanide_use.php பரணிடப்பட்டது 2012-02-29 at the வந்தவழி இயந்திரம் (accessed April 22, 2012).
- ↑ . "coordination compound" Encyclopædia Britannica. Encyclopædia Britannica Online Academic Edition. 2012. http://www.britannica.com/EBchecked/topic/136410/coordination-compound.
