ஈத்தீனோன்

| |

| |
| பெயர்கள் | |
|---|---|
| விருப்பத்தெரிவு ஐயூபிஏசி பெயர்
ஈத்தீனோன்[1] | |
| வேறு பெயர்கள்
கீட்டீன்
கார்போமீத்தீன் கீட்டோ-எத்திலீன் | |
| இனங்காட்டிகள் | |
| 463-51-4 | |
Beilstein Reference
|
1098282 |
| ChEBI | CHEBI:48003 |
| ChemSpider | 9643 |
| EC number | 207-336-9 |
| யேமல் -3D படிமங்கள் | Image |
| பப்கெம் | 10038 |
| வே.ந.வி.ப எண் | OA7700000 |
SMILES
| |
| UNII | LEP3SM032A |
| பண்புகள் | |
| C2H2O | |
| வாய்ப்பாட்டு எடை | 42.037 கி/மோல் |
| தோற்றம் | நிறமற்ற வாயு |
| மணம் | மூக்கைத்துளைக்கும் மணம் |
| அடர்த்தி | 1.93 கி/செமீ3 |
| உருகுநிலை | −150.5 °C (−238.9 °F; 122.6 K) |
| கொதிநிலை | −56.1 °C (−69.0 °F; 217.1 K) |
| சிதைகிறது | |
| கரைதிறன் | அசிட்டோன் எத்தனால் டை எத்தில் ஈதர் அரோமேட்டிக் கரைப்பான்கள் ஆலோகார்பன்களில் கரைகிறது. |
| ஆவியமுக்கம் | >1 வளிமண்டல அழுத்தம் (20°செ)[2] |
| ஒளிவிலகல் சுட்டெண் (nD) | 1.4355 |
| வெப்பவேதியியல் | |
| Std enthalpy of formation ΔfH |
-87.24 கிலோயூல்/மோல் |
| வெப்பக் கொண்மை, C | 51.75 யூல்/கெல்வின் மோல் |
| தீங்குகள் | |
| பொருள் பாதுகாப்பு குறிப்பு தாள் | External MSDS |
| தீப்பற்றும் வெப்பநிலை | −107 °C (−161 °F; 166 K) |
| வெடிபொருள் வரம்புகள் | 5.5-18% |
| Lethal dose or concentration (LD, LC): | |
LD50 (Median dose)
|
1300 mg/kg (oral, rat) |
LC50 (Median concentration)
|
17 ppm (mouse, 10 min)[3] |
LCLo (Lowest published)
|
23 ppm (mouse, 30 min) 53 ppm (rabbit, 2 hr) 53 ppm (guinea pig, 2 hr) 750 ppm (cat, 10 min) 200 ppm (monkey, 10 min) 50 ppm (mouse, 10 min) 1000 ppm (rabbit, 10 min)[3] |
| அமெரிக்க சுகாதார ஏற்பு வரம்புகள்: | |
அனுமதிக்கத்தக்க வரம்பு
|
TWA 0.5 ppm (0.9 mg/m3)[2] |
பரிந்துரைக்கப்பட்ட வரம்பு
|
TWA 0.5 ppm (0.9 mg/m3) ST 1.5 ppm (3 mg/m3)[2] |
உடனடி அபாயம்
|
5 ppm[2] |
மாறுதலாக ஏதும் சொல்லவில்லை என்றால் கொடுக்கப்பட்ட தரவுகள் யாவும் பொருள்கள் அவைகளின் இயல்பான வெப்ப அழுத்த நிலையில் (25°C, 100kPa) இருக்கும். | |
| | |
| Infobox references | |
கரிம வேதியியலில், ஈத்தீனோன் (Ethenone) என்பது கீட்டீனின் (Ketene) முறையான பெயர் ஆகும். இது C2H2O அல்லது H2C=C=O வாய்ப்பாட்டுடன் கூடிய கரிமச் சேர்மமாகும். இது கீட்டீன் வகுப்பின் எளிமையான உறுப்பினர் ஆகும். இது அசிடைலேற்றங்களுக்குப் பயன்படும் ஒரு முக்கியமான வினைக்காரணியாகும்.
பண்புகள்[தொகு]
ஈத்தீனோன் மிகவும் வினைத்திறன் கொண்ட வாயுவாகும்.(நிலையான நிலையில்) இந்த வாயு கூர்மையான எரிச்சலூட்டும் வாசனையைக் கொண்டுள்ளது. இது குறைந்த வெப்பநிலையில் மட்டுமே நிலையானதாக இருக்கும் (−80°C). எனவே, பயன்பாட்டிற்குத் தேவைப்படும் போது தயார் நிலையில் இருப்பதற்கு ஏதுவாக அவ்வப்போது தயாரித்துக் கொள்ளப்பட வேண்டும், இல்லையெனில் இருபடியாக்கல் ஏற்பட்டு பலபடிகளுடன் வினைப்பட்டு கையாளக் கடினமாக இருக்கும் பலபடிகளுடன் வினையாற்றுகிறது. தயாரிப்பின் போது உருவாகும் பலபடி உள்ளடக்கம் கீட்டீன் வாயுவில் கந்தக டை ஆக்சைடை சேர்ப்பதன் மூலம் குறைக்கப்படுகிறது. [4] இச்சேர்மத்தின் கூட்டுப்பயனுடைய இரட்டைப் பிணைப்புகளின் காரணமாக, எத்தனோன் அதிக வினைத்திறன் கொண்டதாக உள்ளது. மேலும், தொடர்புடைய அசிட்டிக் அமிலத்தின் வழிப்பொருள்களுக்கு H-அமிலச் சேர்மங்களின் கலவைகளின் சேர்க்கை வினைகளில் வினைபுரிகிறது. எடுத்துக்காட்டாக, இது தண்ணீருடன் வினைபுரிந்து அசிட்டிக் அமிலமாகவும் முதன்மை அல்லது இரண்டாம் நிலை அமீன்களுடன் வினைப்பட்டு தொடர்புடைய அசிடமைடுகளாகவும் மாறுகிறது.
தயாரிப்பு[தொகு]
தொழில்துறை வேதியியலில், அசிட்டிக் அமிலத்தின் நீர் நீக்க வினையால் கீட்டீன் உற்பத்தி செய்யப்படுகிறது:
ஆய்வக அளவில், 200°செல்சியசிற்கும் அதிகமான வெப்பநிலையில் மெல்ட்ரம் அமிலத்தின் வெப்பச் சிதைவு மூலம் இதை உருவாக்க முடியும்.
வரலாறு[தொகு]
500-600°செல்சியசில் சூடான குழாய்கள் அல்லது மின்சாரம் மூலம் வெப்பப்படுத்தப்பட்ட உலோகக் (செம்பு போன்ற) கம்பிகள் வழியாக அனுப்பப்படும் போது கார்பன் டைசல்பைடு முன்னிலையில் , அசிட்டோன் மீத்தேன் மற்றும் எத்தனோனாக சிதைவடைகிறது. இந்த வினையில் 95% விளைபொருள் கிடைக்கும்.[5] 1910 ஆம் ஆண்டில் ஹெர்மன் ஸ்டாடிங்கர் (உலோக துத்தநாகத்துடன் புரோமோஅசிட்டைல் புரோமைடு வினை மூலம்) [6] [7] அசிட்டிக் அமிலத்தின் நீர் நீக்க வினையிலிருந்து தயாரிக்கப்பட்டு கண்டுபிடிக்கப்பட்டது.
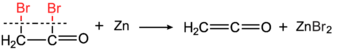
அசிட்டிக் நீரிலியின் வெப்பச் சிதைவு வினையும் விவரிக்கப்பட்டது. [8]



இயற்கையில் கிடைக்கும் விதம்[தொகு]
ஈத்தீனோன் விண்வெளியில், வால்மீன்களில் அல்லது விண்மீன்களுக்கு இடையேயான ஊடகத்தின் ஒரு பகுதியாக வாயு நிலையில் உருவாவதாக அறியப்படுகிறது.[9]
பயன்பாடு[தொகு]
அசிட்டிக் அமிலத்திலிருந்து அசிட்டிக் நீரிலியை உருவாக்க எத்தனோன் பயன்படுத்தப்படுகிறது. பொதுவாக இது வேதிச் சேர்மங்களின் அசிட்டைலேற்ற வினைகளுக்குப் பயன்படுத்தப்படுகிறது.
மேற்கோள்கள்[தொகு]
- ↑ "Front Matter". Nomenclature of Organic Chemistry : IUPAC Recommendations and Preferred Names 2013 (Blue Book). Cambridge: The Royal Society of Chemistry. 2014. பக். 723. doi:10.1039/9781849733069-FP001. பன்னாட்டுத் தரப்புத்தக எண்:978-0-85404-182-4.
- ↑ 2.0 2.1 2.2 2.3 "NIOSH Pocket Guide to Chemical Hazards #0367". National Institute for Occupational Safety and Health (NIOSH).
- ↑ 3.0 3.1 "Ketene". Immediately Dangerous to Life and Health. National Institute for Occupational Safety and Health (NIOSH).
- ↑ EP 0377438, issued 1990-06-11, assigned to Lonza AG
- ↑ K.-H.
- ↑ H. Staudinger H. W. Klever (1908): "Keten. Bemerkung zur Abhandlung zur Abhandlung der HHrn. V.T. Wilsmore und A. W. Stewart".
- ↑ Tidwell, T. T. (2005), "Ein Jahrhundert Ketene (1905–2005): die Entdeckung einer vielseitigen Klasse reaktiver Intermediate".
- ↑ Norman Thomas Mortimer Wilsmore (1907): "Keten".
- ↑ Hudson, Reggie L.; Loeffler, Mark J. (31 July 2013). "Ketene Formation in Interstellar Ices: A Laboratory Study". The Astrophysical Journal 773 (2): 109. doi:10.1088/0004-637x/773/2/109. Bibcode: 2013ApJ...773..109H.



