மின்வேதிக் கலம்
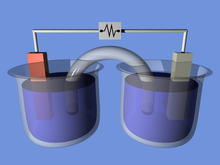
மின்வேதிக்கலம் (electrochemical cell) என்பது வேதிவினைகளில் இருந்து மின் ஆற்றலை உருவாக்கவல்ல அல்லது மின் ஆற்றலைப் பயன்படுத்தி வேதிவினைகளை நிகழ்த்தவல்ல கருவியாகும். மின்வேதிக்கலத்துக்கான பொது எடுத்துகாட்டு நுகர்வாளர்கள் பயன்படுத்தும் செந்தர 1.5-வோல்ட் மின்கல அடுக்கு ஆகும். இவ்வகை இயல்பான மின்கல அடுக்கு தனி கால்வானியக் கல மின்கல அடுக்கு என அழைக்கப்படுகிறது. இது இணையாக அல்லது தொடராக உள்ள பாணியிலோ அமைந்த பல கலங்களால் ஆனதாகும்.[1][2][3]
அரைக்கலங்கள்
[தொகு]
மின்வேதிக் கலம் இரண்டு அரைக்கலங்களால் ஆனதாகும். ஒவ்வொரு அரைக்கலத்திலும் ஒரு மின்முனையும் மின்பகுளியும் அமைந்திருக்கும். இரு அரைக்கலங்களும் ஒரே மைன்பகுளியையோ தனித்தனி மின்பகுளிகளையோ பயன்படுத்தலாம். கல வேதிவினையில் மின்முனையும் மின்பகுளியும் அல்லாது எரிபொருட்கலத்தைப் போல வேறு வெளிப்பொருளும் உள்ளடங்கும். எரிபொருட்கலத்தில் வெளிப்பொருளாக நீரகம் பயன்படுகிறது. மின்வேதிக் கலத்தில் ஓர் அரைக்கல மின்முனையின் வினைபடு பொருள் மின்னன்களை மின்முனையில் இழக்க, உயிரவேற்ற வினை நடைபெறும்; மறு அரைக்கலத்தில் மின்முனையில் இருந்து மின்னன்களைப் பெற, குறைப்பு வினை நடைபெறும்.
சமனிலை வேதிவினை
[தொகு]கல மின்னிலை
[தொகு]கல மின்னிலையை மின்முனை மின்னிலைகள் வழியாக முன்கணிக்கலாம். மின்முனை மின்னிலைகள் மின்வேதிக் கலத்தின் அரைகலங்களின் மின்னிலைகளாகும்.
- உயிரகவேற்றவினையை உருவாக்கிட (ஒட்டுமொத்த கல நேர்மின்னிலையை அடைய) குறைந்த மின்னிலையில் குறைப்புவினையை எதிர்திசையில் நிகழச் செய்யவேண்டும்.
- மின்னன் சமனிலையை அடைய அரைவினைகள் முழு எண்ணால் பெருக்க்ப்படவேண்டும்.
வினையை ஒரு மாறிலியால் பெருக்கும்போது கல மின்னிலை மாறாது.
கல மின்னிலை 0 முதல் 6 வோல்ட்கள் வரை மாறும். நீர் மின்பகுளியாக உள்ளபோது கல மின்னிலை 2.5 வோல்ட்டுக்கும் குறைவாகவே இருக்கும். ஏனெனில் உயர் கல மின்னிலைகளைப் பெற நீர்ய்டன் வினைபுரியும் திறன்மிக்க மின்னேற்றப் பொருள்களும் குறைப்புப் பொருள்களும் தேவைப்படுகின்றன.நீருக்கு மாற்றாக வேறு கரைசல்களைப் பயன்படுத்தி உயர் கல மின்னிலைகளை அடையலாம். காட்டாக, இலிதியம் கலங்கள் 3 வோல்ட்களில் இயல்பாகக் கிடைக்கின்றன.
கல மின்னிலை வினைபடு பொருள்களின் வகையையும் செறிவையும் பொறுத்தமையும். கலம் மின்னிறக்கப்படும்போது, வினைபடு பொருள்களின் செறிவு குறைகிறது. எனவே கல மின்னிலையும் குறையும்.
சான்றுகள்
[தொகு]- ↑ Wenzel, Thomas J. (2013-07-30). "Douglas A. Skoog, Donald M. West, F. James Holler, and Stanley R. Crouch: Fundamentals of analytical chemistry, 9th ed., international ed.". Analytical and Bioanalytical Chemistry 405 (25): 412–432. doi:10.1007/s00216-013-7242-1. பன்னாட்டுத் தர தொடர் எண்:1618-2642. http://dx.doi.org/10.1007/s00216-013-7242-1.
- ↑ Wendt, Hartmut; Kolb, Dieter M.; Engelmann, Gerald E.; Ziegler, Jörg C. (2011-10-15), "Electrochemistry, 1. Fundamentals", in Wiley-VCH Verlag GmbH & Co. KGaA (ed.), Ullmann's Encyclopedia of Industrial Chemistry (in ஆங்கிலம்), Weinheim, Germany: Wiley-VCH Verlag GmbH & Co. KGaA, pp. a09_183.pub4, எண்ணிம ஆவணச் சுட்டி:10.1002/14356007.a09_183.pub4, பன்னாட்டுத் தரப்புத்தக எண் 978-3-527-30673-2, பார்க்கப்பட்ட நாள் 2023-05-05
- ↑ Chemistry, Rice University, 2015. [Online]. Available: https://web.ung.edu/media/Chemistry2/Chemistry-LR.pdf
