நைட்ரோ சேர்மங்கள் ஒடுக்கம்
நைட்ரோ சேர்மங்கள் ஒடுக்கம் (Reduction of nitro compounds) என்ற வேதி வினை பல்வேறு வேதி வினைப் பொருள்கள் மற்றும் வினை நிபந்தனைகளால் பாதிக்கப்படுகிறது. ஒடுக்கப்பட வேண்டிய முதல் வேதி வினைக்குழுக்களில் ஒன்று நைட்ரோ குழுவாகுமென வரலாறு தெரிவிக்கிறது.
ஆல்கைல் மற்றும் அரைல் நைட்ரோ சேர்மங்களின் ஒடுக்கம் வேறு வகையில் நிகழ்கின்றன. எனவே ஒடுக்கும் வினை நிபந்தனைகளை தொடங்கும் பொருளை அடிப்படையாகக் கொண்டு அலிபாட்டிக் நைட்ரோ சேர்மங்கள், அரோமாட்டிக் நைட்ரோ சேர்மங்கள் என விரிவாக வகைப்படுத்த இயலும். இரண்டாம் நிலை வகைபாடுகள் வினைவிளை பொருள்களின் அடிப்படையில் அமைகின்றன.
அலிபாட்டிக் நைட்ரோ சேர்மங்கள்[தொகு]
ஐதரோகார்பன்களாக ஒடுக்கமடைதால்[தொகு]
ஐதரோநைட்ரோநீக்கம் என்பது நைட்ரோ குழுவை ஐதரசனைப் பயன்படுத்தி இடப்பெயர்ச்சி செய்வதைக் குறிக்கும். இவ்விடப்பெயர்ச்சி வினை மிகவும் கடினமான ஒரு செயலாகும். ஆனால், உயர் வெப்பநிலைகளில் சிலிக்கா அரைதிண்மக் கரைசல் மேலுள்ள பிளாட்டினம் மீது வினையூக்கியைப் பயன்படுத்தி ஐதரசனேற்ற வினையை நிகழ்த்தினால் இவ்விடப்பெயர்ச்சி வினை சாத்தியமாகும் [1]. டிரைபியூட்டைல்வெள்ளீயம் ஐதரைடுடன் ஒரு தனியுறுப்பு தொடக்கியைச் சேர்த்து தனியுறுப்பு வினையின் வழியாகவும் இவ்வினையை நிகழ்த்தலாம். அசோபிசு ஐசோபியூட்டைரோநைட்ரைல் தனியுறுப்பு தொடக்கிக்கு உரிய ஓர் உதாரணமாகும் [2]
அமீன்களாக ஒடுக்கமடைதல்[தொகு]
பல்வேறு வினைப் பொருள்களைப் பயன்படுத்தி நைட்ரோ சேர்மங்களை அலிபாட்டிக் அமீன்களாக ஒடுக்கமடையச் செய்ய முடியும்.
- பிளாட்டினம்(IV) ஆக்சைடைப் (PtO2)[3] பயன்படுத்தி வினையூக்க ஐதரசனேற்றம், அல்லது இரேனி நிக்கல் [4] வினையூக்கியைப் பயன்படுத்தி வினையூக்க ஐதரசனேற்றம்.
- மீளும் அசிட்டிக் அமிலத்தில் இரும்பு உலோகம்
- சமாரியம் டையையோடைடு [5]
- இரேனி நிக்கல், பிளாட்டினம் அல்லது கார்பன், அல்லது துத்தநாகப் பொடி மற்றும் பார்மிக் அமிலம் அல்லது அமோனியம் பார்மேட்டு [6]
α,β-நிறைவுறா நைட்ரோ சேர்மங்களை கீழ் கண்டுள்ள வழிகளில் நிறைவுற்ற அமீன்களாக ஒடுக்க முடியும்.
- பலேடியம்-மேல்-கார்பன் வினையூக்கியைக் கொண்டு ஐதரசனேற்றம் செய்தல்
- இரும்பு உலோகம்
- இலித்தியம் அலுமினியம் ஐதரைடு [7] (குறிப்பு:ஐதராக்சிலமீன்களும் ஆக்சைம்களும் மாசுக்களாகும்)
- இலித்தியம் போரோ ஐதரைடு அல்லது சோடியம் போரோ ஐதரைடுடன் டிரைமெத்தில்சிலில் குளோரைடு [8]
- சோடியம் பிசு(2-மெத்தாக்சியெத்தாக்சி)அலுமினியம் ஐதரைடு
ஐதராக்சிலமீன்களாக ஒடுக்கம்[தொகு]
டைபோரேனைப் பயன்படுத்தி அலிபாட்டிக் நைட்ரோ சேர்மங்களை அலிபாட்டிக் ஐதராக்சிலமீன்களாக ஒடுக்க முடியும்[9].
ஆக்சைம்களாக ஒடுக்கம்[தொகு]
வெள்ளீயம் குளோரைடு[10] அல்லது குரோமியம்(II) குளோரைடு[11] போன்ற உலோக உப்புகளைப் பயன்படுத்தி நைட்ரோ சேர்மங்களை ஆக்சைம்களாக ஒடுக்க முடியும். கட்டுப்படுத்தப்பட்ட ஐதரசனை வினையூக்க ஐதரசனேற்ற வினைக்கு உட்படுத்தியும் ஆக்சைம்களைப் பெறமுடியும் [12]
அரோமாட்டிக் நைட்ரோ சேர்மங்கள்[தொகு]
அனிலின்களாக ஒடுக்கம்[தொகு]
 நைட்ரோ அரோமாட்டிக் சேர்மங்களை ஒடுக்கம் செய்தல் தொழில்முறை அளவுகளில் மேர்கொள்ளப்படுகிறது[13]. அரைல் நைட்ரோ சேர்மங்களிலிருந்து அனிலின் தயாரிப்பதற்கு பல வழிமுறைகள் உள்ளன.
நைட்ரோ அரோமாட்டிக் சேர்மங்களை ஒடுக்கம் செய்தல் தொழில்முறை அளவுகளில் மேர்கொள்ளப்படுகிறது[13]. அரைல் நைட்ரோ சேர்மங்களிலிருந்து அனிலின் தயாரிப்பதற்கு பல வழிமுறைகள் உள்ளன.
- இரேனி நிக்கலைப் பயன்படுத்தி வினையூக்க ஐதரசனேற்றம்[14] அல்லது சியோலைட்டின் மீது நிக்கம் நுண் துகள்கள்[15] பலேடியம்-மேல்-கார்பன்[16] பிளாட்டினம்(IV) ஆக்சைடு அல்லது உருசிபாரா நிக்கல்[6].
- அமில ஊடகத்திலுள்ள இரும்பு[17].(குறிப்பு:இவ்வொடுக்க வினைக்கு இரும்பு மிகப் பொருத்தமாக இருக்கும். (பிச்சாம்பு ஒடுக்கம்)
- சோடியம் ஐதரோசல்பைட்டு[18]
- சோடியம் சல்பைடு(அல்லது ஐதரசன் சல்பைடு மற்றும் காரம்). உதாரணமாக 1,3-டைநைட்ரோபென்சீன் வழிப்பொருளை சோடியம் சல்பைடு பயன்படுத்தி ஒடுக்கினால் 3-நைட்ரோ அனிலின் கிடைக்கிறது.[19]
- வெள்ளீய(II) குளோரைடு[20]
- தைட்டானியம்(III) குளோரைடு
- துத்தநாகம்
- சமாரியம்[21]
- இரேனி நிக்கல், பிளாட்டின-மேல்-கார்பன், அல்லது துத்தநாகப் பொடி அல்லது பார்மிக் அமிலம் அல்லது அமோனியம் பார்மேட்டு[6]
- பிளாட்டின-மேல்-கார்பன் முன்னிலையில் டெக்காபோரேன் மற்றும் அசிட்டிக் அமிலம்[6]
- ஐதரோ அயோடிக் அமிலம்[22]
அரைல் நைட்ரோ சேர்மங்களை அனிலின்களாக ஒடுக்க உலோக ஐதரைடுகள் பயன்படுத்தப்படுவதில்லை. ஏனெனில் அவை அசோ சேர்மங்களை உருவாக்குகின்றன.
ஐதராக்சிலமீன்களாக ஒடுக்கம்[தொகு]
அரைல் நைட்ரோ சேர்மங்களிலிருந்து அரைல் ஐதராக்சிலமீன்களைப் பெறுவதற்கு பல வழிமுறைகள் உள்ளன.
- இரேனி நிக்கலும் ஐதரசீனும் 0-10°செல்சியசு வெப்பநிலையில் வினை[23]
- மின்பகு ஒடுக்கம்[24]
- நீர்த்த அமோனியம் குளோரைடிலுள்ள துத்தநாகம்[25]
ஐதரசீனோ சேர்மங்களாக ஒடுக்கம்[தொகு]
நைட்ரோ அரீன்களுடன் அதிக அளவு துத்தநாக உலோகத்தைச் சேர்த்து சூடுபடுத்தினால் ”என்” ”என்” டையரைல் ஐதரசீன் உருவாகிறது.[26]
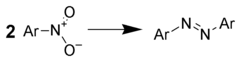
அசோ சேர்மங்களாக[தொகு]
அரோமாட்டிக் நைட்ரோ சேர்மங்களை உலோக ஐதரைடுகளுடன் சேர்த்து சூடுபடுத்துவதால் அசோ சேர்மங்கள் உருவாகின்றன.
- இலித்தியம் அலுமினியம் ஐதரைடு பயன்படுத்தலாம்[27]
- துத்தநாக உலோகத்தை சோடியம் ஐதராக்சைடுடன் சேர்த்து பயன்படுத்தலாம்.[26] (அதிக துத்தநாகம் அசோ குழுவை ஐதரசீனோ சேர்ம்மாக ஒடுக்கமடையச் செய்கிறது.
அசோக்சி சேர்மங்களாக ஒடுக்கம்[தொகு]
அரோமாட்டிக் சேர்மங்களை கீழ்கண்டவற்றைப் பயன்படுத்தி அசோக்சி சேர்மங்களாக மாற்றலாம்.
- Na3AsO3 அல்லது குளுக்கோசு அல்லது NaOH[28]
- C6H5NO2→ அசோக்சிபென்சீன்
மேற்கோள்கள்[தொகு]
- ↑ M. J. Guttieri; W. F. Maier (1984). "Selective cleavage of carbon-nitrogen bonds with platinum". J. Org. Chem. 49 (16): 2875–2880. doi:10.1021/jo00190a006.
- ↑ T. V. (Babu) RajanBabu, Philip C. Bulman Page, Benjamin R. Buckley, "Tri-n-butylstannane" Encyclopedia of Reagents for Organic Synthesis 2004, John Wiley & Sons. doi:10.1002/047084289X.rt181.pub2
- ↑ A. T. Nielsen (1962). "The Isomeric Dinitrocyclohexanes. II. Stereochemistry". J. Org. Chem. 27 (6): 1998–2001. doi:10.1021/jo01053a019.
- ↑ Dauben, Jr., H. J.; Ringold, H. J.; Wade, R. H.; Pearson, D. L.; Anderson, Jr., A. G. (1963). "Cycloheptanone". Organic Syntheses. http://www.orgsyn.org/demo.aspx?prep=cv4p0221.; Collective Volume, vol. 4, p. 221
- ↑ A. S. Kende; J. S. Mendoza (1991). "Controlled reduction of nitroalkanes to alkyl hydroxylamines or amines by samarium diiodide". Tetrahedron Letters 32 (14): 1699–1702. doi:10.1016/S0040-4039(00)74307-3.
- ↑ 6.0 6.1 6.2 6.3 Adams, J. P. (2002). "Nitro and related groups" (in en). Journal of the Chemical Society, Perkin Transactions 1 0 (23): 2586–2597. doi:10.1039/b009711j.
- ↑ A. Burger, M. L. Stein and J. B. Clements (1957). "Some Pyridylnitroalkenes, Nitroalkanols, and Alkylamines". J. Org. Chem. 22 (2): 143–144. doi:10.1021/jo01353a010.
- ↑ Giannis, A.; Sandhoff, K. (1989). "LiBH4(NaBH4)/Me3SiCl, an Unusually Strong and Versatile Reducing Agent" (in en). Angewandte Chemie International Edition in English 28 (2): 218–220. doi:10.1002/anie.198902181.
- ↑ H. Feuer, R. S. Bartlett, B. F. Vincent and R. S. Anderson (1965). "Diborane Reduction of Nitro Salts. A New Synthesis of N-Monosubstituted Hydroxylamines". J. Org. Chem. 30 (9): 2880–2882. doi:10.1021/jo01020a002.
- ↑ Braun, V. J.; Sobecki, W. (1911). "Über primäre Dinitro-, Nitronitrit- und Dialdoxim-Verbindungen der Fettreihe". Ber. 44 (3): 2526–2534. doi:10.1002/cber.19110440377.
- ↑ J. R. Hanson; E. Premuzic (1967). "Applications of chromous chloride--II : The reduction of some steroidal nitro-compounds". Tetrahedron 23 (10): 4105–4110. doi:10.1016/S0040-4020(01)97921-9.
- ↑ C. Grundmann (1950). "Über die partielle Reduktion von Nitro-cyclohexan". Angewandte Chemie 62 (23–24): 558–560. doi:10.1002/ange.19500622304.
- ↑ Gerald Booth (2007). Nitro Compounds, Aromatic. Weinheim: Wiley-VCH. doi:10.1002/14356007.a17_411.
- ↑ Allen, C. F. H.; VanAllan, J. (1955). "2-Amino-p-cymene". Organic Syntheses. http://www.orgsyn.org/demo.aspx?prep=cv3p0063.; Collective Volume, vol. 3, p. 63
- ↑ Mazaheri O., Javad Kalbasi R.. "Preparation and characterization of Ni/mZSM-5 zeolite with a hierarchical pore structure by using KIT-6 as silica template: an efficient bi-functional catalyst for the reduction of nitro aromatic compounds". Organic Syntheses. doi:10.1039/C5RA02349A.
- ↑ Bavin, P. M. G. (1973). "2-Aminofluorene". Organic Syntheses. http://www.orgsyn.org/demo.aspx?prep=cv5p0030.; Collective Volume, vol. 5, p. 30
- ↑ Fox, B. A.; Threlfall, T. L. (1973). "2,3-Diaminopyridine". Organic Syntheses. http://www.orgsyn.org/demo.aspx?prep=cv5p0346.; Collective Volume, vol. 5, p. 346
- ↑ Redemann, C. T.; Redemann, C. E. (1955). "5-Amino-2,3-dihydro-1,4-phthalazinedione". Organic Syntheses. http://www.orgsyn.org/demo.aspx?prep=cv3p0069.; Collective Volume, vol. 3, p. 69
- ↑ Hartman, W. W.; Silloway, H. L. (1955). "2-Amino-4-nitrophenol". Organic Syntheses. http://www.orgsyn.org/demo.aspx?prep=cv3p0082.; Collective Volume, vol. 3, p. 82
- ↑ "Encyclopedia of Reagents for Organic Synthesis". Encyclopedia of Reagents for Organic Synthesis. (2005). DOI:10.1002/047084289X.rt112.pub2. ISBN 9780470842898.
- ↑ Basu, M. K. (2000). "Ultrasound-promoted highly efficient reduction of aromatic nitro compounds to the aromatic amines by samarium/ammonium chloride". Tetrahedron Lett. 41 (30): 5603. doi:10.1016/S0040-4039(00)00917-5.
- ↑ Kumar, J. S. Dileep; Ho, ManKit M.; Toyokuni, Tatsushi (2001). "Simple and chemoselective reduction of aromatic nitro compounds to aromatic amines: reduction with hydriodic acid revisited". Tetrahedron Letters 42 (33): 5601–5603. doi:10.1016/s0040-4039(01)01083-8.
- ↑ Ayyangar, N. R.; Brahme, K. C.; Kalkote, U. R.; Srinivasan, K. V. (1984). "Facile Transfer-Reduction of Nitroarenes to N Arylhydroxylamines with Hydrazine in the Presence of Raney Nickel". Synthesis 1984 (11): 938. doi:10.1055/s-1984-31027. https://archive.org/details/sim_synthesis_1984-11_11/page/938.
- ↑ Harman, R. E. (1963). "Chloro-p-benzoquinone". Organic Syntheses. http://www.orgsyn.org/demo.aspx?prep=cv4p0148.; Collective Volume, vol. 4, p. 148
- ↑ Kamm, O. (1941). "β-Phenylhydroxylamine". Organic Syntheses. http://www.orgsyn.org/demo.aspx?prep=cv1p0445.; Collective Volume, vol. 1, p. 445
- ↑ 26.0 26.1 Bigelow, H. E.; Robinson, D. B. (1955). "Azobenzene". Organic Syntheses. http://www.orgsyn.org/demo.aspx?prep=cv3p0103.; Collective Volume, vol. 3, p. 103
- ↑ R. F. Nystrom; W. G. Brown (1948). "Reduction of Organic Compounds by Lithium Aluminum Hydride. III. Halides, Quinones, Miscellaneous Nitrogen Compounds". J. Am. Chem. Soc. 70 (11): 3738–3740. doi:10.1021/ja01191a057. பப்மெட்:18102934.
- ↑ O.P.Tandon