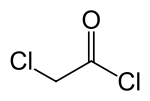
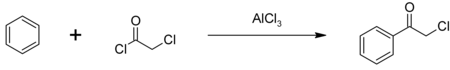குளோரோ அசிட்டைல் குளோரைடு
| |

| |
| பெயர்கள் | |
|---|---|
| விருப்பத்தெரிவு ஐயூபிஏசி பெயர்
குளோரோ அசிட்டைல் குளோரைடு | |
| வேறு பெயர்கள்
2-குளோரோ அசிட்டைல் குளோரைடு
குளோரோ அசிட்டிக் அமிலக்குளோரைடு குளோரோ அசிட்டிக் குளோரைடு மோனோகுளோரோ அசிட்டைல் குளோரைடு | |
| இனங்காட்டிகள் | |
| 79-04-9 | |
| ChemSpider | 13856283 |
| EC number | 201-171-6 |
InChI
| |
| யேமல் -3D படிமங்கள் | Image |
| KEGG | C14859 |
| பப்கெம் | 6577 |
SMILES
| |
| பண்புகள் | |
| C2H2Cl2O | |
| வாய்ப்பாட்டு எடை | 112.94 g·mol−1 |
| தோற்றம் | நிறமற்றும் மஞ்சளுமான நீர்மம் |
| அடர்த்தி | 1.42 கி/மி.லி |
| உருகுநிலை | −22 °C (−8 °F; 251 K) |
| கொதிநிலை | 106 °C (223 °F; 379 K) |
| வினைபுரியும் | |
| ஆவியமுக்கம் | 19 மி.மீ பாதரசம் (20°செ)[1] |
| தீங்குகள் | |
| பொருள் பாதுகாப்பு குறிப்பு தாள் | Oxford MSDS |
| ஈயூ வகைப்பாடு | |
| தீப்பற்றும் வெப்பநிலை | தீப்பற்றி எரியாது [1] |
| அமெரிக்க சுகாதார ஏற்பு வரம்புகள்: | |
அனுமதிக்கத்தக்க வரம்பு
|
none[1] |
பரிந்துரைக்கப்பட்ட வரம்பு
|
TWA 0.05 பகுதி/மில்லியன் (0.2 மி.கி/மீ3)[1] |
உடனடி அபாயம்
|
N.D.[1] |
மாறுதலாக ஏதும் சொல்லவில்லை என்றால் கொடுக்கப்பட்ட தரவுகள் யாவும் பொருள்கள் அவைகளின் இயல்பான வெப்ப அழுத்த நிலையில் (25°C, 100kPa) இருக்கும். | |
| | |
| Infobox references | |
குளோரோ அசிட்டைல் குளோரைடு (Chloroacetyl chloride) C2H2Cl2O என்ற வேதியியல் வாய்ப்பாடு கொண்ட ஒரு வேதிச் சேர்மம் ஆகும். குளோரினேற்றம் செய்யப்பட்ட அசைல் குளோரைடு வகைச் சேர்மமாக வகைப்படுத்தப்படும் இச்சேர்மம் இரு வினைக்குழு சேர்மமாகும். ஒரு பயனுள்ள கட்டுறுப்புத் தொகுதி வேதிப்பொருளாக குளோரோ அசிட்டைல் குளோரைடு பயன்படுத்தாப்படுகிறது.
தயாரிப்பு[தொகு]
மெத்திலீன் குளோரைடை கார்பனைலேற்றம் எனப்படும் கார்பனோராக்சைடு சேர்க்கும் வினை, வினைலிடின் குளோரைடு|வினைலிடின் குளோரைடை ஆக்சிசனேற்றம் செய்தல் அல்லது கீட்டீனுடன்[2] குளோரின் சேர்த்தல் போன்ற முறைகளில் தொழிற்சாலைகளில் குளோரோ அசிட்டைல் குளோரைடு தயாரிக்கப்படுகிறது. குளோரோ அசிட்டிக் அமிலமும் தயோனைல் குளோரைடு சேர்த்தும் அல்லது பாசுபரசு ஐங்குளோரைடும் பாசுசீன் சேர்த்தும் கூட இதைத் தயாரிக்க இயலும்.
வினைகள்[தொகு]
குளோரோ அசிட்டைல் குளோரைடு ஒர் இருவினைக்குழு சேர்மம் என்பதால் இந்த அசைல் குளோரைடு எளிதாக எசுத்தர்களாகவும், [3] அமைடுகளாகவும் உருவாகிறது. அதேவேளையில் இம்மூலக்கூறின் மறுமுனை அமீன்களுடன் சேர்ந்து வேறு இணைப்புகளாகவும் உருவாகிறது. குளோரோ அசிட்டைல் குளோரைடு பயன்படுத்தி இலிடோகெய்ன் சேர்மத்தைத் தயாரிக்கும் தொகுப்பு வினை இங்கு விளக்கப்பட்டுள்ளது:[4]
பயன்கள்[தொகு]
களைக்கொல்லிகளான ஆலாகுளோர் மற்றும் பியூட்டாகுளோர் தயாரித்தலின் போது ஓர் இடைநிலை வேதிப்பொருளாகப் பயன்படுவதுதான் குளோரோ அசிட்டைல் குளோரைடின் பிரதானமானதொரு பயனாகும். ஒரு ஆண்டுக்கு தோராயமாக நூறு மில்லியன் பவுண்டுகள் அளவிற்கு இது பயன்படுத்தப்படுகிறது. மற்றொரு வேதியியல் இடைநிலையும், கண்ணீர்ப்புகை வாயுமான பீனசைல் குளோரைடு தயாரிக்கவும் இதைப் பயன்படுத்துகிறார்கள். அலுமினியம் குளோரைடு வினையூக்கியின் உதவியால் பென்சீனை பிரைடல்-கிராப்ட்சு அசைலேற்றம் செய்து பீனசைல் குளோரைடு தயாரிக்கப்படுகிறது[2] Phenacyl chloride is synthesized in a Friedel-Crafts acylation of benzene, with an aluminium chloride catalyst:[5]
முன்பாதுகாப்பு[தொகு]
பிற அசைல் குளோரைடுகள் போலவே அமீன்கள், ஆல்ககால்கள் மற்றும் ஐதரோகுளோரிக் அமிலம் ஆகியன்வற்றுடன் சேரும் போது கண்ணிர்ப் புகையாக மாறுகிறது. அமெரிக்காவின் தொழில் பாதுகாப்பு மற்றும் சுகாதார நிர்வாக அமைப்பு இதைப் பயன்படுத்துவதற்கான எல்லைகள் எதையும் விதிக்கவில்லை என்றாலும் அந்நாட்டின் தொழில் பாதுகாப்பு மற்றும் சுகாதார தேசிய நிறுவனம், எட்டுமணி நேர வேலை நேரத்தில் 0.05 பகுதிகள்/மில்லியன் அளவு அனுமதிக்கத்தக்க அளவாக பரிந்துரைக்கிறது[6].
மேற்கோள்கள்[தொகு]
- ↑ 1.0 1.1 1.2 1.3 1.4 "NIOSH Pocket Guide to Chemical Hazards #0120". National Institute for Occupational Safety and Health (NIOSH).
- ↑ 2.0 2.1 Paul R. Worsham (1993). "15. Halogenated Derivatives" (Google Books excerpt). Acetic acid and its derivatives. New York: M. Dekker. பக். 288–298. பன்னாட்டுத் தரப்புத்தக எண்:0-8247-8792-7. https://books.google.com/books?id=3MjdGp1v1YIC&pg=RA2-PA288.
- ↑ Robert H. Baker and Frederick G. Bordwell (1955). "tert-Butyl acetate". Organic Syntheses. http://www.orgsyn.org/demo.aspx?prep=cv3p0141.; Collective Volume, vol. 3
- ↑ T. J. Reilly (1999). "The Preparation of Lidocaine". J. Chem. Ed. 76 (11): 1557. doi:10.1021/ed076p1557. http://jchemed.chem.wisc.edu/Journal/Issues/1999/Nov/abs1557.html. பார்த்த நாள்: 2016-10-13.
- ↑ Nathan Levin and Walter H. Hartung (1955). "ω-Chloroisonitrosoacetophenone". Organic Syntheses. http://www.orgsyn.org/demo.aspx?prep=cv3p0191.; Collective Volume, vol. 3, p. 191
- ↑ "NIOSH Pocket Guide to Chemical Hazards". Centers for Disease Control and Prevention. 2011.