ருத்தேனியம்(IV) ஆக்சைடு
| |
| பெயர்கள் | |
|---|---|
| ஐயூபிஏசி பெயர்
ருத்தேனியம்(IV) ஆக்சைடு
| |
| வேறு பெயர்கள்
ருத்தேனியம் டையாக்சைடு
| |
| இனங்காட்டிகள் | |
| 12036-10-1 | |
| EC number | 234-840-6 |
InChI
| |
| யேமல் -3D படிமங்கள் | Image |
| பப்கெம் | 82848 |
SMILES
| |
| பண்புகள் | |
| RuO2 | |
| வாய்ப்பாட்டு எடை | 133.0688 கி/மோல் |
| தோற்றம் | நீலம்-கருப்பு திண்மம் |
| அடர்த்தி | 6.97 கி/செ,மீ3 |
| கொதிநிலை | 1,200 °C (2,190 °F; 1,470 K) பதங்கமாகும் |
| கரையாது | |
| +162.0•10−6செ.மீ3/மோல் | |
| கட்டமைப்பு | |
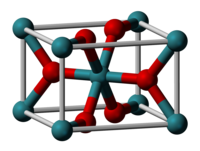
| படிக அமைப்பு | உரூட்டைல் நாற்கோணம், tP6 |
| புறவெளித் தொகுதி | P42/mnm, No. 136 |
| ஒருங்கிணைவு வடிவியல் |
எண்முகம் (RuIV); முக்கோண சமதளம் (O2−) |
| தீங்குகள் | |
| தீப்பற்றும் வெப்பநிலை | தீப்பற்றாது |
| தொடர்புடைய சேர்மங்கள் | |
| ஏனைய எதிர் மின்னயனிகள் | ருத்தேனியம் டைசல்பைடு |
| ஏனைய நேர் மின்அயனிகள் | ஒசுமியம்(IV) ஆக்சைடு |
மாறுதலாக ஏதும் சொல்லவில்லை என்றால் கொடுக்கப்பட்ட தரவுகள் யாவும் பொருள்கள் அவைகளின் இயல்பான வெப்ப அழுத்த நிலையில் (25°C, 100kPa) இருக்கும். | |
| | |
| Infobox references | |
ருத்தேனியம்(IV) ஆக்சைடு (Ruthenium(IV) oxide) என்பது RuO2 என்ற மூலக்கூற்று வாய்ப்பாட்டால் விவரிக்கப்படும் ஒரு கனிம வேதியியல் சேர்மமாகும். ருத்தேனியம் தனிமத்தின் மிகப் பொதுவான ஆக்சைடுகளில் ருத்தேனியம்(IV) ஆக்சைடும் ஒன்றாகும். இது கருப்பு நிறத்தில் ஒரு திண்மமாக கானப்படுகிறது. குளோரின் மற்றும் குளோரின் ஆக்சைடுகளை தயாரிக்க உதவும் மின் வினையூக்கியாக ருத்தேனியம்(IV) ஆக்சைடு பரவலாகப் பயன்படுகிறது. பல டையாக்சைடுகளைப் போல ருத்தேனியம்(IV) ஆக்சைடு உரூட்டைல் கட்டமைப்பை ஏற்றுக் கொள்கிறது.ருத்தேனியம் டையாக்சைடு என்ற பெயராலும் அழைக்கப்படுகிறது.
தயாரிப்பு[தொகு]
ருத்தேனியம் டிரை குளோரைடு சேர்மத்தை ஆக்சிசனேற்றம் செய்து ருத்தேனியம்(IV) ஆக்சைடு தயாரிக்கலாம். கிட்டத்தட்ட விகிதவியல் அளவுகளில் ருபீடியம் ஆக்சைடு (RuO2) ஒற்றை படிகங்கள் உருவாகின்றன. கடத்தும் முகவராக ஆக்சிசன் செயற்பட்டு வேதியியல் ஆவி போக்குவரத்து முறையில் மேற்கண்ட ஒற்றைப் படிகங்கள் கிடைக்கும்[1] மின்னியல் ரீதியாக உறுதிப்படுத்தப்பட்ட ருத்தேனியம் டையாக்சைடு நீரேற்றின் திரவக்கூழை ருத்தேனியம் டெட்ராக்சைட்டின் தன்னியக்கக் குறைத்தல் வினையை பயன்படுத்துவதன் மூலம் தயாரிக்கலாம். இவ்வினையில் உருவாகும் விளைபொருள் துகள்களை 40 நானோ மீட்டர் – 160 நானோ மீட்டர் விட்டம் அளவுள்ள சீரான கோளங்களை உள்ளடக்கியதாக கட்டுப்படுத்தலாம்.[2]
ருத்தேனியம் டையாக்சைடு 1200 பாகை செல்சியசு வெப்பநிலையில் கொதிக்கிறது. இது எளிதில் தீப்பற்றாது. நீரில் கரையாது. கொதிநிலை வெப்பநிலையில் இது பதங்கமாகிறது.
பயன்கள்[தொகு]
ஐதரசன் குளோரைடை ஆக்சிசனேற்றம் செய்து குளோரின் உற்பத்தி செய்யும் சுமிட்டோமோ- டீக்கன் செயல்முறையின் வினையூக்கியில் ருத்தேனியம்(IV) ஆக்சைடு முக்கிய அங்கமாக பயன்படுத்தப்படுகிறது [3][4]. RuO 2 சேர்மத்தை பல சூழ்நிலைகளில் வினையூக்கியாகப் பயன்படுத்தலாம். கார்பன் மோனாக்சைடும் ஐதரசனும் சேர்ந்த கலவையை நீர்ம ஐதரோகார்பனாக மாற்றும் பிசர்-டிராப்சு செயல்முறை, ஏபர்-போசுச் செயல்முறை மற்றும் பல்வேறு எரிபொருள் கலங்களின் மின்வாய்கள் போன்றவை சில குறிப்பிடத்தக்க வினைகள்.ஆகும்.
கண்ணாடி, ஒளியியல் கருவிகள், பீங்கான் போன்ற பயன்பாடுகளுக்கு ருத்தேனியம்(IV) ஆக்சைடின் கரையாத தன்மையும் வெப்ப இயங்கியல் ரீதியாக உயர் நிலைப்புத் தன்மையுடன் இருக்கும் பண்பும் மிகுந்த பயனளிக்கின்றன. நீரிய அமிலங்களில் மின்சுமையை நன்றாக சேமித்து வைக்கும் தன்மையை பெற்றுள்ளது. ஆக்சைடு உப்புகள் பொதுவாக மின்சாரத்தை கடத்தாது. இருப்பினும் சில பெரோவ்சிகைட்டு கட்டமைப்பிலுள்ள ஆக்சைடுகள் திண்ம ஆக்சைடு எரிபொருள் கலன்களின் எதிர்மின் முனைகளிலும், ஆக்சிசன் உற்பத்தி திட்டங்களிலும் பயன்படுகின்றன.
சாத்தியமான மற்றும் முக்கிய பயன்பாடுகள்[தொகு]
குளோரினின் மின்னாற்பகுப்பு முறை உற்பத்திக்காக பயன்படும் தைட்டானியம் நேர்மின்முனையில் பூசி ஒருங்கிணைந்த மின் சுற்றுகள் தயாரிக்க ருத்தேனியம்(IV) ஆக்சைடு விரிவாகப் பயன்படுத்தப்படுகிறது.[5][6]. ருத்தேனியம் ஆக்சைடு மின்தடைகளை 02 < வெப்பம் < 4 கெல்வின். வெப்பநிலை வரம்பில் உணர்திறன் வெப்பநிலை மானிகளாகப் பயன்படுத்தலாம். மீமின்தேக்கிகளில் தீவிர செயலில் உள்ள பொருளாகவும் பயன்படுத்தப்படலாம், ஏனெனில் இது மிக அதிக மின்சுமை பரிமாற்ற திறன் கொண்டுள்ளதாக உள்ளது. .ருத்தேனியம் ஆக்சைடு நீரிய நிலைக் கரைசல்களில் பயன்படுத்தப்படும்போது மின்சுமையை சேமிக்கும் திறனைக் கொண்டுள்ளது.[7]. கந்தக அமிலத்தில் 200 பாகை செல்சியசு வெப்பநிலைக்கு குறைவான வெப்பநிலையில் ருத்தேனியம் (IV) ஆக்சைடின் சராசரி மின்திறன் 650 ஐ எட்டியுள்ளது இதன் கொள்ளளவு பண்புகளை மேம்படுத்துவதற்கான முயற்சிகளில், முன் தயாரிப்பு வேலைகளாக ருத்தேனியம் ஆக்சைடின் நீரேற்றம், அதன் படிகத்தன்மை மற்றும் துகள் அளவு ஆகியன சோதிக்கப்பட்டது..
மேற்கோள்கள்[தொகு]
- ↑ Harald Schäfer, Gerd Schneidereit, Wilfried Gerhardt "Zur Chemie der Platinmetalle. RuO2 Chemischer Transport, Eigenschaften, thermischer Zerfall" Z. anorg. allg. Chem. 1963, 319, 327-336. எஆசு:10.1002/zaac.19633190514
- ↑ McMurray, H. N. (1993). "Uniform colloids of ruthenium dioxide hydrate evolved by the surface-catalyzed reduction of ruthenium tetroxide". The Journal of Physical Chemistry 97 (30): 8039–8045. doi:10.1021/j100132a038.
- ↑ Helmut Vogt, Jan Balej, John E. Bennett, Peter Wintzer, Saeed Akbar Sheikh, Patrizio Gallone "Chlorine Oxides and Chlorine Oxygen Acids" in Ullmann's Encyclopedia of Industrial Chemistry 2002, Wiley-VCH. எஆசு:10.1002/14356007.a06_483
- ↑ Seki, K; Catal. Surv. Asia, 2010, 14, 168 எஆசு:10.1007/s10563-010-9091-7.
- ↑ De Nora, O.; Chem. Eng. Techn., 1970, 42, 222.
- ↑ Iles, G.S.; Platinum Met. Rev., 1967,11,126.
- ↑ Matthey, Johnson. Platinum Metals Review பரணிடப்பட்டது 2015-09-24 at the வந்தவழி இயந்திரம். 2002, 46, 3, 105

