நீரின் தன்னயனாக்கல்
| காடிகளும் காரங்களும் |
|---|
 |
| காடியின் வகைகள் |
| கார வகைகள் |
நீர் மூலக்கூறு தனது தூய வடிவிலோ அல்லது கரைசலொன்றிலோ ஒரு ஐதரசன் அணுவின் கருவை இழந்து ஐதரொக்சைட்டு அயனை (OH-)உருவாக்கல் நீரின் தன்னயனாக்கல் எனப்படும். இழக்கப்பட்ட ஐதரசன் அயன் (H+) வேறொரு நீர் மூலக்கூறொன்றுடன் இணைந்து ஐதரோனியம் அயனை (H3O+)உருவாக்கும். நீரின் இத்தன்னயனாக்கல் இயல்பு நீரின் ஈரியல்பைக் காட்டுகின்றது.
சமநிலை மாறிலி[தொகு]
தூய நீர் மிகவும் குறைவாகவே மின்னைக் கடத்தும். இவ்வளவு 0.055 µS∙cm−1 என கணிப்பிடப்பட்டுள்ளது. இவ்வளவு நீரின் தன்னயனாக்கத்தால் உருவாகும் அயன்களாலேயே என்க் கருதப்படுகின்றது.
- H2O + H2O
 H3O+ + OH−
H3O+ + OH−
அயன்களின் செறிவின் அடிப்படையில் மேற்படி தாக்கத்துக்கான சமநிலை மாறிலி பின்வருமாறு வழங்கப்படும்.
நீரின் அயனாக்கல் மாறிலியை (Kw) நீரிலுள்ள அயன்களின் செறிவையும் சமநிலை மாறிலியையும் கொண்டு கணிக்கலாம்.
இதில் [H3O+] என்பது ஐதரோனியம் அயனின் செறிவையும், [OH−] என்பது ஐதரொக்சைட்டு அயனின் செறிவையும் குறிக்கின்றது.
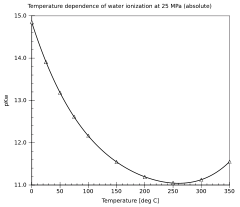
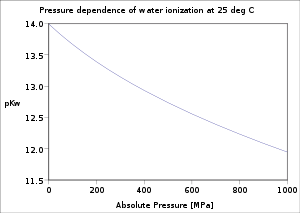
25 °C வெப்பநிலையில் Kwஇன் அளவு 1.0×10−14 ஆகக் காணப்படும். இவ்வளவீட்டைக் கொண்டு நீரின் தன்னயனாக்கல் தூய நீரில் மிக அரிதாகவே நிகழ்கின்றதென அறிந்து கொள்ளலாம்.


![{\displaystyle K_{\rm {eq}}={\frac {[{\rm {H_{3}O^{+}}}][{\rm {OH^{-}}}]}{[{\rm {H_{2}O}}]^{2}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/22a8003c433e7b859645f29a00432bf07d1c3919)
![{\displaystyle K_{\rm {w}}=[{\rm {H_{3}O^{+}}}][{\rm {OH^{-}}}]=K_{\rm {eq}}\cdot [{\rm {H_{2}O}}]^{2}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/8d7fb570b45de6771131a93a76a9448b2ba852fe)