தாமிரம்(II) ஐதராக்சைடு

| |
| |
| பெயர்கள் | |
|---|---|
| ஐயூபிஏசி பெயர்
தாமிரம்(II) ஐதராக்சைடு
| |
| வேறு பெயர்கள்
Cupric hydroxide
| |
| இனங்காட்டிகள் | |
| 20427-59-2 | |
| ChemSpider | 144498 |
| யேமல் -3D படிமங்கள் | Image |
| KEGG | C18712 |
| பப்கெம் | 164826 |
SMILES
| |
| UNII | 3314XO9W9A |
| பண்புகள் | |
| Cu(OH)2 | |
| வாய்ப்பாட்டு எடை | 97.561 g/mol |
| தோற்றம் | Blue or blue-green solid |
| அடர்த்தி | 3.368 g/cm3, solid |
| உருகுநிலை | 80 °C (176 °F; 353 K) (decomposes into CuO) |
| negligible | |
கரைதிறன் பெருக்கம் (Ksp)
|
2.20 x 10−20[1] |
| கரைதிறன் | insoluble in ethanol; soluble in NH4OH, KCN |
| +1170.0·10−6 cm3/mol | |
| வெப்பவேதியியல் | |
| Std enthalpy of formation ΔfH |
−450 kJ·mol−1 |
| நியம மோலார் எந்திரோப்பி S |
108 J·mol−1·K−1 |
| தீங்குகள் | |
| முதன்மையான தீநிகழ்தகவுகள் | Skin, Eye, & Respiratory Irritant |
| பொருள் பாதுகாப்பு குறிப்பு தாள் | http://www.sciencelab.com/xMSDS-Cupric_Hydroxide-9923594 |
| தீப்பற்றும் வெப்பநிலை | Non-flammable |
| Lethal dose or concentration (LD, LC): | |
LD50 (Median dose)
|
1000 mg/kg (oral, rat) |
| அமெரிக்க சுகாதார ஏற்பு வரம்புகள்: | |
அனுமதிக்கத்தக்க வரம்பு
|
TWA 1 mg/m3 (as Cu)[2] |
பரிந்துரைக்கப்பட்ட வரம்பு
|
TWA 1 mg/m3 (as Cu)[2] |
உடனடி அபாயம்
|
TWA 100 mg/m3 (as Cu)[2] |
| தொடர்புடைய சேர்மங்கள் | |
| ஏனைய எதிர் மின்னயனிகள் | Copper(II) oxide Copper(II) carbonate Copper(II) sulfate Copper(II) chloride |
| ஏனைய நேர் மின்அயனிகள் | Nickel(II) hydroxide Zinc hydroxide Iron(II) hydroxide Cobalt hydroxide |
மாறுதலாக ஏதும் சொல்லவில்லை என்றால் கொடுக்கப்பட்ட தரவுகள் யாவும் பொருள்கள் அவைகளின் இயல்பான வெப்ப அழுத்த நிலையில் (25°C, 100kPa) இருக்கும். | |
| | |
| Infobox references | |
காப்பர்(II) ஐதாராக்சைடு என்பது ஐதராக்சைடு மற்றும் தாமிரம் சேர்ந்தது இதன் மூலக்கூறு வாய்பாடு Cu(OH)2உள்ளது. இது ஒரு வெளிர் நீலநிறத் திண்மம். தாமிர(II) கார்பனேட்டு மற்றும் ஐதராக்சைடு சேரந்த கலவை வலிமையான தாமிர ஐதராக்சைடாக விற்கப்படுகிறது.தாமிர ஐதராக்சைடு ஒரு வலிமை குறைந்த காரம்.
அமைப்பு[தொகு]
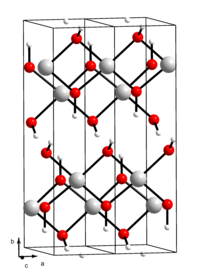
Cu(OH)2 ன் அமைப்பு X- கதிர் படிகத்தினால் தீர்மானிக்கப்பட்டுள்ளது. தாமிரம் மையத்தில சதுர சாய்தளக்கோபுர அமைப்பில் உள்ளது. தளத்தில் இருந்து நான்கு Cu-O களும் 1.96 Å, தூரத்திலும் மற்றும் அச்சில் இருந்து 2.36 Å தூரத்திலும் உள்ளன. தளத்தில் ஐதராக்சைடு ஈந்தணைவி இரட்டை அல்லது முப்பிணைப்பில் இணைக்கப்படுகிறது.[3]
வினைகள்[தொகு]
சுமார் 100 °C இது நிலையானது.
தாமிர(II) ஹைட்ராக்சைடு அம்மோனியா கரைசலுடன் வினைபுரிந்து அடர்நீல நிற டெட்ராஅம்மைன்தாமிர அயனிகளைத் [Cu(NH3)4]2+ தருகிறது. டைஆக்சிசன் முன்னிலையில் அம்மோனியா கரைசலுடன் வினைவேகமாற்ற ஆக்சிசனேற்றம் அடைந்து தாமிர அம்மைன் நைட்ரைடுகளைத்Cu(2)2( NH3)n [4][5] தருகிறது.
தாமிரம்(II) ஐதராக்சைடு சிறிதளவு ஈரியல்பு தன்மை உடையது. செறிவுமிக்க காரங்களில் சிறிதளவு கரைந்து [Cu(OH)4]2− தருகின்றன.[6]
மேற்கோள்கள்[தொகு]
- ↑ Pradyot Patnaik. Handbook of Inorganic Chemicals. McGraw-Hill, 2002, ISBN 0-07-049439-8
- ↑ 2.0 2.1 2.2 "NIOSH Pocket Guide to Chemical Hazards #0150". National Institute for Occupational Safety and Health (NIOSH).
- ↑ H. R. Oswald, A. Reller, H. W. Schmalle, E. Dubler (1990). "Structure of Copper(II) Hydroxide, Cu(OH)2". Acta Cryst. C46: 2279–2284. doi:10.1107/S0108270190006230.
- ↑ Y. Cudennec (1995). "Etude cinétique de l'oxydation de l'ammoniac en présence d'ions cuivriques". Comptes Rendus Académie Sciences Paris, série II,Méca; phys. chim. astron. 320 (6): 309–316.
- ↑ Y. Cudennec (1993). "Synthesis and study of Cu(NO2)2(NH3)4 and Cu(NO2)2(NH3)2". European journal of solid state and inorganic chemistry 30 (1-2): 77–85.
- ↑ Pauling, Linus (1970).
வெளி இணைப்புகள்[தொகு]
- பொருள் பாதுகாப்பு தரவு தாள் பரணிடப்பட்டது 2016-03-03 at the வந்தவழி இயந்திரம்
