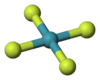
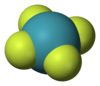
செனான் நான்குபுளோரைடு

| |||
| |||
| பெயர்கள் | |||
|---|---|---|---|
| ஐயூபிஏசி பெயர்
செனான் டெட்ராபுளோரைடு
| |||
| இனங்காட்டிகள் | |||
| 13709-61-0 | |||
| ChemSpider | 109927 | ||
| யேமல் -3D படிமங்கள் | Image | ||
| பப்கெம் | 123324 | ||
SMILES
| |||
| பண்புகள் | |||
| XeF 4 | |||
| வாய்ப்பாட்டு எடை | 207.2836 கி மோல்l−1 | ||
| தோற்றம் | வெண் படிகம் | ||
| அடர்த்தி | 4.040 g cm−3, solid | ||
| உருகுநிலை | 117 °C (243 °F; 390 K) sublimates[1] | ||
| வினைபுரியும் | |||
| கட்டமைப்பு | |||
| ஒருங்கிணைவு வடிவியல் |
D4h | ||
| மூலக்கூறு வடிவம் | |||
| இருமுனைத் திருப்புமை (Dipole moment) | 0 D | ||
| வெப்பவேதியியல் | |||
| Std enthalpy of formation ΔfH |
−251 kJ·mol−1[2] | ||
| நியம மோலார் எந்திரோப்பி S |
146 J·mol−1·K−1[2] | ||
மாறுதலாக ஏதும் சொல்லவில்லை என்றால் கொடுக்கப்பட்ட தரவுகள் யாவும் பொருள்கள் அவைகளின் இயல்பான வெப்ப அழுத்த நிலையில் (25°C, 100kPa) இருக்கும். | |||
| | |||
| Infobox references | |||
செனான் டெட்ராபுளோரைடு (Xenon tetrafluoride) என்பது முதன்முதலில் கண்டறியப்பட்ட மந்த வாயுக்களின் இருமூலக்கூறு வேதிச் சேர்மமாகும்.[3] இதனுடைய மூலக்கூறு வாய்பாடு XeF
4 என்பதாகும். செனானும் புளோரினும் (F
2) வேதி வினை புரிந்து செனான் டெட்ராபுளோரைடு உருவாகிறது. இவ்வினைக்கான வேதியியற் சமன்பாடு கீழே தரப்பட்டுள்ளது:[4][5]
- Xe + 2 F
2 → XeF
4
வெப்பம் உமிழ் வினையான இவ்வினையில் 251 கிஜூ/மோல் ஆற்றல் வெளிவிடப்படுகிறது.[3]
சாதராண நிலையில் செனான் டெட்ராபுளோரைடு நிறமற்ற படிகமாகக் காணப்படுகிறது. 1963 ஆம் ஆண்டில் நடைபெற்ற அணுக்கருக் காந்த ஒத்ததிர்வு நிறமாலையியல், படிகங்களின் அணு மற்றும் மூலக்கூறு அமைப்பை அறிய உதவும் எக்சு-கதிர் படிகவியல் ஆய்வுகள் மூலமாக இதனுடைய படிகவடிவம் கண்டறியப்பட்டது.[6][7] இதனுடைய சதுரச் சமதள மூலக்கூறு அமைப்பில் மூலக்கூறின் சமதளத்திற்கு மேலும் கீழுமாக தனித்த இலத்திரன் இரட்டைகள் காணப்படுகின்றன. நியூட்ரான் விளிம்பு வளைவு அறிவியல் மற்றும் வலுவளவு ஓட்டு இலத்திரன் சோடிகளின் தள்ளுகைக் கொள்கை ஆகியன இவ்வமைப்பிற்கு வலுசேர்த்து தெளிவுபடுத்துகின்றன.[8]
செனான் டெட்ராபுளோரைடு 115.7°செ வெப்பநிலையில் (240.26 °ப) பதங்கமாகிறது.
செனானின் பிற புளோரைடுகள் போலவே செனான் டெட்ரா புளோரைடும் ஆற்றல் உமிழும் வினையை வெளிப்படுத்துகிறது. சாதாரண வெப்பநிலையில் வெப்பம் மற்றும் அழுத்தப் பண்புகளில் நிலைப்புத்தன்மை பெற்றுள்ளது. செனானின் அனைத்து புளோரைடுகளும் நீருடன் உடனடியாக வினைபுரிந்து தூய்மையான செனான் வாயு, ஐதரசன் புளோரைடு மற்றும் மூலக்கூறு ஆக்சிசன் ஆகியனவற்றை வெளிவிடுகின்றன. சற்று ஈரமான காற்றிலேயே இவ்வினை நிகழும் என்பதால் அனைத்து செனான் புளோரைடுகளும் ஈரமில்லாச் சூழலில் பாதுகாக்கப்பட வேண்டும்.
தொகுப்பு முறை தயாரிப்பு[தொகு]
ஒரு நிக்கல் கொள்கலனில் செனான் மற்றும் புளோரின் வாயுக்களின் 1 : 3 விகித கலவை எடுத்துக்கொள்ளப்பட்டு அதை 400 பாகை செல்சியசு வெப்பநிலை அளவிற்குச் சூடாக்கும்போது செனான் டெட்ரா புளோரைடு உருவாகிறது. இதனுடன் சிறிதளவு செனான் எக்சா புளோரைடும் (XeF6 ) உருவாகிறது. உள்ளிடும் கலவையில் சேர்க்கப்படும் புளோரினின் அளவை அதிகரித்துக் கொள்வதின் மூலமாக இச்சேர்மத்தின் உற்பத்தியை மேலும் அதிகரித்துக் கொள்ள முடியும்[9]. இவ்வினையில் நிக்கல் ஒரு வினையூக்கி அல்ல என்றாலும் அது புளோரினுடன் வினைபுரிந்து பாத்திரத்தின் உட்புறத்தில் நிக்கல் புளோரைடு ( NiF2 ) என்ற உரித்து பிரிக்கமுடியாத பாதுகாப்புப் படலத்தை உருவாக்குகிறது. நிக்கல் கொள்கலன் இவ்வினையில் பயன்படுத்தப்படுவதற்கு இதுவே காரணமாகும்.
வேதி வினைகள்[தொகு]
தாழ்வான வெப்பநிலைகளில் செனான் டெட்ரா புளோரைடு நீராற்பகுப்பு அடைகிறது. இவ்வினையில் செனான், ஆக்சிசன், ஐதரோ புளோரிக் அமிலம் மற்றும் நீரிய செனான் டிரைஆக்சைடு ஆகியன உருவாகின்றன[10].
டெட்ராமீத்தைல் அம்மோனியம் புளோரைடுடன் செனான் டெட்ரா புளோரைடு வினைபுரிந்து டெட்ராமீத்தைல் அம்மோனியம் பெண்டா புளோரோ ஆக்சனேட்டு உருவாகிறது. இச்சேர்மம் XeF5- என்ற ஐங்கோண எதிர்மின் அயனிகளைக் கொண்டுள்ளது. இந்த எதிர்மின் அயனிகளை சீசியம் புளோரைடுடன் வினைப்படுத்தியும் பெறமுடியும்:[11]
- CsF + XeF
4 → CsXeF
5.
பிசுமத் பெண்டாபுளோரைடுடன் (BiF5) இது வினைபுரிந்து XeF+3 என்ற நேர்மின் அயனியாக உருவாகிறது.[12]
- BiF
5 + XeF
4 → XeF3BiF6
XeF3Sb2F11 என்ற உப்பிலும் இந்த நேர்மின் அயனி காணப்படுவதாக அணுக்கருக் காந்த ஒத்ததிர்வு நிறமாலையியல் ஆய்வு தெரிவிக்கிறது.[13]
400 பாகை செல்சியசு வெப்பநிலையில் செனான் டெட்ரா புளோரைடு செனான் வாயுவுடன் வினைபுரிந்து செனான் டைபுளோரைடு (XeF2) உண்டாகிறது.XeF
2:[9]
- XeF4 + Xe → 2 XeF2
செனான் டெட்ரா புளோரைடு பிளாட்டினத்துடன் வினைபுரிந்து பிளாட்டினம் டெட்ராபுளோரைடு (PtF4) உருவாகிறது.:[9]
- XeF4 + Pt → PtF4 + Xe
பயன்கள்[தொகு]
சிலிகான் இரப்பரில் உள்ள உலோக அசுத்தங்களை ஆராய்வதற்கான ஒரு சிதைவு முகவராக செனான் டெட்ரா புளோரைடு பயன்படுத்தப்படுகிறது. செனான் டெட்ரா புளோரைடு சிலிகான் அமைப்புடன் வினைபுரிந்து இறுதியாக உலோக அசுத்தங்களை வெளியேற்றிவிட்டு எளிமையான வாயுப்பொருட்களைத் தருகிற்து [14].
மேற்கோள்கள்[தொகு]
- ↑ Arnold F. Holleman; Egon Wiberg (2001). Nils Wiberg. ed. Inorganic chemistry. translated by Mary Eagleson, William Brewer. Academic Press. பக். 394. பன்னாட்டுத் தரப்புத்தக எண்:0-12-352651-5.
- ↑ 2.0 2.1 Zumdahl, Steven S. (2009). Chemical Principles 6th Ed.. Houghton Mifflin Company. பக். A23. பன்னாட்டுத் தரப்புத்தக எண்:0-618-94690-X. https://archive.org/details/chemicalprincipl0000zumd_u9g0.
- ↑ 3.0 3.1 Zumdahl (2007). Chemistry. Boston: Houghton Mifflin. பக். 243. பன்னாட்டுத் தரப்புத்தக எண்:0-618-52844-X. https://archive.org/details/completesolution00stev.
- ↑ Claassen, H. H.; Selig, H.; Malm, J. G. (1962). "Xenon Tetrafluoride". J. Am. Chem. Soc. 84 (18): 3593. doi:10.1021/ja00877a042.
- ↑ C. L. Chernick, H. H. Claassen, P. R. Fields 1, H. H. Hyman, J. G. Malm, W. M. Manning, M. S. Matheson, L. A. Quarterman, F. Schreiner, H. H. Selig, I. Sheft, S. Siegel, E. N. Sloth, L. Stein, M. H. Studier, J. L. Weeks, and M. H. Zirin (1962). "Fluorine Compounds of Xenon and Radon". Science 138 (3537): 136–138. doi:10.1126/science.138.3537.136. பப்மெட்:17818399. Bibcode: 1962Sci...138..136C.
- ↑ Thomas H. Brown, E. B. Whipple, and Peter H. Verdier (1963). "Xenon Tetrafluoride: Fluorine-19 High-Resolution Magnetic Resonance Spectrum". Science 140 (3563): 178. doi:10.1126/science.140.3563.178. பப்மெட்:17819836. Bibcode: 1963Sci...140..178B.
- ↑ James A. Ibers and Walter C. Hamilton (1963). "Xenon Tetrafluoride: Crystal Structure". Science 139 (3550): 106–107. doi:10.1126/science.139.3550.106. பப்மெட்:17798707. Bibcode: 1963Sci...139..106I.
- ↑ Burns, John H.; Agron, P. A.; Levy, Henri A (1963). "Xenon Tetrafluoride Molecule and Its Thermal Motion: A Neutron Diffraction Study". Science 139 (3560): 1208–1209. doi:10.1126/science.139.3560.1208. பப்மெட்:17757912. Bibcode: 1963Sci...139.1208B.
- ↑ 9.0 9.1 9.2 Allen J. Bard; Roger Parsons; Joseph Jordan; International Union of Pure and Applied Chemistry (1985). Standard Potentials in Aqueous Solution. CRC Press. பக். 767–768. பன்னாட்டுத் தரப்புத்தக எண்:0-8247-7291-1. https://archive.org/details/standardpotentia0000unse.
- ↑ எஆசு:10.1126/science.139.3559.1046
This citation will be automatically completed in the next few minutes. You can jump the queue or expand by hand - ↑ Charlie Harding; David Arthur Johnson; Rob Janes (2002). Elements of the p block (Volume 9 of Molecular world). Royal Society of Chemistry. பக். 93. பன்னாட்டுத் தரப்புத்தக எண்:0-85404-690-9. https://archive.org/details/elementsofpblock0000unse.
- ↑ Hitomi Suzuki; Yoshihiro Matano (2001). Organobismuth chemistry. Elsevier. பக். 8. பன்னாட்டுத் தரப்புத்தக எண்:0-444-20528-4.
- ↑ எஆசு:10.1039/C29710001543
This citation will be automatically completed in the next few minutes. You can jump the queue or expand by hand - ↑ எஆசு:10.1016/S0003-2670(96)00563-6
This citation will be automatically completed in the next few minutes. You can jump the queue or expand by hand