அலோகம்: திருத்தங்களுக்கு இடையிலான வேறுபாடு
No edit summary |
சி {{mergeto|அலோகம்}} |
||
| வரிசை 1: | வரிசை 1: | ||
{{mergeto|அலோகம்}} |
|||
[[File:Periodic table (polyatomic).svg|thumb|right|350px|தனிம வரிசை அட்டவணையில் அலோகங்கள்:<br/>{{legend|{{Element color|polyatomic nonmetal}}|[[#polyatomic nonmetal|பலவணு அலோகங்கள்]]}}{{legend|{{Element color|diatomic nonmetal}}|[[#Diatomic nonmetals|ஈரணு அலோகங்கள்]]}}{{legend|{{Element color|Noble gas}}|[[#Noble gases|மந்த வாயுக்கள்]]}} அட்டவணையில் [[ஐதரசன்]] தவிர மற்ற அலோகங்கள், [[p-தொகுதி]] யில் அடுக்கப்பட்டுள்ளன. [[ஹீலியம்]], s-தொகுதி தனிமம் பொதுவாக மந்த வாயுக்களுக்கான பண்புகளைப் பெற்றிருப்பதால் [[நியான்| நியானுக்கு மேலாக ( p-தொகுதி) வைக்கப்பட்டுள்ளது]].]] |
[[File:Periodic table (polyatomic).svg|thumb|right|350px|தனிம வரிசை அட்டவணையில் அலோகங்கள்:<br/>{{legend|{{Element color|polyatomic nonmetal}}|[[#polyatomic nonmetal|பலவணு அலோகங்கள்]]}}{{legend|{{Element color|diatomic nonmetal}}|[[#Diatomic nonmetals|ஈரணு அலோகங்கள்]]}}{{legend|{{Element color|Noble gas}}|[[#Noble gases|மந்த வாயுக்கள்]]}} அட்டவணையில் [[ஐதரசன்]] தவிர மற்ற அலோகங்கள், [[p-தொகுதி]] யில் அடுக்கப்பட்டுள்ளன. [[ஹீலியம்]], s-தொகுதி தனிமம் பொதுவாக மந்த வாயுக்களுக்கான பண்புகளைப் பெற்றிருப்பதால் [[நியான்| நியானுக்கு மேலாக ( p-தொகுதி) வைக்கப்பட்டுள்ளது]].]] |
||
08:34, 30 ஆகத்து 2014 இல் நிலவும் திருத்தம்
இக்கட்டுரை அல்லது கட்டுரைப்பகுதி அலோகம் கட்டுரையுடன் ஒன்றிணைக்கப் பரிந்துரைக்கப்படுகிறது. (கலந்துரையாடவும்) |
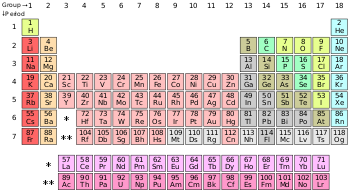
அட்டவணையில் ஐதரசன் தவிர மற்ற அலோகங்கள், p-தொகுதி யில் அடுக்கப்பட்டுள்ளன. ஹீலியம், s-தொகுதி தனிமம் பொதுவாக மந்த வாயுக்களுக்கான பண்புகளைப் பெற்றிருப்பதால் நியானுக்கு மேலாக ( p-தொகுதி) வைக்கப்பட்டுள்ளது.
உலோகப் பண்புகளை பெற்றிருக்காத வேதியியல் தனிமங்கள் அலோகங்கள் என்று அழைக்கப்படுகின்றன. அலோகங்கள் எளிதில் ஆவியாகக் கூடியனவாகவும், வெப்பத்தையும் மின்சாரத்தையும் எளிதில் கடத்தாத காப்புப் பொருட்களாகவும், குறைவான நெகிழ்வுத் தன்மை கொண்டவையாகவும் காணப்படுகின்றன.வேதியியல் பண்புகளின் அடிப்படையில் இவை அதிக அயனியாக்கும் ஆற்றல் மற்றும் எலக்ட்ரான் கவர் ஆற்றல் மதிப்புகளைக் கொண்டுள்ளன. அலோகங்கள் மற்ற தனிமங்கள் அல்லது சேர்மங்களுடன் வினைபுரியும் போது எலக்ட்ரான்களைப் பெற அல்லது பகிர்ந்து கொள்ள முனைகின்றன.
17 தனிமங்கள் பொதுவாக அலோகங்களாக வகைப் படுத்தப்பட்டுள்ளன. இவற்றுள் பெரும்பாலானவை வாயுக்கள். ( ஐதரசன், ஹீலியம், நைட்ரசன், ஆக்சிசன், புளுரின் ,நியான், குளோரின், ஆர்கான், கிரிப்டான், செனான் மற்றும் ரேடான் ) புரோமின் மட்டும் திரவநிலையில் உள்ளது. கார்பன், பாஸ்பரஸ், கந்தகம், செலினியம் மற்றும் அயோடின் போன்ற வெகுசில தனிமங்கள் திடநிலையில் காணப்படுகின்றன.
