கந்தக மோனாக்சைடு
| |||

| |||
| பெயர்கள் | |||
|---|---|---|---|
| முறையான ஐயூபிஏசி பெயர்
ஆக்சிடோகந்தகம்[1] | |||
| இனங்காட்டிகள் | |||
| 13827-32-2 | |||
Beilstein Reference
|
7577656 | ||
| ChEBI | CHEBI:45822 | ||
| ChEMBL | ChEMBL1236102 | ||
| ChemSpider | 102805 | ||
Gmelin Reference
|
666 | ||
| யேமல் -3D படிமங்கள் | Image | ||
| ம.பா.த | sulfur+monoxide | ||
| பப்கெம் | 114845 | ||
SMILES
| |||
| பண்புகள் | |||
| SO | |||
| வாய்ப்பாட்டு எடை | 48.064 கி மோல்−1 | ||
| தோற்றம் | நிறமற்ற வாயு | ||
| வினைபுரியும் | |||
| மட. P | 0.155 | ||
| வெப்பவேதியியல் | |||
| Std enthalpy of formation ΔfH |
5.01கிலோயூல் மோல்−1 | ||
| நியம மோலார் எந்திரோப்பி S |
221.94 யூல் கெல்வின்−1 மோல்−1 | ||
மாறுதலாக ஏதும் சொல்லவில்லை என்றால் கொடுக்கப்பட்ட தரவுகள் யாவும் பொருள்கள் அவைகளின் இயல்பான வெப்ப அழுத்த நிலையில் (25°C, 100kPa) இருக்கும். | |||
| | |||
| Infobox references | |||
கந்தக மோனாக்சைடு (Sulfur monoxide) என்பது SO என்ற மூலக்கூற்று வாய்ப்பாட்டால் விவரிக்கப்படும் ஒரு கனிம வேதியியல் சேர்மமாகும். இது நீர்த்த வாயு நிலையில் மட்டுமே காணப்படுகிறது. செறிவூட்டப்படும்போது அல்லது அமுக்கப்படும்போது, அது டைகந்தக டையாக்சைடு S 2 O 2 ( disulfur டை ஆக்சைடு ) ஆக மாற்றப்படுகிறது. இது விண்வெளியில் கண்டறியப்பட்டுள்ளது, ஆனால் அரிதாகவே அப்படியே எடுத்துக்கொள்ளப்படுகிறது.
கட்டமைப்பு[தொகு]
கந்தக மோனாக்சைடு மூலக்கூறு ஆக்சிசனை ஒத்த மும்மடங்கு அடிப்படை நிலையைக் கொண்டுள்ளது, அதாவது ஒவ்வொரு மூலக்கூறும் இரண்டு இணைக்கப்படாத எலக்ட்ரான்களை கொண்டிருக்கும் [2]. S - O பிணைப்பு நீளம் 148.1 பைக்கோ மீட்டர் ஆகும் இது குறைந்த கந்தக ஆக்சைடுகளில் காணப்படுவதைப் போன்றது. S8O சேர்மத்தை இதற்கு எடுத்துக்காட்டாகக் கூறலாம். இதில் S - O பிணைப்பு நீளம் 148 பைக்கோமீட்டர்கள் ஆகும். ஆனால் 146 பைக்கோ மீட்டர் நீளம் கொண்ட வாயு நிலை S 2 O , 143.1 பைக்கோ மீட்டர் நீளம் கொண்ட வாயு நிலை SO 2 மற்றும் 142 பைக்கோ மீட்டர் நீளம் கொண்ட வாயு நிலை SO 3 ஆகியனவற்றின் பிணைப்பு நீளங்களை விட இது அதிகமாகும் [2]. இணை சேராதா எலக்ட்ரான்கள் ஏதுமில்லாத ஒற்றை நிலையில் அருகாமை அகச்சிவப்பு கதிர்வீச்சில் இம் மூலக்கூறு கிளர்வடைகிறது. முப்படியின் அடிப்படை நிலையை விட ஒற்றைநிலை அதிக வினைத்திறன் கொண்டிருக்குமென நம்பப் படுகிறது. இதுபோலவே ஆக்சிசனிலும் முப்படியின் அடிப்படை நிலையை விட ஒற்றைநிலை அதிக வினைத்திறன் கொண்டிருக்கிறது .[3].
தயாரிப்பு[தொகு]
கரிம தொகுப்பு வினைகளில் ஒரு வினையாக்கியான கந்தக மோனாக்சைடின் உற்பத்தியானது அதை வினைவிளை பொருளாக விடுவிக்கும் சேர்மங்களைப் பயன்படுத்துவதை மையமாகக் கொண்டுள்ளது. எடுத்துக்காட்டுகளில் ஒப்பீட்டளவில் எளிமையான மூலக்கூறு எத்திலீன் எபிசல்பாக்சைடின் :[4] சிதைவு வினை அடங்கும். இத்துடன் சிக்கலான டிரைசல்பைடு ஆக்சைடு (C10H6S3O)[5] சேர்மத்தையும் எடுத்துக்காட்டாக கூறலாம்.
- C2H4S=O → C2H4 + S=O
வினைகள்[தொகு]
SO மூலக்கூறு வெப்ப இயக்கவியல் ரீதியாக நிலையற்றது ஆகும். தொடக்கத்தில் இது S 2 O 2 சேர்மமாக மாற்றுகிறது [2]. ஆல்க்கீன்கள், ஆல்க்கைன்கள் மற்றும் டையீன்களில் கந்தக மோனாக்சைடு இணைந்து மூன்று உறுப்பு வளையங்களைக் கொண்ட கந்தகம் சேர்ந்த மூலக்கூறுகளை உருவாக்குகிறது [6].
ஆய்வக உற்பத்தி[தொகு]
ஆய்வகத்தில் கந்தக டை ஆக்சைடை கந்தக ஆவியுடன் சேர்த்து ஒளிர் மின்னிறக்கத்தில் சூடாக்கும்போது கந்தக மோனாக்சைடு தயாரிக்க முடியும் [7]. கரைந்திருக்கும் மந்த வாயுவைக் கொண்ட அடர் கந்தக அமிலத்தின் செறிவூட்டப்பட்ட ஒலிப்புலத்திற்கு உட்படுத்தப்பட்ட ஒற்றை குமிழில் கந்த மோனாக்சைடு கண்டறியப்பட்டுள்ளது [7]. கந்தகத்திற்கான வேதியோளிர்வு உணர்த்துக் கருவி கீழ்கண்ட வினைகளை அடிப்படையாகக் கொண்டுள்ளது [8]:
- SO + O3 → SO2(excited) + O2
- SO2(excited) → SO2 + hν
இடைநிலைத் தனிமங்களுக்கான ஈந்தணைவி[தொகு]
கந்தக மோனாக்சைடு ஓர் ஈந்தணைவியாக எண்ணற்ற வழிகளில் பிணைகிறது.
•ஒரு விளிம்பு நிலை ஈந்தணைவியாக , வளைந்த MOS திட்டத்தில் பிணைகிறது. எடுத்துக்காட்டாக டைட்டானியம் ஆக்சிபுளோரைடுடன் பிணைதல் :[9][10]. •வளைந்த M-S-O திட்டத்துடன் வளைந்த நைட்ரோசிலை ஒத்த பிணைப்பு [11]. •Fe 3 S (SO) (CO) 9 இல் உள்ளதைப் போல 2 அல்லது 3 உலோக மையங்களில் கந்தகம் வழியாக பாலம் அமைத்தல் பிணைப்பு •வனேடியம், நையோபியம் மற்றும் டாண்ட்டலம் ஆகியவற்றுடன் பக்கவாட்டு பிணைப்பு ref>Wei, Rui; Chen, Xiuting; Gong, Yu (2019). "Side-On Sulfur Monoxide Complexes of Tantalum, Niobium, and Vanadium Oxyfluorides". Inorganic Chemistry 58: 3807–3814. doi:10.1021/acs.inorgchem.8b03411.</ref>.
விண்வெளியில் கந்தக மோனாக்சைடு[தொகு]
வியாழனின் நிலவுகளில் ஒன்றான ஐஓ நிலவைச் சுற்றி கந்தக மோனாக்சைடு அவற்றின் வளிமண்டலங்களிலும் [12] பிளாசுமா பூந்தளத்திலும் [13] கண்டறியப்பட்டுள்ளது. வெள்ளி விண்மீனின் வளிமண்டலத்திலும்,[14] ஆலி-பாப் வால்நட்சத்திரத்திலும் [15] மற்றும் விண்மீன்களிடை ஊடகத்திலும் [16] இவ்வாயு கண்டறியப்பட்டுள்ளது.
ஐஓ நிலவின் மீது எரிமலை மற்றும் ஒளி வேதியியல் வழிகளால் கந்தக மோனாக்சைடு தயாரிக்கப்படும் என்று கருதப்படுகிறது. முதன்மையான ஒளி வேதியியல் வினைகள் பின்வருமாறு முன்மொழியப்படுகின்றன:
- O + S2 → S + SO
- SO2 → SO + O
அறியப்பட்ட மிகப்பெரிய நட்சத்திரமான என்.எம்.எல் சிக்னியில் கந்தக மோனாக்சைடு கண்டுபிடிக்கப்பட்டுள்ளது [17].
உயிரியலில் கந்தக மோனாக்சைடு[தொகு]
கந்தக மோனாக்சைடு சில உயிரியல் செயல்பாடுகளைக் கொண்டிருக்கலாம், பன்றியின் இரத்தக்குழாய் தமனியில் நிலையற்ற கந்தக மோனாக்சைடின் உருவாக்கம் வினை விளை பொருள்களிலிருந்து தயாரிக்கப்படுவதாக ஊகிக்கப்படுகிறது [18].
பாதுகாப்பு[தொகு]
நமது வளிமண்டலத்தில் கந்தக மோனாக்சைடு உருவாக்கம் ஓர் அரிதான நிகழ்வு என்பதாலும் நிலைப்புத்தன்மை இல்லாத காரணத்தாலும் இதன் ஆபத்துகளை முழுமையாக தீர்மானிப்பது கடினமாகும். ஆனால் அமுக்கி, சுருக்கும்போது, இது டைகந்தக டையாக்சைடாக மாறுகிறது. இது ஒப்பீட்டளவில் நச்சுத்தன்மை மற்றும் அரிக்கும் தன்மை கொண்டது. இந்த சேர்மம் மீத்தேனைப் போல எளிதில் தீப்பற்றி எரியக்கூடியது. எரிக்கப்படும்போது இது கந்தக டை ஆக்சைடு என்ற நச்சு வாயுவை உருவாக்குகிறது.
இரட்டை நேர்மின் அயனி[தொகு]
எக்சாமெத்தில்பென்சீன் முன்னிலையில் கந்தக டை ஆக்சைடு மீயமில நிபந்தனைகளில் புரோட்டானேற்றம் செய்யப்பட்டால் π- அணைவு C6(CH3)6SO2+ உருவாகிறது. SO2+ அயனியின் ஒரு பகுதி தடையில்லாத பென்சீன் வளையத்தின் மேல் நகர்கிறது. S-O பிணைப்பு நீளம் 1.424(2) ஆங்சிட்ராங்கு ஆகும்[19] .
டைகந்தக டையாக்சைடு[தொகு]


கந்தக மோனாக்சைடை டைகந்தக டையாக்சைடாக மாற்றலாம்.[20]. டைகந்தக டையாக்சைடு C2v சமச்சீருடன் சமதள கட்டமைப்பில் படிகமாகிறது. இதிலுள்ள S-O பிணைப்பு நீளம் 145.8 பைக்கோமீட்டர் ஆகும். இந்நீளம் ஒருமத்திலுள்ள பிணைப்பு நீளத்தைவிட குட்டையானது S-S பிணைப்பு நீளம் 202.45 பைக்கோ மீட்டர் ஆகும், இதேபோல OSS பிணைப்புக் கோணம் 112.7 பாகைகளாகும். மேலும் இதன் இருமுனைத் திருப்புத் திறன் அளவு 3.17 டி ஆகும்[20]
மேற்கோள்கள்[தொகு]
- ↑ "sulfur monoxide (CHEBI:45822)". Chemical Entities of Biological Interest. UK: European Bioinformatics Institute.
- ↑ 2.0 2.1 2.2 Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ). Butterworth-Heinemann. பன்னாட்டுத் தரப்புத்தக எண்:0080379419.
- ↑ Near-Infrared-Light-Induced Reaction of Singlet SO with Allene and Dimethylacetylene in a Rare Gas Matrix. Infrared Spectra of Two Novel Episulfoxides Salama F; Frei H J. Phys. Chem. 1989, 93, 1285-1292
- ↑ Sulfur Monoxide Chemistry. The Nature of SO from Thiirane Oxide and the Mechanism of Its Reaction with Dienes Chao P., Lemal D. M. Journal of the American Chemical Society 95,3: (1973) 920 எஆசு:10.1021/ja00784a049
- ↑ Grainger, Richard S.; Procopio, Alberto; Steed, Jonathan W. (2001). "A Novel Recyclable Sulfur Monoxide Transfer Reagent". Organic Letters 3 (22): 3565–3568. doi:10.1021/ol016678g. பப்மெட்:11678709.
- ↑ [1+2] Cycloadditions of Sulfur Monoxide (SO) to Alkenes and Alkynes and [1+4]Cycloadditions to Dienes (Polyenes). Generation and Reactions of Singlet SO? Juzo Nakayama, Yumi Tajima, Piao Xue-Hua, Yoshiaki Sugihara J. Am. Chem. Soc. 2007; volume 129, pp 7250 - 7251. எஆசு:10.1021/ja072044e
- ↑ 7.0 7.1 The temperatures of single-bubble sonoluminescence (A) Suslick K.S. and Flannigan D.J., The Journal of the Acoustical Society of America (2004) 116, 4, 2540.
- ↑ Chemical Mechanism and Efficiency of the Sulfur Chemiluminescence Detector Benner, R. L., Stedman, D. H. Applied Spectroscopy, 48, 7, (1994), 848-851எஆசு:10.1366/0003702944029901
- ↑ Schenk, W. A. (1987). Sulfur Oxides as Ligands in Coordination Compounds. Angewandte Chemie International Edition in English. 26. பக். 98-109. doi:10.1002/anie.198700981.
- ↑ Sulfur: Inorganic Chemistry Woollins JD, Encyclopedia of Inorganic Chemistry (1995), John Wiley and Sons ISBN 0-471-93620-0
- ↑ Wei, Rui; Chen, Xiuting; Gong, Yu (23 August 2019). "End-On Oxygen-Bound Sulfur Monoxide Complex of Titanium Oxyfluoride". Inorganic Chemistry 58 (17): 11801–11806. doi:10.1021/acs.inorgchem.9b01880.
- ↑ Io’s atmosphere: Not yet understood Lellouch, E. 1996. Icarus 124, 1–21.
- ↑ Detection of SO in Io's Exosphere Russell C.T., Kivelson M.G. Science (2000): 287, 5460, 1998–1999, எஆசு:10.1126/science.287.5460.1998
- ↑ International Ultraviolet Explorer observations of Venus SO2 and SO Na, Chan Y. ; Esposito, L.W. ; Skinner, T.E; Journal of Geophysical Research; 95 1990, 7485-7491
- ↑ New Molecular Species in Comet C/ 1995 O1 (Hale-Bopp) Observed with the Caltech S submillimeter Observatory D. C. Lis, D. M. Mehringer, D. Benford, M. Gardner, T. G. Phillips, D. Bockelée-Morvan, N. Biver, P. Colom, J. Crovisier, D. Despois and H. Rauer Earth, Moon, and Planets Volume 78, Numbers 1-3 / July, 1997 எஆசு:10.1023/A:1006281802554
- ↑ Observations of interstellar sulfur monoxide Gottlieb, C. A.; Gottlieb,E.W.; Litvak,M.M.; Ball,J.A.; Pennfield,H. Astrophysical Journal, 1, 219, (1978),77-94 எஆசு:10.1086/155757
- ↑ Kevin Marvel (19 December 1996). "NML Cygni". The Circumstellar Environment of Evolved Stars As Revealed by Studies of Circumstellar Water Masers. Universal-Publishers. பக். 182–212. பன்னாட்டுத் தரப்புத்தக எண்:978-1-58112-061-5. https://books.google.com/books?id=wwx1Gj5wR5QC&pg=PR182. பார்த்த நாள்: 23 August 2012.
- ↑ Identification of carbonyl sulfide and sulfur dioxide in porcine coronary artery by gas chromatography/mass spectrometry, possible relevance to EDHF Balazy M, Abu-Yousef IA, Harpp DN, Park J. Biochem Biophys Res Commun. November 21, 2003;311(3):728-34
- ↑ Malischewski, Moritz; Seppelt, Konrad (2017-12-04). "Isolation and Characterization of a Non-Rigid Hexamethylbenzene-SO2+ Complex" (in en). Angewandte Chemie International Edition 56 (52): 16495–16497. doi:10.1002/anie.201708552. பன்னாட்டுத் தர தொடர் எண்:1433-7851. பப்மெட்:29084371. https://hal.sorbonne-universite.fr/hal-01730776/file/so_angew_sans%20marque.pdf.
- ↑ 20.0 20.1 Spectroscopic studies of the SO2 discharge system. II. Microwave spectrum of the SO dimer Lovas F. J., Tiemann E., Johnson D.R. The Journal of Chemical Physics (1974), 60, 12, 5005-5010 எஆசு:10.1063/1.1681015

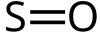

![{\displaystyle {\ce {C6(CH3)6 + SO2 + 3 HF + 3 AsF5 -> [C6(CH3)6SO] [AsF6]2 + [H3O] [AsF6]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/6180a066164bc36ff36bd854a7120604bb2858d2)