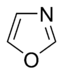
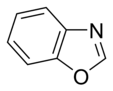
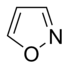
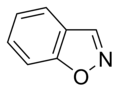
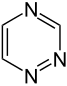
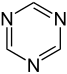
எளிய அரோமாட்டிக் வளையம்
எளிய அரோமாட்டிக் வளையங்கள் (Simple aromatic rings) என்பவை எளிய அரீன்கள் அல்லது எளிய அரோமாட்டிக்குகளைக் குறிக்கின்றன. அரோமாட்டிக் கரிமச் சேர்மங்களான இவை இணை சமதள வளைய அமைப்புகளால் ஆக்கப்பட்டுள்ளன. பல எளிய அரோமாட்டிக் வளையங்கள் சாதாரணமான பெயரையே கொண்டுள்ளன. பதிலீடு செய்யப்பட்ட சிக்கலான மூலக்கூறுகளின் அடித்தள அல்லது உட்புறக் கட்டமைப்புகளில் இவை காணப்படுகின்றன. பென்சீன், இண்டோல், சைக்ளோடெட்ராடெக்காயெப்டேன் போன்றவை சில எளிய அரோமாட்டிக் சேர்மங்களாகும்[1][2]. கார்பன் அல்லாத வளைய அணுக்களைப் பெற்றுள்ள நிலையில், எளிய அரோமாட்டிக் வளையங்களை பல்லினவளையங்களாக வகைப்படுத்த முடியும். ஆக்சிசன், நைட்ரசன், அல்லது கந்தகம் போன்றவற்றை உதாரணமாகக் கருதலாம். பென்சீன் போன்ற சேர்மத்தில் ஒற்றை வளையத்தையும், நாப்தலீன் போன்ற சேர்மங்களில் இரட்டை வளையத்தையும், ஆந்திரசீன் போன்ற சேர்மத்தில் பலவளையங்களாகவும் இவை அமைந்துள்ளன. மேலும், எளிய ஒற்றைவளைய அரோமாட்டிக் வளையங்கள் பொதுவாக பிர்ரோல் போன்ற ஐந்து உறுப்பினர் வளையமாக அல்லது பிரிடின் போன்ற ஆறு உறுப்பினர் வளையமாக அமைகின்றன. இணைந்த அரோமாட்டிக் வளையங்களில், ஒற்றை வளையங்கள் தங்களிடையே பிணைப்புகளைப் பங்கீடு செய்து கொள்கின்றன.
பல்லினவளைய அரோமாட்டிக் வளையங்கள்[தொகு]
| ||||||||||||||||||||||||||||||||||||||||||||||
எளிதாக புரோட்டானேற்றம் செய்து நைட்ரசனைக் (N) கொண்டிருக்கும் அரோமாட்டிக் வளையங்களை கார அரோமாட்டிக் வளையங்களாக பிரிக்க முடியும். இவை அரோமாட்டிக் நேர்மின் அயனிகளாகவும் உப்புகளாகவும் (பிரிடினியம்), காரமல்லாத அரோமாட்டிக் வளையங்களாகவும் உருவாகின்றன.
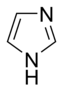
- கார அரோமாட்டிக் வளையங்களிலுள்ள தனி இணை எலக்ட்ரான்கள் அரோமாட்டிக் அமைப்பின் ஒரு பகுதியாக இல்லாமல் வளைய தளத்தில் நீட்சியடைந்துள்ளன. அமீன்களில் உள்ள நைட்ரசன் அணுக்களைப் போல இந்த தனி இணைகள் நைட்ரசன் அடங்கிய காரங்களுக்கு காரணமாகின்றன. இவ்வகைச் சேர்மங்களில் நைட்ரசன் அணு, ஐதரசன் அணுக்களுடன் இணைந்திருப்பதில்லை. பிரிடின் அல்லது குயினோலின் கார அரோமாட்டிக் வளையங்களுக்கு எடுத்துக்காட்டாகும். கார நைட்ரசன் அணுக்களையும், காரம் அல்லாத நைட்ரசன் அணுக்களையும் பல வளையங்கள் பெற்றுள்ளன. இமிடசோல் மற்றும் பியூரின் இதற்கான எடுத்துக்காட்டுகளாகும்.
- காரமல்லாத வளையங்களில் நைட்ரசனின் தனி இணை எலக்ட்ரான்கள் உள்ளடங்காமல், அரோமாட்டிக் பை எலக்ட்ரான்கள் அமைப்பிற்கு பங்களிக்கின்றன. இச்சேர்மங்களில் நைட்ரசன் அணு ஐதரசன் அணுக்களுடன் இணைந்துள்ளன. காரமல்லாத நைட்ரசனைக் கொண்டிருக்கும் அரோமாட்டிக் வளையங்களுக்கு பிர்ரோல் மற்றும் இண்டோல் சேர்மங்கள் எடுத்துக்காட்டுகளாகும்
- ஆக்சிசன் மற்றும் கந்தகத்தைக் கொண்டிருக்கும் அரோமாட்டிக் வளையங்களில் பல்லின அணுக்களின் தனி இணை எலக்ட்ரான்களில் ஒன்று, காரமல்லா நைட்ரசனைக் கொண்டிருக்கும் வளையத்தைப் போல அரோமாட்டிக் அமைப்பிற்கு பங்களிக்கின்றன. இரண்டாவது தனி இணை எலக்ட்ரான்கள் வளையத்தின் தளத்தில் கார நைட்ரசன் கொண்டிருக்கும் வளையத்தைப் போல நீட்சியடைந்துள்ளன.
அரோமாட்டிக் தன்மைக்கான நிபந்தனைகள்[தொகு]
மூலக்கூறு கண்டிப்பாக வளையமாக இருக்கவேண்டும்.
- வளையத்திலுள்ள ஒவ்வொரு அணுவும் கண்டிப்பாக அவற்றின் பி ஆர்பிட்டாலில் நிரம்பியதாக இருக்கவேண்டும். மேலும் ஏதவதொரு பக்கத்தில் பி ஆர்பிட்டாலுடன் மேற்பொருந்தியிருக்க வேண்டும்.
- கண்டிப்பாக மூலக்கூறு தளமூலக்கூறாக இருக்கவேண்டும்.
- ஒற்றைப்படையிலான எண்ணிக்கையில் பை- எலக்ட்ரான்களைக் கொண்டிருக்க வேண்டும். கண்டிப்பாக அக்கெல் விதியை பின்பற்ற வேண்டும்: (4n+2) பை எலக்ட்ரான்கள். இங்கு n என்பது சுழியில் தொடங்கும் முழு எண்ணாகும்.
மாறாக 4n பை எலக்ட்ரான்களைக் கொண்ட மூலக்கூறுகள் அரோமாட்டிக் தன்மைக்கு எதிராக உள்ளன.
மேற்கோள்கள்[தொகு]
- ↑ Clayden, J.; Greeves, N.; Warren, S.; Wothers, P. (2001). Organic Chemistry. Oxford, Oxfordshire: Oxford University Press. பன்னாட்டுத் தரப்புத்தக எண்:0-19-850346-6. http://www.organic-chemistry.org/books/reviews/0198503466.shtm.
- ↑ Eicher, T.; Hauptmann, S. (2003). The Chemistry of Heterocycles: Structure, Reactions, Syntheses, and Applications (2nd ). Wiley-VCH. பன்னாட்டுத் தரப்புத்தக எண்:3-527-30720-6. https://archive.org/details/chemistryofheter0000eich.