சீசியம் சல்பைடு
| |
| பெயர்கள் | |
|---|---|
| ஐயூபிஏசி பெயர்
சீசியம் சல்பைடு
| |
| இனங்காட்டிகள் | |
| 12214-16-3 | |
| ChemSpider | 22499401 |
InChI
| |
| யேமல் -3D படிமங்கள் | Image |
| பப்கெம் | 14496896 |
SMILES
| |
| பண்புகள் | |
| Cs2S | |
| வாய்ப்பாட்டு எடை | 297.876 |
| தோற்றம் | வெண்மை நிற படிகங்கள் |
| அடர்த்தி | 4.19 கிராம்.செ.மீ−3 |
| உருகுநிலை | 480 °செல்சியசு[1] |
| நீராற்பகுப்பில் சீசியம் பைசல்பைடு தோன்றும்[2] | |
| எத்தனால் மற்றும் கிளிசரால்-இல் கரைதிறன் | கரையும் |
| கட்டமைப்பு | |
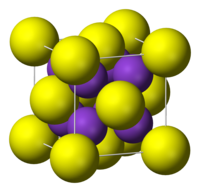
| படிக அமைப்பு | கனசதுரம், எதிர்-புளோரைட்டு |
| தீங்குகள் | |
| முதன்மையான தீநிகழ்தகவுகள் | நஞ்சு |
| GHS pictograms |  
|
| GHS signal word | அபாயம் |
| H314, H400 | |
| P260, P264, P273, P280, P301+330+331, P303+361+353, P304+340, P305+351+338, P310, P321, P363, P391, P405, P501 | |
| தொடர்புடைய சேர்மங்கள் | |
| ஏனைய எதிர் மின்னயனிகள் | சீசியம் ஆக்சைடு சீசியம் செலீனைடு சீசியம் தெலூரைடு சீசியம் பொலோனைடு |
| ஏனைய நேர் மின்அயனிகள் | இலித்தியம் சல்பைடு சோடியம் சல்பைடு பொட்டாசியம் சல்பைடு உருபீடியம் சல்பைடு பிரான்சியம் சல்பைடு |
மாறுதலாக ஏதும் சொல்லவில்லை என்றால் கொடுக்கப்பட்ட தரவுகள் யாவும் பொருள்கள் அவைகளின் இயல்பான வெப்ப அழுத்த நிலையில் (25°C, 100kPa) இருக்கும். | |
| Infobox references | |
சீசியம் சல்பைடு (Caesium sulfide) என்பது Cs2S என்ற மூலக்கூற்று வாய்ப்பாட்டால் விவரிக்கப்படும் ஒரு கனிம வேதியியல் சேர்மமாகும். நீரிய கரைசலில் இது ஓர் வலிமையான காரமாகச் செயல்படுகிறது. சீசியம் சல்பைடு காற்றில் அழுகிய முட்டையின் நாற்றத்தை உமிழ்கிறது.
தயாரிப்பு[தொகு]
சீசியம் மற்றும் கந்தகத்தை டெட்ரா ஐதரோ பியூரானில் வினைபுரியச் செய்து சோடியம் சல்பைடைப் போலவே நீரிலி சீசியம் சல்பைடையும் தயாரிக்கலாம். வினை நிகழ அமோனியா அல்லது நாப்தலீன் வினைக்கலவையுடன் சேர்க்கப்படவேண்டும்.[3]
- 2Cs + S → Cs2S
ஐதரசன் சல்பைடை சீசியம் ஐதராக்சைடு கரைசலில் கரைத்து சீசியம் பைசல்பைடை தயாரிக்க முடியும். பின்னர் இதிலிருந்தும் சீசியம் சல்பைடு கிடைக்கிறது.[4][5]。
- CsOH + H2S → CsHS + H2O
- CsHS + CsOH → Cs2S + H2O
மேற்கோள்கள்[தொகு]
- ↑ Dale L. Perry, Sidney L. Phillips: Handbook of inorganic compounds. CRC Press, 1995, ISBN 978-0-8493-8671-8, S. 336 ([1], p. 336, கூகுள் புத்தகங்களில்).
- ↑ Jean D'Ans, Ellen Lax: Taschenbuch für Chemiker und Physiker. 3. Elemente, anorganische Verbindungen und Materialien, Minerale, Band 3. 4. Auflage, Springer, 1997, ISBN 978-3-5406-0035-0, S. 692 ([2], p. 692, கூகுள் புத்தகங்களில்).
- ↑ J.-H. So and P. Boudjouk (1992). N. G. Russell. ed. "Hexamethyldisilathiane". Inorganic Syntheses: 30–32. doi:10.1002/9780470132609.ch11. பன்னாட்டுத் தரப்புத்தக எண்:9780470132609.
- ↑ Wilhelm Blitz, Ernst Wilke-Dörfurt: "Über Sulfide des Rubidiums und Cäsiums" in Zeitschr. f. anorg. Chem. 1906. 48, S. 297–317. Volltext
- ↑ R. Abegg, F. Auerbach: 'Handbuch der anorganischen Chemie'. Verlag S. Hirzel, Bd. 2, 1908. S. 430.Volltext
