டையெத்தில் அலுமினியம் சயனைடு

| |

| |
| பெயர்கள் | |
|---|---|
| ஐயூபிஏசி பெயர்
டையெத்தில் அலுமேனைல்பார்மோநைட்ரைல்
| |
| வேறு பெயர்கள்
சயனோடையெத்தில் அலுமினியம்
(சயனோ-κC)டையெத்தில்-அலுமினியம் (சயனோ-C)டையெத்தில்-அலுமினியம் சயனோடையெத்தில்-(7CI,8CI) அலுமினியம் சயனோடையெத்திலேன் சயனோடையெத்தில் அலுமினியம் டையெத்தில் அலுமினியம் சயனைடு | |
| இனங்காட்டிகள் | |
| 5804-85-3 | |
| பப்கெம் | 16683962 |
| பண்புகள் | |
| C 4H 10AlCN Et 2AlCN | |
| வாய்ப்பாட்டு எடை | 111.12 g mol−1 |
| தோற்றம் | அடர் பழுப்பு, தெளிவான நீர்மம் (1.0 மோல் லிட்டர்−1 தொலுயீனில்[1] |
| அடர்த்தி | 0.864 கி செ.மீ−3 (25 °செல்சியசு) பவெப்பநிலையில் நீர்மம் |
| கொதிநிலை | 162 °C (324 °F; 435 K) at 0.02 மி.மீ.பாதரசம் |
| பென்சீன்,தொலுயீன், டையைசோபுரோப்பைல் ஈதர் | |
| தீங்குகள் | |
| தீப்பற்றும் வெப்பநிலை | 7 °C (45 °F; 280 K) closed cup[1] |
மாறுதலாக ஏதும் சொல்லவில்லை என்றால் கொடுக்கப்பட்ட தரவுகள் யாவும் பொருள்கள் அவைகளின் இயல்பான வெப்ப அழுத்த நிலையில் (25°C, 100kPa) இருக்கும். | |
| | |
| Infobox references | |
டையெத்தில் அலுமினியம் சயனைடு (Diethylaluminum cyanide) என்பது ((C2H5)2AlCN)n. என்ற மூலக்கூற்று வாய்ப்பாட்டால் விவரிக்கப்படும் ஒரு கரிம அலுமினியம் சேர்மமாகும். இதை நாகாட்டா வினையாக்கி என்றும் கூறுவர்[2]. நிறமற்ற இச்சேர்மத்தை தொலுயீனில் கரைக்கப்பட்ட கரைசலாகவே இதை கையாளுவர். α,β-நிறைவுறா கீட்டோன்களை ஐதரோசயனேற்றம் செய்ய ஒரு வினையாக்கியாக இச்சேர்மம் பயன்படுத்தப்படுகிறது[1][3][4][5][6].
தயாரிப்பு[தொகு]
டிரையெத்தில் அலுமினியத்துடன் சற்று மிகையளவு ஐதரசன் சயனைடு சேர்த்து சூடுபடுத்தினால் டையெத்தில் அலுமினியம் சயனைடு உருவாகிறது. பொதுவாக நச்சுத்தன்மை மிகுந்த சேர்மமென்பதால் ஊசி மூலம் எடுக்கக்கூடிய சிறுசிறு கண்ணாடிச் சிமிழ்களில் இது சேமிக்கப்படுகிறது. தொலுயீன், பென்சீன், எக்சேன் மற்றும் ஐசோபுரோப்பைல் ஈதர் போன்ற கரைப்பான்களில் இது கரைகிறது. டையெத்தில் அலுமினியம் சயனைடு உடனடியாக நீராற்பகுப்புக்கு உட்படுகிறது. மற்றும் புரோட்டான் வழங்கும் :Et3Al + HCN → 1/n (Et2AlCN)n + EtH கரைப்பான்களுடன் இது இணக்கமாக இருக்காது.
கட்டமைப்பு[தொகு]
மற்ற டையார்கனைல் அலுமினியம் சயனைடுகள் ஆராயப்பட்டபோதிலும் டையெத்தில் அலுமினியம் சயனைடு எக்சுகதிர் படிகவியல் ஆய்வுகள் மூலம் ஆராயப்படவில்லை. டையார்கனைல் அலுமினியம் சயனைடுகள் (R2AlCN)n என்ற பொது மூலக்கூற்று வாய்ப்பாட்டைக் கொண்டுள்ளன. (n = 3) என்ற வளைய முப்படியாக அல்லது (n = 4) என்ற நாற்படியாக இங்கு இவை இடம்பெறுகின்றன. இந்த சில்படிமங்களில் AlCN---Al இணைப்பன்களை காணமுடியும். பிசு[டை(டிரைமெத்தில்சிலில்)மெத்தில்]அலுமினியம்சயனைடு ((Me3Si)2CH)2AlCN, என்ற அணைவுச் சேர்மம் டையெத்தில் அலுமினியம் சயனைடை ஒத்த சேர்மமாக உள்ளது. ஒரு முப்படியுடன் கூடிய கீழ்காணும் கட்டமைப்பில் இது காணப்படுவதாக படிகவியல் ஆய்வுகள் தெரிவிக்கின்றன:[4].
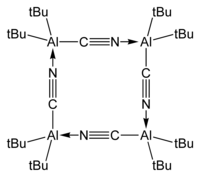
பிசு(டெர்ட்-பியூட்டைல்)அலுமினியம் சயனைடு tBu2AlCN படிகத்தன்மை கட்டத்தில் ஒரு நாற்படியாக கானப்படுவதாகவும் இந்த ஆய்வுகள் தெரிவிக்கின்றன:[7][8].
பயன்கள்[தொகு]
α,β-நிறைவுறா கீட்டோன்களை வேதிவினைக் கூறுகள் விகிதப்படி ஐதரோசயனேற்றம் செய்ய ஒரு வினையாக்கியாக இச்சேர்மம் பயன்படுத்தப்படுகிறது. கரைப்பானின் காரத்தன்மை இவ்வினையைப் பாதிக்கிறது. வினையாக்கியின் லூயிசு அமிலத்தன்மை பண்பின் காரணமாக இவ்விளைவு தோன்றுகிறது வினையின் நோக்கமே ஆல்க்கைல் நைட்ரைல்களை உருவாக்குவதே ஆகும். அமீன்கள், அமைடுகள், கார்பாக்சிலிக் அமிலங்கள், எசுத்தர்கள், ஆல்டிகைடுகள் போன்ற கரிமச் சேர்மங்களை தயாரிப்பதற்கு இந்நைட்ரைல்கள் முன்னோடிச் சேர்மங்களாகப் பயன்படுகின்றன.
மேற்கோள்கள்[தொகு]
- ↑ 1.0 1.1 1.2 "MSDS - 276863". Sigma-Aldrich. பார்க்கப்பட்ட நாள் December 9, 2012.
- ↑ Nagata, W (1988). "Diethylaluminum cyanide". Organic Syntheses VI: 307. doi:10.15227/orgsyn.052.0090.
- ↑ Nagata, W. (1966). "Alkylaluminum cyanides as potent reagents for hydrocyanation". Tetrahedron Lett. 7 (18): 1913–1918. doi:10.1016/S0040-4039(00)76271-X.
- ↑ 4.0 4.1 Uhl, Werner; Schütz, Uwe; Hiller, Wolfgang; Heckel, Maximilian (1995). "Synthese und Kristallstruktur des trimeren [(Me3Si)2CH]2Al—CN". Z. anorg. allg. Chem. 621 (5): 823–828. doi:10.1002/zaac.19956210521.
- ↑ Wade, K.; Wyatt, B. K. (1969). "Reactions of organoaluminium compounds with cyanides. Part III. Reactions of trimethylaluminium, triethylaluminium, dimethylaluminium hydride, and diethylaluminium hydride with dimethylcyanamide". J. Chem. Soc.: 1121–1124. doi:10.1039/J19690001121.
- ↑ Coates, G. E.; Mukherjee, R. N. (1963). "35. Dimethylaluminium cyanide and its gallium, indium, and thallium analogues; beryllium and methylberyllium cyanide". J. Chem. Soc.: 229–232. doi:10.1039/JR9630000229.
- ↑ Uhl, W.; Matar, M. (2004). "Hydroalumination of nitriles and isonitriles". Z. Naturforsch. B 59 (11–12): 1214–1222. http://www.znaturforsch.com/ab/v59b/59b1214.pdf.
- ↑ Uhl, W.; Schütz, U.; Hiller, W.; Heckel, M. (2005). "Synthese und Kristallstruktur des trimeren [(Me3Si)2CH]2Al—CN". Z. Naturforsch. B 60 (2): 155–163. http://www.znaturforsch.com/ab/v60b/60b0155.pdf.

![trimeric bis[di(trimethylsilyl)methyl]aluminium cyanide](http://upload.wikimedia.org/wikipedia/commons/thumb/8/8f/Cyclo-%28%28%28Me3Si%292CH%292AlCN%293-2D.png/300px-Cyclo-%28%28%28Me3Si%292CH%292AlCN%293-2D.png)