பதிலீட்டு வினைகள்
பதிலீட்டு வினைகள் ( ஒற்றை இடப்பெயர்ச்சி வினை அல்லது ஒற்றை பதிலீட்டு வினை எனவும் அழைக்கப்படுகின்றன) ஒரு இரசாயன வினை. இதில் ஒரு வேதிச்சேர்மத்தில் உள்ள வினைபடுத் தொகுதி மற்றொரு வினைபடுதொகுதியால் [1][2] மாற்றப்படுகின்றன. கரிம வேதியியல் பதிலீட்டு வினைகள் முக்கியமானதாக உள்ளன. கரிம வேதியியலில் பதிலீட்டு வினைகள் எலக்ட்ரான்கவர் பதிலீட்டு வினைகள் மற்றும் கருக்கவர் பதிலீட்டு வினைகள் என்று வகைப்படுத்தப்பட்டுள்ளன. இவைகள் வினையில் ஈடுபடும் வினைபடுபொருட்களைப் பொறுத்தே அமைகின்றன. அங்கு பிற பிரிவுகள், அதே போல் மற்றவை கீழே குறிப்பிடப்பட்டுள்ளன.
ஆலசனேற்ற வினைகள் பதிலீட்டு வினைகளுக்கு ஒரு சிறந்த உதாரணமாக உள்ளது. குளோரின் வாயு (Cl-Cl) மூலக்கூறுகளை, கதிரியக்கத்திற்கு உட்படுத்தும் போது, சில மூலக்கூறுகள் குளோரின் உறுப்புகளாக(Cl.) மாறுகின்றன. இதன் தனித்த எல்கட்ரான்கள் வலிமையான கருக்கவர் காரணியாக உள்ளன. வலிமை குறைந்த C-H சகப்பிணைப்பு உடைக்கப்படுகிறது. மேலும், விடுவிக்கப்பட்ட புரோட்டானுடன் இணைந்து மின்நடுநிலை வாய்ந்தH-Cl பிணைப்பு உருவாகிறது. CH3. உள்ள சகப்பிணைப்புள் மற்ற உறுப்புகளால் மாற்றப்பட்டு CH3Cl (மெத்தீல் குளோரைடு) உருவாகிறது.
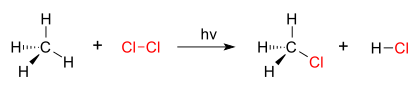
|
| மீத்தேன், குளோரின் மூலம் குளோரினேற்றம் அடைதல் |
|---|
கருக்கவர் பதிலீடு[தொகு]
கனிம மற்றும் கரிம வேதியியலில், கருக்கவர் பதிலீட்டு வினை ஒரு அடிப்படை வினையாகும். நேர்மின் சுமை கொண்ட அணுக்கள் அல்லது பகுதியளவு நேர்மின் சுமை கொண்ட அணுக்களுடன் தாக்குதல் நடத்தி கருக்கவர் பிணைப்பு ஏற்படுகிறது. வலுகுறைந்த கருக்கவர் காரணி விடுபடு தொகுதியாக விடுவிக்கப்படுகிறது. மீதமுள்ள நேர்மின்சுமை அல்லது பகுதியளவு நேர்மின்சுமை பெற்றுள்ள அணுக்கள் கருக்கவர் காரணியாகின்றன. கருக்கவர் மற்றும் விடுபடுதொகுதி இவைகள் வினைபொருளாக பங்குபெறுகின்றன.
இவ்வினையின் மிகவும் பொதுவான வடிவம் கீழே கொடுக்கப்பட்டுள்ளது.இங்கு R-LG என்பது வினைப்பொருளைக் குறிக்கிறது.
- Nuc: + R-LG → R-Nuc + LG:
கார நிலையில், அல்கைல் புரோமைடு நீரார்பகுப்பு வினை கருக்கவர் பதிலீட்டு வினைக்கு உதாரணமாகும்.இங்கு OH− என்பது தாக்ககூடிய கருக்கவர்காரணி மற்றும் Br− என்பது டுபடும் தொகுதி.
- R-Br + OH− → R-OH + Br−
வினைவழி முறைகள்[தொகு]
இப்பதிலீட்டு வினைகள் இரண்டு வெவ்வேறான வினைவழி முறைகளைக் கொண்டுள்ளன. அவை, ஒரு மூலக்கூறு கருக்கவர் பதிலீட்டு வினைகள் (SN1) மற்றும் இரு மூலக்கூறு பதிலீட்டு வினைகள் (SN2).
SN1, வழிமுறை இரண்டு படிகள் உள்ளன. முதல் படியில், விடுபடு தொகுதி விடுபட்டு கார்போனியம் அயனி அல்லது கார்பன் நேரயணி C+ உருவாகிறது..இரண்டாவது படியில், கருக்கவர் வினைபொருள் Nuc:) கார்பன் நேர் அயனியைத் தாக்கி சகப்பிணைப்பு சிக்மா பிணைப்புகளை உருவாக்குகிறது. வினைபொருள் சமச்சீரற்ற கார்பன் அணுக்களைக் கொண்டிருந்தால், முப்பரிமான மாற்றி வேதியியலில் நிலையான கட்டமைப்பை தருகின்றன. விளைவாக சுழிமாய்கலவை ஏற்படுகிறது.
மூவிணைய பியுட்டைல் புரோமைடின் நீரார்பகுப்பு வினை SN1 வினைக்கான எடுத்துகாட்டாகும்.
SN2 வழிமுறை ஒரு படியில் நடைபெறுகிறது. கருக்கவர் தாக்குதல் மற்றும் விடுபடு தொகுதி வெளியேற்றம் இரண்டும் ஒரே நேரத்தில் நடக்கும். இதன் முடிவுகள் தலைகீழ் கட்டமைப்பைக் கொண்டுள்ளன.
சமச்சீரற்ற கார்பன் வினைப்பொருள் கருக்கவர் தாக்குதலுக்கு உட்படுகிறது. முப்பரிமான மாற்றிய வேதியியலில் இத்தலைகீழ் மாற்றம் வால்டன் தலைகீழ்மாற்றம் என்றழைக்கப்படுகிறது.
குளோரோஈத்தேன், புரோமீனுடன் நீரார்பகுப்படையும் வினை SN2 வினைக்கு எடுத்துக்காட்டாகும்.
எலக்ட்ரான்கவர் பதிலீடு[தொகு]
எலக்ட்ரான் கவர் பதிலீட்டு வினைகளில் எலக்ட்ரான் கவர் காரணி ஈடுபடுகிறது. குறிப்பாக கருக்கவர் அரோமேடிக் பதிலீடுகள்.
எலக்ட்ரான் கவர் காரணி ஆல் பென்சீன் வளையத்தில் உள்ள எலக்ட்ரான் ஒத்திசைவு வடிவம் தாக்கப்படுகிறது. ஒத்திசைவு பிணைப்பு உடைந்து கார்பன் நேர்மின் அயனி ஒத்திசைவு வடிவம் கிடைக்கிறது. இறுதியாக புரோட்டான் வெளியேற்றப்பட்டு ஒரு புதிய அரோமேடிக் சேர்மம் உருவாகிறது.
| எலக்ட்ரான்கவர் அரோமேடிக் சேர்மம் |
|---|
உறுப்பு பதிலீடு[தொகு]
உறுப்பு பதிலீட்டு வினையில் உறுப்புகள் பங்குபெறுகின்றன. ஒரு உதாரணம் அன்சுடிக்கர் வினை.
கரிமஉலோக பதிலீடு[தொகு]
இணைப்பு வினைகளில் கரிமஉலோகச் சேர்மங்கள் ஈடுபடுகின்றன. கரிம உலோகச் சேர்மம் RM மற்றும் ஒரு கரிம ஆலைடு R X இவை இரண்டும் இணைந்து R-R'என்ற புதிய சேர்மத்தைத் தருகின்றன. இதில் புதிதாக கார்பன்-கார்பன் பிணைப்பு உருவாக்கப்படுகின்றது. இதற்கான உதாரணங்கள் ஹெக் வினை, உல்மன் வினை, மற்றும் உர்ட்சு-பிட்டிக் வினை வினை. பல வேறுபாடுகளும் உள்ளன.[3]
பதிலீட்டுச் சேர்மங்கள்[தொகு]
பதிலீட்டுச் சேர்மங்கள் ஒரு வேதிச் சேர்மங்கள் ஆகும். பெரியளவில் பதிலீடு செய்யப்பட்ட தொகுதிகள் அல்லது அல்கைல், ஐதராக்சைல் அல்லது ஆலசன் போன்ற வினைபடு தொகுதிகளைக் கொண்டுள்ள சேர்மங்களால் ஒன்று அல்லது ஒன்றுக்கு மேற்பட்ட ஹைட்ரஜன் அணுக்கள் மைய அமைப்பில் இருந்து மாற்றப்படுகின்றன.
உதாரணமாக, பென்சீன் ஒரு எளிய அரோமேடிக் வளையம் கொண்டச் சேர்மம். பல்லீனச் சேர்மங்களைக் கொண்டத் தொகுதிகளுடன் பென்சீன்கள் பதலீட்டு வினைக்கு உட்பட்டுகின்றன. இவற்றின் பண்புகளால் இவை பரவலாகப் பயன்படுத்தப்படுகின்றன.
| பதிலீடு பென்சீன் சேர்மங்களுக்கு உதாணங்கள் | ||
| சேர்மம் | வாய்ப்பாடு | அமைப்பு |
| பென்சீன் | இ6H6 | 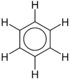 |
| Toluene | இ6H5-CH3 | |
| o-Xylene | C6H4(-CH3)2 | 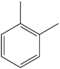 |
| Mesitylene | C6H3(-CH3)3 |  |
| பினாயில் | இ6H5-ஓ | 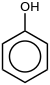 |
மேற்கோள்கள்[தொகு]
- ↑ March, Jerry (1985), Advanced Organic Chemistry: Reactions, Mechanisms, and Structure (3rd ed.), New York: Wiley, ISBN 0-471-85472-7
- ↑ Imyanitov, Naum S. (1993). "Is This Reaction a Substitution, Oxidation-Reduction, or Transfer?". J. Chem. Educ. 70 (1): 14–16. doi:10.1021/ed070p14. Bibcode: 1993JChEd..70...14I. https://archive.org/details/sim_journal-of-chemical-education_1993-01_70_1/page/14.
- ↑ Elschenbroich, C.; Salzer, A. (1992). Organometallics: A Concise Introduction (2nd ). Weinheim: Wiley-VCH. பன்னாட்டுத் தரப்புத்தக எண்:3-527-28165-7.

