குளோரைடு செயல்முறை
குளோரைடு செயல்முறை (Chloride process) என்பது தைட்டானியத்தை அதன் தாதுக்களில் இருந்து பிரிக்க பயன்படும் ஒரு முறையாகும். இந்தச் செயல்முறையில் ஊட்டு மூலப்பொருள் கார்பன் மற்றும் குளோரின் வாயுவுடன் 1000 பாகை செல்சியசு வெப்பநிலைக்கு சூடுபடுத்தப்படுகிறது. இதனால் முதலில் தைட்டானியம் டெட்ரா குளோரைடு உருவாகிறது. இல்மனைட்டு தாதுவில் இருந்து குறிப்பாக இம்மாற்றம் தொடங்குகிறது :[1]
- 2 FeTiO3 + 7 Cl2 + 6 C → 2 TiCl4 + 2 FeCl3 + 6 CO
இந்த செயல்முறை உயர்வெப்பக்கார்பன் வினையின் மாறுபாடு ஆகும். இவ்வினை கார்பனின் குறைக்கும் சக்தியைப் பயன்படுத்துகிறது.
மற்ற அசுத்தங்கள் அதனுடன் தொடர்புடைய குளோரைடுகளாக மாற்றப்படுகின்றன, ஆனால் அவை TiCl4 சேர்மத்தை விட குறைவாகவே ஆவியாகின்றன. தைட்டானியம் டெட்ராகுளோரைடு வடித்தல்முறை மூலம் சுத்தப்படுத்தப்படுகிறது. ஆக்சிசன் சுடர் அல்லது பிளாசுமாவில் தொடர்ந்து ஆக்சிசனேற்றம் செய்வதன் மூலம் தூய தைட்டானியம் டையாக்சைடை பெறலாம் [2][3].
- TiCl₄ + O₂ + heat → TiO₂ + 2Cl₂
இம்முறையில் மறுசுழற்சிக்குத் தேவையான குளோரின் பெறப்படுகிறது.
தரமான செயல்முறை[தொகு]
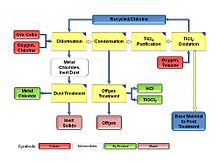
தைட்டானியம் டையாக்சைடுக்கான தரமான செயல்முறையின் அடிப்படை பொருட்கள் பின்வரும் முக்கிய உற்பத்தி அலகுகளைக் கொண்டுள்ளன:[4].
- ஆக்சிசனேற்றம்
- குளோரினேற்றம்
- ஒடுக்கம்
- தூய்மையாக்கல்
பின்வரும் துணை அலகுகளும் இச்செயல்முறைக்கு அவசியமானவையாகும்.
- தாது/கற்கரி சேமிப்பு
- வாயு விலகிய சூடாக்கல்
- தூசு சிகிச்சை
நிலையான நிபந்தனைகளின் கீழ் குளோரைடு செயல்முறை ஒரு தொடர்ச்சியான சுழற்சிமுறையாகும். இதில் ஆக்சிசனேற்ற நிலையிலிருந்து குளோரின் ஒடுக்க நிலைக்கும் ஒடுக்க நிலையிலிருந்து ஆக்சிசனேற்ற நிலைக்கும் தலைகீழாக மாறுகிறது. குளோரின் மூலக்கூற்று நிலையில் இருப்பது ஆக்சிசனேற்ற வடிவமாகும். தைட்டானியம் டெட்ராகுளோரைடாக (TiCl4) இருப்பது ஒடுக்க நிலையாகும். மூலக்கூற்று ஆக்சிசன் ஆக்சிசனேற்ற முகவராகவும், கற்கரி ஒடுக்க முகவராகவும் செயல்படுகின்றன. இரண்டும் இச்செயல்முறைக்குள் செலுத்தப்படுகின்றன. அவ்வாறே ஆக்சைடுகளின் கலவையான தைட்டானியம் தாதுவும் கற்கரியுடன் சேர்க்கப்பட்டு செலுத்தப்படுகிறது. வினைக்காக சேர்க்கப்பட்ட ஆக்சிசன் விளைபொருள் TiO2 உடன் செயல்முறையிலிருந்து வெளியேறுகிறது. கற்கரியும் கார்பனோராக்சைடு மற்றும் கார்பனீராக்சைடு வடிவில் செயல்முரையிலிருந்து வெளியேறுகிறது. செயல்முறைக்குள் செலுத்தப்பட்ட இதரப் பொருட்கள் உலோக குளோரைடுகளாக வெளியேறுகின்றன[5].
மேற்கோள்கள்[தொகு]
- ↑ Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ). Butterworth–Heinemann. பன்னாட்டுத் தரப்புத்தக எண்:0080379419.
- ↑ "The TiO2 Process". Ti-Cons. Archived from the original on 2016-12-20. பார்க்கப்பட்ட நாள் 2016-12-17.
- ↑ Jones, Tony; Egerton, Terry A. (2000). "Titanium Compounds, Inorganic" (in en). Kirk-Othmer Encyclopedia of Chemical Technology. John Wiley & Sons, Inc.. doi:10.1002/0471238961.0914151805070518.a01.pub3. பன்னாட்டுத் தரப்புத்தக எண்:9780471238966. http://onlinelibrary.wiley.com/doi/10.1002/0471238961.0914151805070518.a01.pub3/abstract.
- ↑ "Manufacture and General Properties of Titanium Dioxide Pigments" (PDF). Ti-Cons. Archived from the original (PDF) on 2011-01-24. பார்க்கப்பட்ட நாள் 2012-04-11.
- ↑ "The Details of the TiO2 Process" (PDF). Ti-Cons. Archived from the original (PDF) on 2016-12-20. பார்க்கப்பட்ட நாள் 2012-04-11.
புற இனைப்புகள்[தொகு]
- "Chloride Process". KRONOS Worldwide, Inc. பார்க்கப்பட்ட நாள் 2007-09-05.
- "The Chloride Process from Ti-Cons". Ti-Cons Jendro, Weiland und Partner. Archived from the original on 2016-03-07. பார்க்கப்பட்ட நாள் 2010-06-16.
