பியூரான்
| |||
| பெயர்கள் | |||
|---|---|---|---|
| விருப்பத்தெரிவு ஐயூபிஏசி பெயர்
பியூரான்[2] | |||
| முறையான ஐயூபிஏசி பெயர்
ஆக்சோல் 5-ஆக்சாவளையபென்டா-1,3-டையீன் 5-ஆக்சாவளைய-1,3-பென்டாடையீன் 1,4-ஈபாக்சிபியூட்டா-1,3-டையீன் 1,4-ஈபாக்சி-1,3-பியூட்டாடையீன் | |||
| வேறு பெயர்கள் | |||
| இனங்காட்டிகள் | |||
| 110-00-9 | |||
| ChEBI | CHEBI:35559 | ||
| ChEMBL | ChEMBL278980 | ||
| ChemSpider | 7738 | ||
| யேமல் -3D படிமங்கள் | Image | ||
| KEGG | C14275 | ||
| பப்கெம் | 8029 | ||
SMILES
| |||
| பண்புகள் | |||
| C4H4O | |||
| வாய்ப்பாட்டு எடை | 68.08 g·mol−1 | ||
| தோற்றம் | நிறமற்றது, ஆவியாகக்கூடிய நீர்மம் | ||
| அடர்த்தி | 0.936 கி/மிலி | ||
| உருகுநிலை | −85.6 °C (−122.1 °F; 187.6 K) | ||
| கொதிநிலை | 31.3 °C (88.3 °F; 304.4 K) | ||
| -43.09·10−6செமீ3/மோல் | |||
| தீங்குகள் | |||
| பொருள் பாதுகாப்பு குறிப்பு தாள் | Pennakem | ||
| R-சொற்றொடர்கள் | R26/27/28, R45 | ||
| S-சொற்றொடர்கள் | S16, S37, S45, S28 | ||
| தீப்பற்றும் வெப்பநிலை | −69 °C (−92 °F; 204 K) | ||
Autoignition
temperature |
390 °C (734 °F; 663 K) | ||
| வெடிபொருள் வரம்புகள் | கீழ்நிலைr: 2.3% உயர்நிலை: 14.3% at 20 °செ | ||
| Lethal dose or concentration (LD, LC): | |||
LD50 (Median dose)
|
> 2 g/kg (rat) | ||
மாறுதலாக ஏதும் சொல்லவில்லை என்றால் கொடுக்கப்பட்ட தரவுகள் யாவும் பொருள்கள் அவைகளின் இயல்பான வெப்ப அழுத்த நிலையில் (25°C, 100kPa) இருக்கும். | |||
| | |||
| Infobox references | |||
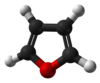
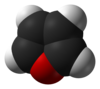
பியூரான் (Furan) ஒரு பல்லின வளைய கரிமச் சேர்மம் ஆகும். கரிம வளையத்தின் ஐந்து பகுதிகளில் நான்கு கார்பன் அணுக்களையும் ஒரு ஆக்சிசன் அணுவினையும் கொண்டுள்ளது. இவ்வாறான வளையங்ளைக் கொண்ட கரிமச்சேர்மங்கள் பியூரான்கள் என குறிப்பிடப்படுகின்றன.
பியூரான் ஒரு நிறமற்ற, தீப்பற்றக்கூடிய, உயர்ந்தளவு ஆவியாகக்கூடிய நீர்மம். இதன் கொதிநிலை புள்ளி அறை வெப்பநிலைக்கு நெருக்கமாக உள்ளது. ஆல்ககால், ஈதர், மற்றும் அசிட்டோன் போன்ற கரிமச்சேர்மங்களில் கரைகிறது. சிறிதளவு நீரில் கரைகிறது.[3] நச்சுத்தன்மை உடையது மற்றும் மனிதர்களுக்கு புற்றுநோயை உண்டாக்ககூடியது. மற்ற வேதிச்சேர்மங்களுக்கு ஒரு தொடக்கப் புள்ளியாக பயன்படுத்தப்படுகிறது.
தயாரிப்பு [தொகு]
தொழில்முறையில், ஃபர்புரால் பல்லேடியம் வினையூக்கி முன்னிலையில் கார்பனைல் நீக்கம் நடைபெற்று (அல்லது) 1,3-பியூட்டாடையீன் காப்பர் முன்னிலையில் ஆக்சிஜனேற்றமடைந்து பியூரான் கிடைக்கிறது.
மேலும் காண்க[தொகு]
மேற்கோள்கள்[தொகு]
- ↑ Webster's Online Dictionary
- ↑ Nomenclature of Organic Chemistry : IUPAC Recommendations and Preferred Names 2013 (Blue Book). Cambridge: வேதியியலுக்கான வேந்திய சங்கம். 2014. பக். 392. doi:10.1039/9781849733069-FP001. பன்னாட்டுத் தரப்புத்தக எண்:978-0-85404-182-4.
- ↑ Jakubke, Hans Dieter; Jeschkeit, Hans (1994). Concise Encyclopedia of Chemistry. Walter de Gruyter. பக். 1–1201. பன்னாட்டுத் தரப்புத்தக எண்:0-89925-457-8.